Новый алгоритм стресс-эхокардиографии с аденозинтрифосфатом
РезюмеНеласов Н.Ю., Моргунов М.Н., Сидоров Р.В., Долтмурзиева Н.С., Ерошенко О.Л., Арзуманян Э.А., Кренева Е.Л., Шлык С.В.
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, пер. Нахичеванский, 29, Ростов-на-Дону, 344022, Российская Федерация
Неласов Николай Юлианович, д. м. н., профессор, заведующий кафедрой ультразвуковой диагностики; orcid.org/0000-0003-2208-8042
Моргунов Максим Николаевич, к. м. н., ассистент кафедры ультразвуковой диагностики;
orcid.org/0000-0002-6238-9782
Сидоров Роман Валентинович, д. м. н., заведующий отделением кардиохирургии клиники РостГМУ; orcid.org/0000-0001-9136-4886
Долтмурзиева Наталья Сослановна, ассистент кафедры кардиологии, ревматологии и функциональной диагностики, врач отделения кардиохирургии клиники РостГМУ;
orcid.org/0000-0003-2670-2679
Ерошенко Ольга Леонидовна, к. м. н., доцент кафедры ультразвуковой диагностики;
orcid.org/0000-0002-6501-0731
Арзуманян Эмиль Альбертович, аспирант кафедры ультразвуковой диагностики;
orcid.org/0000-0002-5210-4114
Кренева Екатерина Леонидовна, врач отделения реанимации № 1 и отделения ультразвуковой диагностики клиники РостГМУ; orcid.org/0000-0002-6807-4933
Шлык Сергей Владимирович, д. м. н., профессор, заведующий кафедрой терапии;
orcid.org/0000-0003-4909-7897
Цель. Известно, что при проведении кардиальных стресс-тестов и монотонном интракубитальном введении аденозинтрифосфата (АТФ) в дозе 140-160 мкг/кг/мин субмаксимальная миокардиальная гиперемия не достигается в 16-18% случаев. Нами поставлена задача разработать новый алгоритм стресс-эхокардиографии (СЭхоКГ) с АТФ, предусматривающий возможность ступенеобразного повышения дозировки препарата, а также протестировать его у здоровых лиц и пациентов с ишемической болезнью сердца (ИБС).
Материал и методы. Разработка нового алгоритма СЭхоКГ выполнена на основе анализа основных научных баз данных и первого собственного опыта применения АТФ при СЭхоКГ Ключевые положения нового алгоритма: а) нагрузочная проба состоит из трех этапов (ЭхоКГ-данные должны регистрироваться до инфузии АТФ, во время нее и через 5 мин после ее окончания); б) критерием достижения субмаксимальной миокардиальной гиперемии при введении АТФ является снижение систолического артериального давления (САД) на 5 мм рт. ст. и более; в) запись ЭхоКГ на 2-м этапе пробы обычно осуществляется через 3 мин от начала введения АТФ и при наличии снижения САД; г) начальная доза введения АТФ — 140 мкг/кг/мин, если на 3-й минуте введения препарата САД не снижается, дозировка должна увеличиться сначала до 175 мкг/кг/мин на 1 мин, а при отсутствии эффекта — до 210 мкг/кг/мин еще на 2-3 мин. Тестирование алгоритма проведено у 9 здоровых добровольцев и 26 больных ИБС.
Результаты. При тестировании нового алгоритма во всех случаях была достигнута субмаксимальная миокардиальная гиперемия. У 2 пациентов САД снизилось ниже 90 мм рт. ст., у 1 больного развилась атриовентрикулярная блокада 2-й ст., однако простое снижение скорости инфузии АТФ в течение 30 с нивелировало эту симптоматику. У всех обследованных удалось зарегистрировать СЭхоКГ-данные, приемлемые для последующего анализа сократимости и деформации миокарда.
Выводы. Новый алгоритм СЭхоКГ с АТФ эффективен при регистрации ЭхоКГ-данных. С целью окончательного решения вопроса о безопасности и информативности нового протокола нагрузочной пробы можно рекомендовать его дальнейшее тестирование на больших группах пациентов при СЭхоКГ и при использовании других визуализирующих методик оценки сократимости и перфузии миокарда.
Ключевые слова: стресс-эхокардиография; аденозинтрифосфат; деформация миокарда.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Для цитирования: Неласов Н.Ю., Моргунов М.Н., Сидоров Р.В., Долтмурзиева Н.С., Ерошенко О.Л., Арзуманян Э.А., Кренева Е.Л., Шлык С.В. Новый алгоритм стресс-эхокардиографии с аденозинтрифосфатом. Вестник рентгенологии и радиологии. 2020; 101(5): 288-95. https://doi.org/10.20862/0042-4676-2020-101-5-289-295
Статья поступила 24.06.2020
После доработки 15.07.2020
Принята к печати 16.07.2020
New Algorithm of Stress Echocardiography with Adenosine TriphosphateAbstractNikolay Yu. Nelassov, Maksim N. Morgunov, Roman V. Sidorov, Natalya S. Doltmurzieva, Olga L. Eroshenko, Emil A. Arzumanjan, Ekaterina L. Kreneva, Sergey V. Shlyk
Rostov State Medical University, Ministry of Health of the Russian Federation, Nakhichevan’skiy pereulok, 29, Rostov-on-Don, 344022, Russian Federation
Nikolay Yu. Nelassov, Dr. Med. Sc., Professor, Chief of Chair;
orcid.org/0000-0005-2208-8042
Maksim N. Morgunov, Cand. Med. Sc., Assistant Professor;
orcid.org/0000-0002-6258-9782
Roman V. Sidorov, Dr. Med. Sc., Head of Department;
orcid.org/0000-0001-9156-4886
Natalya S. Doltmurzieva, Assistant Professor;
orcid.org/0000-0005-2670-2679
Olga L. Eroshenko, Cand. Med. Sc., Associate Professor;
orcid.org/0000-0002-6501-0751
Emil A. Arzumanjan, Postgraduate;
orcid.org/0000-0002-5210-4114
Ekaterina L. Kreneva, Anesthesiologist;
orcid.org/0000-0002-6807-4955
Sergey V. Shlyk, Dr. Med. Sc., Professor, Chief of Chair;
orcid.org/0000-0005-4909-7897
Objective. Submaximal myocardial hyperemia is known not to be achieved in 16-18% of cases during cardiac stress tests and monotonic intracubital administration of adenosine triphosphate (ATP) at a dose of 140-160 pg/kg/min. The authors set a task to elaborate a new algorithm for stress echocardiography (SEchoCG) with ATP, providing for the possibility of a stepwise increase in the dosage of the drug, as well as to test it in healthy individuals and patients with coronary heart disease (CHD).
Material and methods. The authors elaborated a new algorithm for SEchoCG on the basis of an analysis of the main science databases and their first own experience in using ATP during SEchoCG. The key provisions of the new algorithm were: (a) the exercise test consisted of 3 stages (EchoCG data should be recorded before, during, and 5 minutes after ATP infusion); (b) the criterion for achieving submaximal myocardial hyperemia during ATP administration is a systolic blood pressure (SBP) reduction of 5 and more mm Hg; (c) EchoCG was usually recorded at Stage 2 of the test 3 minutes after the start of ATP administration and with a decline in SBP; (d) the initial dose of ATP administration was 140 pg/kg/min; if SBP did not decrease at 3 minutes of the drug administration, the dosage should be first increased up to 175 pg/kg/ min at 1 minute; if there was no effect, the dosage should be increased up to 210 pg/kg/min at another 2-3 minutes. The algorithm was tested in 9 healthy volunteers, and in 26 patients with CHD.
Results. Testing the new algorithm showed that all cases achieved submaximal myocardial hyperemia. SBP decreased below 90 mm Hg in 2 patients; 1 patient developed second-degree atrioventricular block; however, a simple decrease in the ATP infusion rate within 30 sec leveled this symptomatology. The SEchoCG data acceptable for the subsequent analysis of myocardial contractility and deformation could be recorded in all the examinees.
Conclusion. The new algorithm for SEchoCG with ATP is effective in recording EchoCG findings. To have a final decision on the safety and information value of a new stress test protocol, it may be recommended to further test those in larger groups of patients during SEchoCG and in the use of other imaging procedures to assess myocardial contractility and perfusion.
Keywords: stress echocardiography; adenosine triphosphate; myocardial deformation.
Conflict of interest. The authors declare no conflict of interest.
For citation: Nelassov NYu, Morgunov MN, Sidorov RV, Doltmurzieva NS, Eroshenko OL, Arzumanjan EA, Kreneva EL, Shlyk SV. New algorithm of stress echocardiography with adenosine triphosphate. Journal of Radiology and Nuclear Medicine. 2020; 101(5): 288-95 (in Russian). https://doi.org/10.20862/0042-4676-2020-101-5-288-295
For corresponding: Nikolay Yu. Nelassov, E-mail: nelassov@rambler.ru
Received June 14,2020 Revised July 15,2020 Accepted July 16,2020
Введение
В последние годы возможности проведения стресс-эхокардиографии (СЭхоКГ) с вазодилататорами в нашей стране ограниченны. Такие препараты, как дипиридамол и аденозин, активно используемые во всем мире для формирования синдрома обкрадывания миокарда и выявления зон скрытой ишемии у пациентов с ишемической болезнью сердца (ИБС), в российской аптечной сети в настоящее время недоступны.
В то же время еще в конце ХХ — начале нашего века было продемонстрировано, что аденозин и его предшественник аденозинтрифосфат (АТФ) имеют почти одинаковый сосудорасширяющий эффект [1, 2]. А в отличие от аденозина, АТФ без труда может быть приобретен в российских аптеках. Сходство вазодилатирующего потенциала аденозина и АТФ обусловило достаточно широкое применение последнего в качестве стресс-агента при проведении динамической однофотонной эмиссионной компьютерной томографии (ОФЭКТ) и позитронно-эмиссионной томографии (ПЭТ) миокарда, перфузионной магнитно-резонансной томографии (ПМРТ) и перфузионной компьютерной томографии (ПКТ) коронарного русла в странах Юго-Восточной Азии и России [3-8].
Что касается вопроса проведения СЭхоКГ с АТФ, то публикации по этой тематике немногочисленны: при поиске русско- и англоязычной научной литературы в базах данных eLibrary, Medline/ PubMed, ScienceDirect с использованием ключевых слов «стресс-эхокардиография», «АТФ», «stress-Echo», «adenosine triphosphate» нами обнаружено только 9 зарубежных публикаций, в основном из 90-х гг. прошлого века [9-17], и ни одной отечественной работы.
Рекомендуемый алгоритм введения АТФ при нагрузочных пробах с использованием различных визуализирующих методик следующий: монотонное внутривенное (в/в) интракубитальное введение препарата в дозе 140-160 мкг/кг/мин с регистрацией необходимых показателей через 1-5 мин от начала пробы и без учета уровня артериального давления (АД) в момент их регистрации [4-7, 9-11, 18]. Между тем, как это было показано ранее, в/в инфузия аденозина или АТФ в стандартных рекомендуемых дозах в 16-18% случаев не приводит к системному гемодинамическому ответу, а именно снижению систолического артериального давления (САД) и повышению частоты сердечных сокращений (ЧСС) [2, 19, 20]. Но известно, что стабильная субмаксимальная гиперемия миокарда (субмаксимальное расширение коронарных артерий) при введении вазодилататоров (аденозин либо АТФ) формируется не раньше чем через 2-3 мин инфузии препарата и только на фоне снижения уровня АД [19]. Таким образом, приблизительно у 1/5 пациентов при использовании стандартного протокола введения АТФ субмаксимального расширения коронарного русла не происходит, и поэтому результаты нагрузочной пробы по выявлению зон ишемии в этой подгруппе больных, к сожалению, нельзя рассматривать как достаточно корректные. Выходом из этой ситуации может стать увеличение дозы АТФ у пациентов с неадекватным гемодинамическим ответом, как это было продемонстрировано в исследовании с ПМРТ [21].
С учетом вышеизложенного в настоящем исследовании поставлены задачи:
- — разработать новый алгоритм СЭхоКГ с АТФ, предусматривающий возможность ступенеобразного повышения дозировки препарата;
- — протестировать новый алгоритм у здоровых лиц и пациентов с ИБС.
При разработке нового алгоритма СЭхоКГ с АТФ мы опирались на анализ литературных данных по тематике выполнения нагрузочных проб с АТФ [1, 2, 5, 6, 8-11, 13-16, 17-21], а также на первый собственный опыт применения АТФ при СЭхоКГ. В графическом виде алгоритм представлен на рисунке 1.
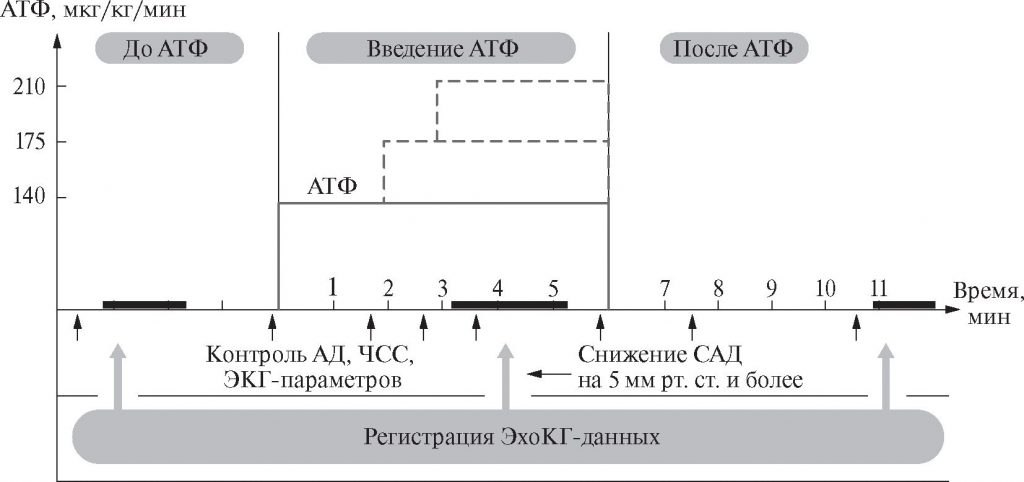
Рис. 1. Алгоритм проведения стресс-эхокардиографии с аденозинтрифосфатом. АТФ — аденозинтрифосфат; АД — артериальное давление; САД — систолическое артериальное давление; ЧСС — частота сердечных сокращений; ЭКГ — электрокардиограмма; ЭхоКГ — эхокардиография Fig. 1. Algorithm for stress echocardiography with adenosine triphosphate. АТФ — adenosine triphosphate; АД — blood pressure; САД — systolic blood pressure; ЧСС — heart rate; ЭКГ — electrocardiogram; ЭхоКГ — echocardiography
На 1-м этапе исследования (до начала интракубитальной инфузии АТФ) изучается история болезни, оцениваются показания и противопоказания к пробе, записываются исходные ЭхоКГ-данные, регистрируется ЭКГ в 12 отведениях, проводится измерение АД и ЧСС.
На 2-м этапе начинается в/в введение АТФ в дозировке 140 мкг/кг/мин. При этом каждую минуту осуществляется контроль АД и ЧСС, мониторируются ЭхоКГ и ЭКГ Повторная регистрация ЭхоКГ-данных обычно выполняется через 3 мин от начала инфузии вазодилататора; сигналом к началу записи является устойчивое снижение САД на 5 мм рт. ст. и более, указывающее на достижение состояния субмаксимальной гиперемии миокарда [19]. Однако запись ЭхоКГ может быть проведена и в более ранние сроки (в случае развития приступа стенокардии, появления сдвигов ишемического характера на ЭКГ). Если через 2 мин введения препарата в дозе 140 мкг/кг/мин САД не снижается, дозировка должна увеличиться сначала до 175 мкг/кг/мин на 1 мин, а при отсутствии эффекта — до 210 мкг/кг/мин еще на 3 мин. Если САД даже при увеличении дозы вазодилататора снизить не удается, то проба прекращается, а результаты пробы считаются неинформативными. Таким образом, снижение САД — главный критерий достижения состояния адекватной гиперемии миокарда.
При введении АТФ необходимо тщательно следить за возможным появлением осложнений (снижение САД ниже 90 мм рт. ст., атриовентрикулярный блок 1-2-й ст.) [1, 5, 6, 22]; при появлении осложнений скорость инфузии АТФ сразу же уменьшается на 35 мкг/кг/мин; если в течение 30 с симптоматика не купируется, введение вазодилататора прекращается и в/в медленно вводится антидот (10 мл 2,4% раствора эуфиллина). В случае появления у пациента бронхоспастической реакции на введение АТФ инфузия препарата прекращается сразу же и эуфиллин вводится в/в без задержки.
Следует также учитывать, что на фоне введения АТФ у пациента могут появиться слабо выраженные симптомы, укладывающиеся в картину малых побочных эффектов на введение аденозина и расширения сосудистого русла (чувства жара, прилива к лицу, комка в горле, сухости во рту, затруднения при дыхании, стеснения и покалывания в грудной клетке, тяжести в плече, головная боль, тошнота) [2, 5, 6, 9, 18]. Появление такой симптоматики не препятствует продолжению нагрузочной пробы, а наоборот, может служить дополнительным маркером начинающейся вазодилатации.
После записи ЭхоКГ-данных на 2-м этапе пробы введение АТФ прекращается. Продолжительность 2-го этапа обычно составляет 4-6 мин.
Завершающая регистрация ЭхоКГ-данных выполняется через 5 мин после окончания инфузии АТФ (в конце 3-го этапа пробы — периода восстановления); длительное сохранение сдвигов ЭхоКГ, появившихся на 2-м этапе пробы, указывает на особую тяжесть поражения коронарных артерий [22]. Общая продолжительность пробы, таким образом, колеблется от 9 до 11 мин; общее количество вводимого АТФ (в зависимости от массы тела пациента и времени достижения состояния адекватной миокардиальной гиперемии) может составлять 35-110 мг
Тестирование вновь созданного алгоритма проведено у 35 человек, сначала у 9 здоровых добровольцев (6 мужчин и 3 женщины, средний возраст 33,3 ± 12,8 года), а затем у 26 пациентов с ИБС (24 мужчины и 2 женщины, средний возраст 63,1 ± 7,5 года). Больным ИБС за несколько дней до нагрузочной пробы с АТФ была выполнена коронароангиография, выявившая у 7 из них (26,9%) однососудистое поражение коронарных артерий, а у 19 (73,1%) — многососудистое. Всем обследованным проведена трехмерная стресс-эхокардиография в реальном масштабе времени с оценкой продольной деформации миокарда левого желудочка (4Э-СЭхоКГ + ПДЛЖ). У здоровых лиц 4Э-СЭхоКГ + ПДЛЖ была выполнена для определения нормативных показателей ПДЛЖ во время модифицированной нагрузочной пробы с АТФ, а у пациентов с ИБС — для оценки функциональной значимости выявленных при коронарографии гемодинамически значимых стенозов и окклюзий коронарных артерий с целью определения тактики хирургической реваскуляризации. При проведении 4Э-СЭхоКГ + ПДЛЖ применен ультразвуковой сканер Vivid Е95 (General Electric, США), оснащенный матричным объемным секторным датчиком 4V-D, а также использованы технологии автоматизированной визуализации функции сердца (Automatic Function Imaging — AFI) и 4D-пространственного спекл-трекинга. АТФ (ВИАЛ, Россия) вводился в/в интракубитально с помощью шприцевого дозатора Инстилар-1438 (Dixion, Россия). Автоматически рассчитанные показатели ПДЛЖ были представлены в виде полярных диаграмм; при анализе выявленных изменений локальной сократимости и деформации миокарда использована 17-сегментная схема деления ЛЖ.
В ходе тестирования нагрузочной пробы (в соответствии с разработанным протоколом) постоянно измерялись АД, ЧСС, тщательно контролировалось состояние пациента на предмет раннего обнаружения возможных осложнений.
Нагрузочная проба расценивалась как положительная в случаях: а) выявления при визуальном контроле новых зон асинергии, затрагивающих более одного сегмента миокарда ЛЖ, либо усиления степени асинергии, зарегистрированной исходно; б) обнаружения новых зон снижения систолической деформации миокарда, затрагивающих более одного сегмента, либо усиления степени нарушений деформации, обнаруженных до пробы [9-11, 14, 15, 17, 22, 23]. При отсутствии подобных изменений проба считалась отрицательной. Проба расценивалась как неинформативная при возникновении осложнений, заставлявших досрочно прекратить пробу, либо при отсутствии у пациента адекватного гемодинамического ответа на введение АТФ (снижение САД на 5 мм рт. ст. и более).
При математической обработке данных использован пакет прикладных программ Statistica 6.0 (StatSoft, США). Все показатели представлены как средние величины и стандартное отклонение (М ± SD).
Протокол исследования получил одобрение этического комитета РостГМУ (в соответствии с требованиями Хельсинкской декларации 1964 г.). Перед нагрузочной пробой с обследуемыми проводилась обстоятельная беседа, в которой в доступной форме была представлена информация о целях пробы, ее характере и структуре, важности получаемой информации, а также возможных осложнениях, после чего пациенты подписывали информированное добровольное согласие на проведение теста.
РезультатыВо время тестирования нового алгоритма у всех обследованных удалось достичь фазы субмаксимальной миокардиальной гиперемии (снижение САД на 5 мм рт. ст. и более). В группе здоровых лиц ни в одном из случаев не пришлось повышать исходную дозировку АТФ. Средняя величина снижения САД в этой группе составила 19,3 ± 18,3 мм рт. ст., ЧСС возросла на 15,7 ± 8,0 уд/мин; развития осложнений (снижения САД ниже 90 мм рт. ст., атриовентрикулярной (АВ) блокады 1-2-й ст., бронхоспазма) не наблюдалось, однако у всех обследованных было отмечено появление хотя бы одного из малых побочных эффектов вазодилатации (чувства жара, прилива к лицу, комка в горле, сухости во рту, затруднения при дыхании, стеснения и покалывания в грудной клетке, тяжести в плече).
В группе пациентов с ИБС в 5 случаях (19,2%) на фоне введения начальной дозы АТФ (140 мкг/кг/ мин) САД не снизилось. Для достижения состояния субмаксимальной миокардиальной гиперемии у 3 больных пришлось увеличить дозировку АТФ до 175 мкг/кг/мин, а у 2 — довести ее до 210 мкг/кг/мин. Средний уровень снижения САД в группе пациентов с ИБС составил 16,8 ± 10,3 мм рт. ст., повышения ЧСС — 10,8 ± 6,7 уд/мин. У 1 больного (3,8%) на фоне введения АТФ в дозе 175 мкг/кг/мин и у 1 пациента (3,8%) при дозе 210 мкг/кг/мин САД снизилось до уровня 80 и 70 мм рт. ст. соответственно, однако простое снижение скорости инфузии препарата до 140 мкг/кг/мин за 20-30 с привело к повышению САД до уровня 95 мм рт. ст. В 1 случае снижение САД сопровождалось и появлением АВ-блокады 2-й ст., однако это нарушение проводимости тут же исчезло при повышении уровня САД. Никаких других осложнений (инфаркта миокарда, АВ-блокады 3-й ст., бронхоспазма) в группе больных зафиксировано не было, однако во всех случаях пациенты отмечали появление слабовыраженных симптомов, характерных для малых побочных эффектов вазодилатации. Эта симптоматика исчезала в течение 30 с после окончания введения АТФ.
Случаев преждевременного прекращения нагрузочной пробы не было. У всех здоровых лиц и пациентов удалось зарегистрировать данные 4D-СЭхоКГ + ПДЛЖ, приемлемые для последующего анализа.
Пример. В качестве примера проведения пробы с АТФ и выполнения автоматизированного мониторирования изменений процессов деформации миокарда ЛЖ можно привести следующее наблюдение. Больной Г. 53 лет 10 лет назад перенес переднесептальный инфаркт миокарда левого желудочка без зубца Q. Лечился консервативно, чувствовал себя удовлетворительно. В последнее время стал отмечать появление болей в области сердца (напоминающих кардиалгические) при физической нагрузке. По результатам выполненной коронароангиографии: а) передняя межжелудочковая ветвь (ПМЖВ) — окклюзия в средней трети с заполнением дистального русла по внутрисистемным коллатералям; б) огибающая ветвь (ОВ) — стеноз дистальной трети 70%; в) правая коронарная артерия (ПКА) — окклюзия в средней трети с заполнением дистального русла по внутрисистемным коллатералям. Проведена 4D-СЭхоКГ + ПДЛЖ с АТФ. Исходное АД 131/75 мм рт. ст., ЧСС 81 уд/мин. Через 2 мин введения АТФ в дозе
140 мкг/кг/мин — АД 133/76 мм рт. ст., ЧСС 80 уд/мин. В связи с отсутствием гемодинамического ответа на введение начальной дозы АТФ скорость инфузии увеличена до 175 мкг/кг/мин. Через 1 мин АД снизилось до 112/59 мм рт. ст., ЧСС возросла до 88 уд/мин. Констатировано достижение стадии субмаксимальной миокардиальной гиперемии и проведена запись данных 40-ЭхоКГ Восстановительный период протекал без особенностей. Через 5 мин после окончания инфузии АТФ — АД 126/84 мм рт. ст., ЧСС 82 уд/мин.
Во время пробы развития приступа стенокардии и сдвигов ишемического характера на ЭКГ не отмечено. При визуальном контроле сократимости миокарда ЛЖ и при обработке 40-данных, зарегистрированных до нагрузки, во время и после нее, нарушений локальной сократимости миокарда ЛЖ также не выявлено. В ходе автоматизированного анализа продольной систолической деформации миокарда ЛЖ получены диаграммы, представленные на рисунке 2.
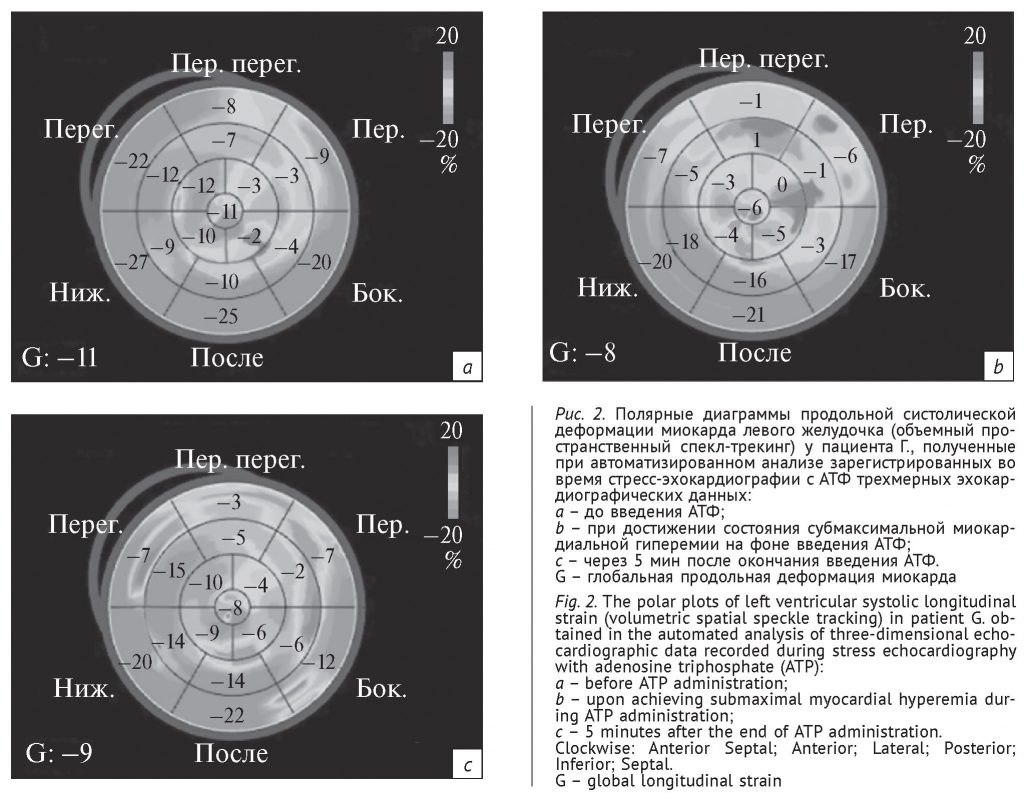
Как видно из представленных диаграмм, до пробы умеренные нарушения ПДЛЖ были выявлены в зоне кровоснабжения ПМЖВ и ОВ. Во время пробы отмечено усиление нарушений ПДЛЖ в этой же зоне; указанные изменения сохранялись и через 5 мин после окончания введения АТФ. Таким образом, только с помощью ПДЛЖ удалось определиться с коронарными артериями (ПМЖВ и ОВ), ответственными за нарушение деформации миокарда (которая, в свою очередь, обусловлена наличием скрытой ишемии). При этом в зоне кровоснабжения ПКА и в покое, и при нагрузке нарушений процессов деформации миокарда не отмечено.
АТФ как вазодилататор может служить эффективным заменителем аденозина во время нагрузочных тестов — степень расширения коронарного русла, стабильность показателей кровотока в коронарных артериях, быстрое окончание действия (период полувыведения до 20 с), быстрота действия антидотов (эуфиллин) при использовании АТФ и аденозина приблизительно одинаковы [1, 2, 6, 8, 9, 20, 24]. К сожалению, публикации о применении АТФ в качестве стресс-агента при ЭхоКГ в нашей стране практически отсутствуют.
Настоящая работа в какой-то мере может восполнить существующий дефицит информации.
С целью минимизации неопределенных результатов СЭхоКГ нами переработан традиционный алгоритм дозировки АТФ: при отсутствии адекватного гемодинамического ответа (снижения АД) на стандартную дозу введения препарата (140 мкг/кг/мин) дозировка ступенеобразно повышается до 210 мкг/кг/мин. При таком подходе нам во всех случаях удалось достигнуть фазы субмаксимальной гиперемии миокарда.
Ранее было продемонстрировано, что частота развития осложнений и их выраженность при нагрузочной пробе с АТФ намного ниже, чем при использовании добутамина, дипиридамола и аденозина [5, 6, 8, 9]. В литературе не описано летальных исходов, случаев развития АВ-блока 3-й ст., желудочковой тахикардии, инфаркта миокарда, отека легких при стресс-тесте с АТФ. Причем установлено, что простое снижение темпа инфузии АТФ позволяет в течение нескольких секунд купировать возникающие осложнения, не прибегая к необходимости введения антидота (эуфиллина). В связи с этим существуют рекомендации при появлении довольно редких и нетяжелых осложнений не прерывать пробу, а путем снижения дозировки АТФ добиваться их исчезновения и после этого фиксировать всю необходимую диагностическую информацию [25]. Такой подход мы с успехом применили и в нашей работе. Только у 2 лиц из 35 (5,7%) было отмечено появление нежелательных симптомов (снижение САД ниже 90 мм рт. ст. и АВ-блокада 2-й ст.). При снижении темпа введения АТФ симптоматика быстро исчезла и введения эуфиллина не потребовалось. Поэтому проба была продолжена и необходимые ЭхоКГ-данные были успешно зарегистрированы.
Достичь фазы субмаксимальной гиперемии миокарда, избежать преждевременного прекращения теста, а также зарегистрировать все необходимые ЭхоКГ-данные во всех случаях позволяет тщательное соблюдение следующих условий: а) заблаговременное выявление противопоказаний к проведению пробы с АТФ (наличия бронхоспастического синдрома, брадиаритмии, АВ-блокады 2-3-й ст., выраженной артериальной гипотонии) [5, 22]; б) подготовка обследуемого к проведению пробы — отмена препаратов группы метилксантинов (кофеин, теобромин, теофиллин и его водорастворимые соли) за 24 ч до выполнения пробы, а также ограничение приема препаратов, повышающих концентрацию теофиллинов (ß-адреноблокаторы, циметидин, эритромицин, антагонисты кальция) или потенциирующих действие аденозина (дипиридамол), отказ от употребления кофе, чая, шоколада, кока-колы за сутки до пробы [5, 24]; в) предварительное информирование пациента о возможном появлении симптомов, связанных с состоянием вазодилатации при введении АТФ; г) активное участие обследуемого в тесте (непрерывный контакт с медицинским персоналом, мониторирование своего самочувствия и оперативное представление информации даже о незначительных его изменениях); д) аккуратное соблюдение протокола нагрузочной пробы; е) постоянное наблюдение за ЭКГ-кривой, уровнем АД, ЧСС; ж) гибкое регулирование темпа введения АТФ.
Учитывая вышеизложенное, можно прийти к следующему заключению: модифицированный алгоритм проведения СЭхоКГ с АТФ имеет хорошие перспективы для практического применения в связи с довольно высокой эффективностью регистрации ЭхоКГ-данных и относительной безопасностью для пациента.
Также важно отметить, что применение АТФ в нагрузочных пробах экономически целесообразно, поскольку стоимость используемого в стресс-тесте АТФ на порядок ниже стоимости аденозина, необходимого для выполнения аналогичного исследования.
Ограничения исследования. Новый алгоритм был протестирован в небольшой группе здоровых лиц и больных ИБС (в нашем случае было всего 35 наблюдений). Окончательное суждение об информативности и безопасности нового протокола нагрузочной пробы с АТФ можно будет вынести только после его тестирования на значительно больших контингентах обследуемых.
Выводы- Разработан новый алгоритм СЭхоКГ с АТФ, предусматривающий возможность ступенеобразного повышения дозировки препарата в случае неадекватного гемодинамического ответа на введение стресс-агента.
- Модифицированный алгоритм введения АТФ во время СЭхоКГ эффективен при регистрации ЭхоКГ-данных. Для решения вопроса о безопасности нового алгоритма целесообразно его тестирование на больших группах пациентов.
- Новый протокол интракубитальной инфузии АТФ, по нашему мнению, может быть рекомендован для тестирования и в других визуализирующих методиках оценки сократимости и перфузии миокарда: ОФЭКТ, ПКТ, ПМРТ, ПЭТ.
- Kato M, Shiode N, Teragawa H, Hirao H, Yamada T, Yamagata T, et al. Adenosine 5’-triphosphate induced dilation of human coronary microvessels in vivo. Intern Med. 1999; 38(4): 324-9. doi: 10.2169/internalmedicine.38.324
- Jeremias A, Filardo S, Whitbourn R, Kernoff R, Yeung A, Fitzgerald P, et al. Effects of intravenous and intracoronary adenosine 5-triphosphate as compared with adenosine on coronary flow and pressure dynamics. Circulation. 2000; 101(3): 318-23. doi: 10.1161/01.CIR.101.3.318
- Nakajima T, Oriuchi N, Tsushima Y, Funabasama S, Aoki J, Endo K. Noninvasive determination of regional myocardial perfusion with first-pass magnetic resonance (MR) imaging. Acad Radiol. 2004; 11(7): 802-8. doi: 10.1016/j.acra.2004.01.017
- Курбатов В.П., Гензель Н.Р., Обединский А.А., Мироненко С.П., Осиев А.Г Оценка нарушений перфузии миокарда методом магнитно-резонансной томографии с аденозиновым стресс-тестом в бассейне кровоснабжения правой коронарной артерии при обосновании показаний к эндоваскулярной реканализации. Радиология — Практика. 2012; 4: 27-34. [Kurbatov VP, Hansel NR, Obedinskiy AA, Mironenko SP, Osiev AG. Assessment of violations of myocardial perfusion method magnetic-resonance tomography with adenosine-based stress test in a pool of blood supply to the right coronary artery when substantiating evidence to endovascular recanalization. Radiology — Practice. 2012; 4: 27-34 (in Russian).]
- Карпова И.Е., Самойленко Л.Е., Соболева Г.Н., Сергиенко В.Б., Карпов Ю.А. Применение однофотонной эмиссионной компьютерной томографии с 99|лТс-МИБИ в сочетании с фармакологической пробой с аденозинтрифосфатом натрия в диагностике ишемии миокарда у больных ишемической болезнью сердца. Кардиология. 2013; 53(2): 91-6.[Karpova IE, Samoilenko LE, Soboleva GN, Sergiyenko VB, Karpov Yu A. Adenosine triphosphate stress99mMIBI single-photon emission computed tomography in the diagnosis of ischemic heart disease. Kardiologiia. 2013; 53(2): 91-6 (in Russian).]
- Miyagawa M, Miyauchi E, Ishimura H, Tanabe Y, Kido T, Kurata A, et al. Quantification of coronary flow reserve by 15O-water PET with ATP stress; from a practical application perspective. Ann Nucl Cardiol. 2016; 2(1): 58-60. doi: 10.17996/ANC.02.01.58
- Мочула А.В., Завадовский К.В., Андреев С.Л., Лишманов Ю.Б. Динамическая однофотонная эмиссионная компьютерная томография миокарда как метод идентификации многососудистого поражения коронарного русла. Вестник рентгенологии и радиологии. 2016; 97(5): 289-95. doi: 10.20862/0042-46762016-97-5-289-295[Mochula AV, Zavadovsky KV, Andreev SL, Lishmanov YuB. Dynamic single-photon emission computed tomography as a method of identification of multivessel coronary artery disease. Journal of Radiology and Nuclear Medicine. 2016; 97(5): 289-95 (in Russian). doi: 10.20862/0042-4676-2016-97-5-289-295]
- Saab R, Hage FG. Vasodilator stress agents for myocardial perfusion imaging. J Nucl Cardiol. 2017; 24(2): 434-8. doi: 10.1007/s12350-016-0408
- Fukai T, Koyanagi S, Tashiro H, Ichiki T, Tsutsui H, Matsumoto T, et al. Adenosine triphosphate stress echocardiography in the detection of myocardial ischemia. Am J Card Imaging. 1995; 9(4): 237-44.
- Harada M, Okura K, Nishizawa S, Inoue T, Sakai H, Lee T, et al. Detection of coronary artery disease by adenosine triphosphate stress echocardiography: comparison with adenosine triphosphate stress thallium myocardial scintigraphy and coronary angiography. J Cardiol. 1998; 32(3): 163-71 (in Japanese).
- Shin JH, Liang SJ, Lee NH, Kim YL, Kim HS, Tank SJ, et al. Adenosine triphosphate stress echocardiography. J Korean Soc Echocar-diogr. 1997; 5(1): 5-12. doi: 10.4250/jkse.1997.5.1.5
- Shishido T, Beppu S, Matsuda H, Miyatake K. Assessment of flow mismatch with pharmacologic stress test on myocardial contrast echocardiography in a model of critical stenosis: adenosine triphosphate and dipyridamole. J Am Soc Echocardiogr. 1999; 12 (4): 257-65. doi: 10.1016/S0894-7317(99)70040-4
- Takeuchi M, Yoshitani H, Miyazaki C, Otani S, Sakamoto K, Yoshikawa J. Assessment of myocardial perfusion by harmonic power doppler imaging at rest and during adenosine triphosphate stress: comparison with coronary flow velocity reserve in the left anterior descending coronary artery. Circ J. 2002; 66(2): 67-72. doi: 10.1253/circj.66.167
- Takagi T, Takagi A, Hozumi T, Yoshikawa J. Detection of significant stenotic lesions in the left anterior descending coronary artery using adenosine triphosphate stress strain imaging: comparison with coronary flow velocity reserve measurement using transthoracic Doppler echocardiography. J Am Soc Echocardiogr. 2006; 19(8): 1001-11. doi: 10.1016/j.echo.2006.02.009
- Otani K, Toshida T, Iwata A, Asanuma T, Ishikura F, Beppu S. Adenosine triphosphate stress myocardial contrast echocardiography detects coronary artery stenosis with greater sensitivity than wall-motion abnormality measurements. J Am Soc Echocar-diogr. 2004; 17(12): 1275-80. doi: 10.1016/j.echo.2004.08.016
- Li WH, Li CP, Li ZP, Zhang M, Li L, Ma XW, et al. Diagnostic accuracy of adenosine triphosphate stress echocardiography derived coronary flow reserve for detecting significant coronary stenosis. Zhonghua Yi Xue Za Zhi. 2013; 93(6): 432-5. doi: 10.3760/cma.j. issn.0376-2491.2013.06.010
- Gunji K, Takagi A, Arai K, Ashihara K, Hagiwara N. Temporal analysis of regional strain rate during adenosine triphosphate stress before and after percutaneous coronary interventions. Heart Vessels. 2015; 30(3): 309-17. doi: 10.1007/s00380-014-0491-x
- He Q Yao Z, Yu X, Qu W, Sun F, Ji F, et al. Evaluation of (99m)Tc-MIBI myocardial perfusion imaging with intravenous infusion of adenosine triphosphate in diagnosis of coronary artery disease. Chin Med J. 2002; 115(11): 1603-17.
- Wilson RF, Wyche K, Christensen BV, Zimmer S, Laxson DD. Effects of adenosine on human coronary arterial circulation. Circulation. 1990; 82(5): 1595-606.
- De Bruyne B, Nico HJ, Barbato E, Bartunek J, Bech JW, et al. Intracoronary and intravenous adenosine 5-triphosphate, adenosine, papaverine, and contrast medium to assess fractional flow reserve in humans. Circulation. 2003; 107(14): 1877-83. doi: 10.1161/01.CIR.0000061950.24940.88
- Karamitsos TD, Ntusi NA, Francis JM, Holloway CJ, Myerson SG, Neubauer S. Feasibility and safety of high-dose adenosine perfusion cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2010; 12: 66. doi: 10.1186/1532-429X-12-66
- Sicari R, Nihoyannopoulos P, Evangelista A, Kasprzak J, Lancel-lotti P, Poldermans D, et al. Stress Echocardiography Expert Consensus Statement — Executive Summary European Association of Echocardiography (EAE) (a registered branch of the ESC). Eur Heart J. 2009; 30(3): 278-89. doi: 10.1093/eurheartj/ehn492
- Smiseth OA, Torp H, Opdahl A, Haugaa KH, Urheim S. Myocardial strain imaging: how useful is it in clinical decision making? Eur Heart J. 2016; 37(15): 1196-207. doi: 10.1093/eurheartj/ehv529
- Coma-Canella I, Palazuelos J, Bravo N, Velloso MJ. Myocardial perfusion imaging with adenosine triphosphate predicts the rate of cardiovascular events. J Nucl Cardiol. 2006; 13(3): 316-23. doi: 10.1016/j.nuclcard.2006.02.010
- Miyagawa M, Kumano S, Sekiya M, Watanabe K, Akutzu H, Imac-hi T, Tanada S. Thallium-201 myocardial tomography with intravenous infusion of adenosine triphosphate in diagnosis of coronary artery disease. J Am Coll Cardiol. 1995; 26(5): 1196-201. doi: 10.1016/0735-1097(95)00304-5