Наслоение препаратов при сердечной недостаточности
Тезис
Препараты с доказанной эффективностью у пациентов с сердечной недостаточностью со сниженной фракцией выброса рекомендуются, согласно проспективным крупным клиническим исследованиям, стабильным пациентам после тщательного титрования в строгом последовательном порядке. Хотя актуальность повышения титрования не доказана, имеются данные о том, что после восстановления и вскоре после выписки из больницы частота сердечно-сосудистых смертей и госпитализаций высока. Клинические исследования показали, что эффект от лечения наступает быстро, в течение 28 дней при применении большинства препаратов первой линии, а в некоторых исследованиях раннее лечение после выписки или уже начатое в больнице дало положительные результаты. Таким образом, раннее лечение может быть полезным для дальнейшего снижения сердечно-сосудистых осложнений. В этом экспертном заключении предлагается распределение лечения в соответствии с фенотипами отдельных пациентов, включающими частоту сердечных сокращений, артериальное давление, нарушение функции почек и электролитные нарушения, а также выделенные подгруппы пациентов с особыми требованиями к началу лечения. Это дополняет другие подходы, которые предполагают начало последовательного лечения в соответствии с величиной лечебного эффекта препаратов, конкретными сердечными заболеваниями и пожеланиями пациентов.
Фенотипирование пациента может помочь в подборе персонализированных препаратов при сердечной недостаточности со сниженной фракцией выброса, что обеспечивает наилучшие результаты, в то время как для тщательного изучения эффективности этих подходов необходимы клинические исследования.
Почти все препараты с доказанной эффективностью при сердечной недостаточности со сниженной фракцией выброса продемонстрировали свою эффективность в плацебо контролируемых исследованиях, где новый препарат был добавлен в дополнение к ранее существовавшим методам лечения (1-12). В нескольких случаях, таких как исследование PARADIGM, новые и существующие препараты сравнивались лицом к лицу (13). В исследованиях сравнивались новые препараты с плацебо в дополнение к стандартной терапии, такие как DAPA-HF (1), EMPEROR-Reduced (2), VICTORIA (3), GALACTIC-HF (4) и SHIFT (12), добавление нового препарата может привести к усложнению лечения, и все же переоценки эффективности традиционной терапии не проводилось. Как следствие, рекомендуемый порядок назначения различных классов лекарств с прогностическими преимуществами в научных руководствах не отражает эффективность или безопасность препарата. Рекомендации существующих руководств также подчеркивают необходимость полного повышения титрования основных методов лечения до целевой (или максимально переносимой) дозы перед началом новых методов лечения. Такой подход приводит к задержкам и трудностям при применении препаратов, особенно у пациентов с сопутствующей патологией, которые уже борются с полипрагмазией. Кроме того, учитывая, что снижение риска наблюдалось на ранних стадиях начала приема эффективных препаратов, например, в течение 12 дней для эмпаглифлозина (2), 28 дней для сотаглифлозина (16,17), 14 дней для сакубитрила/валсартана (13) и 20 дней для ивабрадина (18), и зная, что побочные эффекты возникают на ранних стадиях после постановки диагноза или госпитализации, несвоевременное начало приема новых лекарств может оставить многих пациентов незащищенными (19).
Лечение "стабильного" пациента
В большинстве случаев препараты, рекомендованные при СНнФВ, были протестированы в основном у стабильных пациентов. Эти пациенты не отражают эпидемиологию, тяжесть заболевания и гемодинамическую стабильность пациентов, выписанных из больницы
(20,21). В некоторых небольших исследованиях были предприняты попытки оценить этих пациентов (22,23) или включить их в исследование (3,4,17), но отсутствуют специализированные и адекватные исследования эффективности препаратов для лечения СН в отношении исходов, начатых при выписке, и эффективности их титрования. Часто жизненно важные препараты отменяются или снижают титрование во время госпитализации в связи с декомпенсацией, и, хотя они являются прогностическими, существует мало доказательств того, как следует повышать титрование или начинать прием этих препаратов при выписке (24,25). Научные руководства содержат общие рекомендации по внедрению, не раскрывая четких механизмов (14,15) из-за недостатка данных (26). Таким образом, большинство пациентов в реальных условиях получают дозы жизненно важных препаратов, которые ниже, чем дозы, проверенные в клинических испытаниях (27). Нет четких и окончательных данных о том, лучше ли повышать титрование этих препаратов до их максимальной дозы или комбинировать лекарства на основе их фармакодинамического действия (например, частоты сердечных сокращений и артериального давления).
Проблема титрования
Хотя последующий анализ клинических испытаний и реестров показал более низкую частоту сердечно-сосудистых событий у пациентов, принимающих более высокие дозы препаратов(27,28), эти результаты, возможно, были следствием предвзятого отбора. Менее тяжелые пациенты, возможно, могли получать более высокие дозы препаратов и, таким образом, имели меньшую частоту неблагоприятных исходов из-за меньшей тяжести их заболевания. Исследование ATLAS не выявило различий в смертности и 12%-ном снижении числа госпитализаций у 3793 пациентов с СНнФВ, которым был назначен лизиноприл в дозе 37,5 или 2,5 мг в день после медианы 47-месячного наблюдения (29). Несмотря на то, что у 3846 пациентов с СНнФВ, включенных в исследование HEAAL и рандомизированных на 50 или 150 мг лозартана в день, не наблюдалось снижения смертности (30), высокие дозы лозартана сократили количество госпитализаций на 12%. В обоих исследованиях сообщалось об усилении побочных эффектов гипотензии, ухудшении функции почек и гиперкалиемии при применении высоких доз препарата. Таким образом, мы не знаем, у каких пациентов результаты лечения будут улучшены в достаточной степени за счет увеличения дозы, чтобы учесть повышенный риск. Крупных рандомизированных исследований высоких доз по сравнению с низкими дозами бетаадреноблокаторов или антагонистов минералокортикоидов не проводилось. Ouwerkerk и соавт. (28) обнаружили, что только 14% пациентов получали по меньшей мере 50% целевой дозы ингибиторов АПФ или блокаторов рецепторов ангиотензина или бетаблокаторов в исследовании BIOSTAT-CHF и азиатского исследования, включающее 6787 пациентов с СНнФВ. Эти исследователи обнаружили, что неиспользование или использование более низких доз лекарств было связано с большим бременем сопутствующих заболеваний, таких как почечная дисфункция. После корректировки между <50% целевой дозы каждого препарата и его 100% целевой дозой продемонстрировало очень скромную пользу от более высоких доз (28). Важно отметить, что пациенты, получавшие комбинацию ингибитора АПФ в низких дозах и бетаблокаторов, имели более низкие показатели госпитализации и смертности по сравнению с пациентами, принимавшими оба препарата отдельно (даже в высоких дозах). Хотя это исследование ограничено его наблюдательным дизайном, нет веских оснований для поддержки титрования дозы 1 препарата перед началом приема другого. Также неясно, приводит ли начало приема различных препаратов к различной эффективности по сравнению с последовательным введением лекарств. Неудивительно, что четкие рекомендации по оптимальному сроку и последовательности введения препаратов для лечения СН отсутствуют как у пациентов с СН de novo, так и у пациентов в постострой фазе. Это особенно актуально для пациентов, госпитализированных по поводу СН, у которых есть убедительные показания к назначению по крайней мере 1 нового препарата, рекомендованного руководством, при выписке. В регистре Get With the
Guideline четверть пациентов принимала более 1 лекарства, а 14% при выписке принимали 3 или более новых лекарств (31). Возникает вопрос, следует ли начинать прием препарата до полного повышения титрования уже существующих препаратов или
следует начинать прием всех рекомендованных препаратов одновременно. Кроме того, применение методов лечения может варьироваться в зависимости от местных моделей здравоохранения, и каждая система здравоохранения может по-разному справляться с
повышением титрования и поэтапным назначением различных препаратов(24). В некоторых системах здравоохранения повышение титрования может быть делегировано врачам общей практики, медсестрам или фармацевтам, тогда как в других системах этот
подход реализовать сложнее (24).
Добавление препарата
Наслоение лекарств редко изучалось систематически. Четких данных о применении диуретической терапии не существует, и единственным исследованием, в котором сравнивался порядок применения 2-х препаратов первой линии, было исследование CIBIS III (Исследование бисопролола при сердечной недостаточности). Это исследование показало отсутствие различий между назначением бисопролола или эналаприла в качестве первого препарата (32). В исследовании CIBIS III, как и в других исследованиях бета-блокаторов и ингибиторов АПФ, лечение бисопрололом или эналаприлом начинали с низкой дозы (1,25 мг в день или 2,5 мг два раза в день), а затем постепенно повышали титрование препаратов с интервалом в 2 недели. Титрование является обязательным, если только оно не запрещено из-за непереносимости, но оно может быть скорректировано в зависимости от переносимости. Более 50% пациентов не переносили полные дозы ни того, ни другого препарата при их комбинированном применении. Последние назначенные дозы эналаприла и бисопролола были выше в зависимости от того, какой препарат был назначен первым. В первой группе бисопролола последние назначенные дозы бисопролола были значительно выше по сравнению с первой группой эналаприла, а в первой группе эналаприла последние назначенные дозы эналаприла были значительно выше по сравнению с первой группой бисопролола (32). Эти результаты свидетельствуют о том, что исторический порядок клинических испытаний (ингибитор АПФ перед бета-блокатором) не означает, что сначала следует начинать наиболее эффективную или хорошо переносимую терапию
Переносимость препаратов
У многих пациентов поэтапное и медленное введение препаратов с гемодинамическими эффектами снижает вероятность побочных эффектов, таких как артериальная гипотензия или брадикардия, которые со временем ограничивают приверженность к рекомендованной руководством медикаментозной терапии. Например, одновременное добавление ингибиторов ренин-ангиотензин-альдостероновой системы и бетаблокаторов может оказывать неблагоприятное воздействие на артериальное давление, функцию почек и уровень калия (33,34). Однако клинический подход медленного поэтапного введения лекарств противоречит призыву к более быстрой эскалации терапии для достижения рекомендуемых доз в течение нескольких недель после выписки. Некоторые препараты облегчают применение других, таких как сакубитрил/валсартан (35) и дапаглифлозин (36), и они оказывают благоприятное воздействие на функцию почек и гиперкалиемию при совместном применении с АМР. Кроме того, ивабрадин и бета-адреноблокаторы оказывают аддитивное действие на снижение частоты сердечных сокращений, и ивабрадин может способствовать повышению титрования бета-адреноблокатора (37). Действительно, сроки, порядок и последовательность, в которых следует начинать прием лекарств при СН, никогда систематически не исследовались.
Когда пациенты поступают в стационар с обострением хронической СН, бетаадреноблокаторы часто уменьшают или отменяют из–за их отрицательного инотропного эффекта и их эффектов, снижающих частоту сердечных сокращений и артериальное давление. Не существует научно обоснованных рекомендаций относительно того, следует ли возобновлять прием бета-адреноблокаторов перед выпиской и как оптимизировать дозы после выписки. Программа OPTIMIZE-HF показала, что продолжение терапии бета-блокаторами у пациентов, госпитализированных с декомпенсированной СН, связано с более низким риском смертности после выписки, тогда как отмена терапии бета-блокаторами связана с большим риском и смертностью (34). Аналогичные результаты были получены в 2 рандомизированных исследованиях, что согласуется с метаанализом некоторых небольших исследований (38,39). Хотя эти данные были скорректированы с учетом факторов, приводящих к путанице, эти исследования ограничены знанием того, что пациенты, прекратившие прием бета-адреноблокаторов во время госпитализации, несомненно, имели худшие гемодинамические показатели и, следовательно, более высокий риск смертности (39). IMPACT-HF было единственным исследованием, в котором анализировалось, когда следует начинать прием бетаадреноблокаторов после острого события, и оно не выявило повышенного риска начала приема этих препаратов при выписке.; были аналогичные показатели смертности у пациентов, получавших терапию бета-блокаторами в больнице, по сравнению с пациентами, которые начали терапию бета-блокаторами после выписки (40). Одно небольшое рандомизированное контролируемое исследование показало аналогичные показатели смертности и повторной госпитализации для пациентов, которые
продолжали или прекратили прием бета-блокаторов во время госпитализации в течение 3 месяцев наблюдения (41). Имеются четкие доказательства того, что раннее начало приема ингибиторов АПФ и АМР связано с прогностической пользой. Эффект был
первоначально продемонстрирован CONSENSUS для ингибиторов АПФ (6) и исследование EPHESUS для АМР (7).
Недавно разработанные препараты имеют гемодинамические последствия, которые могут повлиять на титрование других лекарств. Сакубитрил/валсартан вызывает гипотензию, которая может ограничить его полное быстрое применение у всех пациентов (13,42). Совсем недавно исследования DAPA-HF (1) и EMPEROR-Reduced (2) продемонстрировали явную прогностическую пользу дапаглифлозина и эмпаглифлозина. Эти препараты оказывают некоторое влияние на артериальное давление (43), но в целом они хорошо переносятся как диабетиками, так и недиабетикками с СН (44,45). Верицигуат продемонстрировал некоторую прогностическую пользу у пациентов с обострением хронической СН, включая пациентов в непосредственной постострой фазе (3). Преимущество было обусловлено сокращением госпитализации с СН без какого-либо влияния на сердечно-сосудистую смертность (3). Это снижало артериальное давление, но показатели переносимости были ненамного ниже, чем при применении плацебо. Омекамтив мекарбил, который не влияет на частоту сердечных сокращений, артериальное давление или функцию почек, продемонстрировал прогностическую пользу у пациентов с СН, в том числе у тех, кто начал прием препарата до или сразу после госпитализации. Примечательно, что в исследовании GALACTIC были рандомизированы пациенты с очень низким систолическим артериальным давлением (90 мм рт. ст.) (4).
Несколько недавно опубликованных статей и экспертных заключений указывают на то, что пришло время для изменений, чтобы быстро внедрить все доступные препараты с различными фармакологическими профилями с использованием различных
механизмов, поскольку эффективное снижение риска наступает рано (46,47). Последовательность лечения в соответствии с результатами испытаний была критически поставлена под сомнение (46-48), учитывая, что руководящие принципы и рекомендации
некоторых экспертов следовали концепции строгого последовательного повышения титрования у стабильных амбулаторных пациентов, поскольку в этой группе доказательства для большинства лекарств были получены в результате проспективных рандомизированных исследований. Однако, поскольку большинство препаратов снижали нежелательные явления в первые 30 дней после начала лечения (47,48), раннее лечение может еще больше снизить количество побочных эффектов, поскольку можно избежать потери пациентов, вызванной отсрочкой начала лечения (47-49). Рекомендации по началу лечения могут варьироваться от величины эффектов лечения (47,48) до детального определения конкретных механизмов действия лекарств при конкретных заболеваниях (50). Непереносимость и потенциально серьезные побочные эффекты являются ограничениями быстрого начала приема нескольких препаратов за короткий промежуток времени. Поэтому необходимо также принимать во внимание сопутствующие заболевания и характеристики пациента (51). Ни одна из этих концепций не противоречит друг другу, и они могут дополнять друг друга. Недавно было предложено начать быстрое лечение с бета-блокаторов и ингибитора натрий-глюкозного транспортера типа 2 (SGLT2) (47,48), и это имеет определенные преимущества, связанные с переносимостью и масштабом эффектов лечения (48). Тем не менее, можно предположить, что у отдельных пациентов с низкой частотой сердечных сокращений на исходном уровне величина лечебного эффекта бета-блокаторов может быть небольшой, учитывая, что значительная часть механизма действия этого препарата, как предполагается, обусловлена снижением частоты сердечных сокращений (52). Вполне вероятно, что изменение ограничительных моделей на основе клинического суждения
отдельных пациентов имеет смысл. Поэтому мы хотели бы предложить здесь концепцию фенотипирования пациентов в дополнение к алгоритмам на основе величины эффекта лечения, изменений, специфичных для конкретного заболевания, и побочных эффектов
препаратов.
Новый терапевтический алгоритм в соответствии с фенотипом пациента
Учитывая, что почти все препараты, улучшающие прогноз, влияют на частоту сердечных сокращений, артериальное давление, функцию почек и электролитный баланс, целесообразно рассмотреть вопрос о том, как можно оптимизировать применение этих методов лечения в соответствии с особенностями отдельных пациентов. Более того, учитывая, что нет веских причин для поэтапного начала приема жизненно важных препаратов, разумно начинать прием препаратов с доказанной прогностической пользой вместе и применять различные препараты в соответствии с их фармакодинамическими эффектами и особенностями пациента. Такой подход может обеспечить более быструю эскалацию терапии СН с максимальной пользой для конкретного пациента.
Пациенты с СН имеют различные клинические проявления, степень застойных явлений, гемодинамический статус и функцию почек. Таким образом, корректировка или приоритизация лекарств в соответствии с профилем гемодинамики и фенотипов позволит индивидуально применять жизненно важные препараты. Более того, хотя поэтапный подход к назначению препаратов для лечения СН может быть оправдан у пациентов, не принимающих лекарства, большинство пациентов с СН часто имеют ранее существовавшие заболевания и уже принимают ингибиторы ренин-ангиотензин-альдостероновой системы и/или бета-блокаторы. Проблема заключается в том, как определить приоритет и выбрать наиболее адекватное повышение титрования препаратов. Терапия должна проводиться в соответствии с фенотипами (рис. 1). Наиболее важными фенотипами, которые следует учитывать при проведении терапии СН, являются частота сердечных сокращений, артериальное давление, функция почек и их комбинации. Используя этот подход, можно выявить 7 фенотипов, при которых следует проводить персонализированную реализацию и повышение титрования медикаментозной терапии.
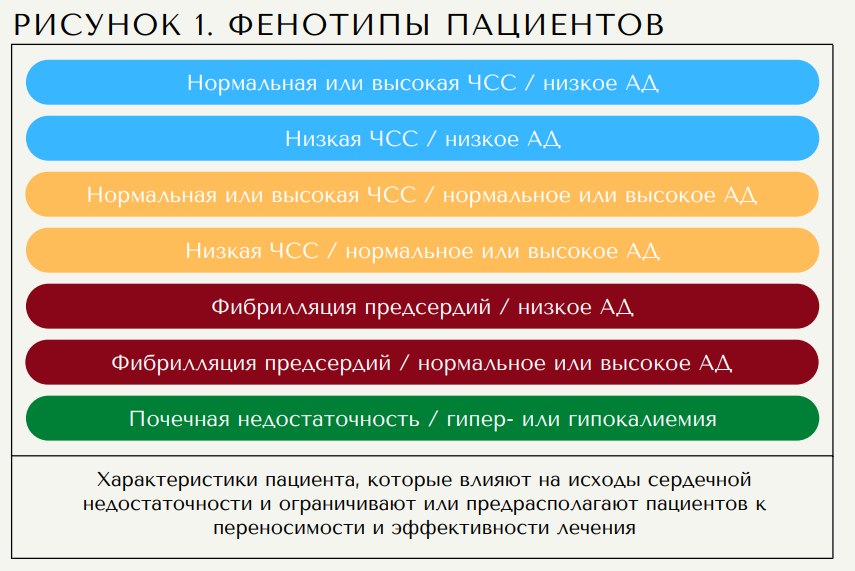
4 класса препаратов: антагонисты иАПФ/АРНИ, бета-блокаторы, ингибиторы SGLT2, АМР, спасающие жизнь эффекты которых были тщательно изучены в крупных рандомизированных плацебо-контролируемых исследованиях в широких группах пациентов (5-11,13), должны быть начаты у пациентов с СНнФВ. Поскольку эти 4 класса были изучены в широких группах пациентов и продемонстрировали явную прогностическую пользу, прием этих препаратов следует начинать как можно скорее в соответствии с переносимостью, пожеланиями пациента и доступностью.
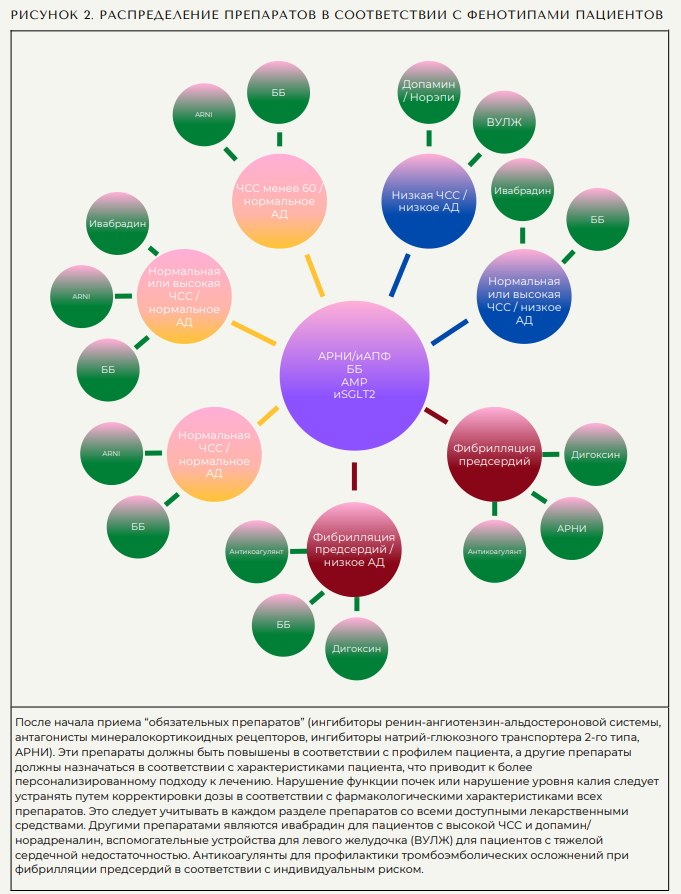
Учитывая, что зависимость доза-реакция часто неизвестна, большинство врачей могут начинать с низких доз, и целевые дозы вряд ли будут достигнуты за короткое время. Поэтому введение доз и добавление дополнительных классов лекарств следует проводить с учетом индивидуальных стратегий (рисунок 2). Некоторые стабильные пациенты, наблюдаемые в клиниках, уже принимают по крайней мере 2 или 3 препарата; у этих пациентов рекомендуется применение 4 классов препаратов. Кроме того, многие пациенты с СН de novo имеют сопутствующие заболевания и, следовательно, уже принимают 1 или 2 жизненно важных препарата для лечения гипертонии, диабета или вторичной профилактики или для лечения основных заболеваний.
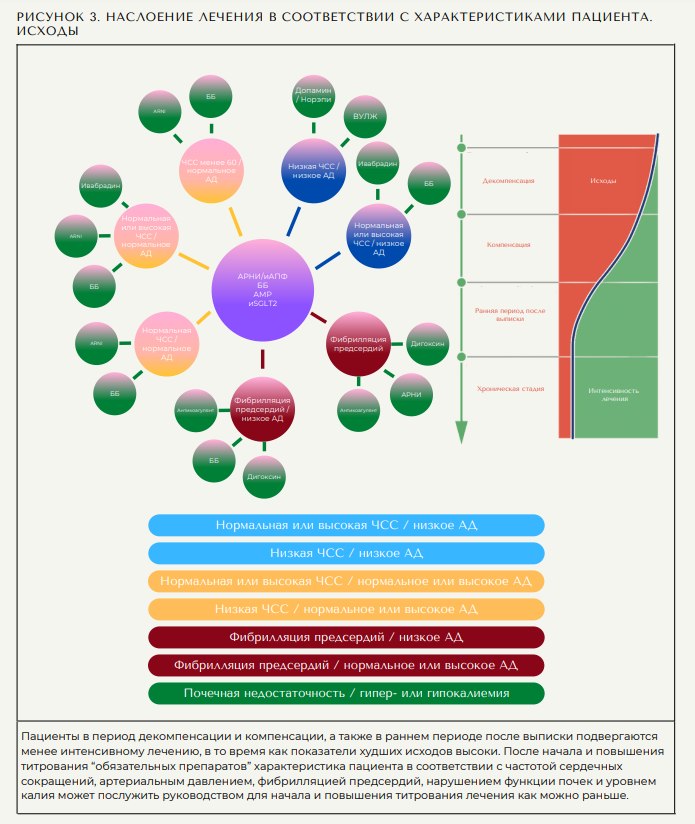
Введение 4 классов препаратов следует начинать как можно скорее после первого посещения и продолжать и увеличивать титрование в соответствии с характеристиками пациента и рекомендациями (49). В частности, после недавней декомпенсации применяемая медикаментозная нагрузка невелика (28-33). Таким образом, вскоре после неблагоприятного события, в частности у пациентов с СН de novo (25), происходит недостаточное лечение, несмотря на высокие показатели госпитализации и сердечнососудистой смертности. Пациентам с СН de novo, которые не привыкли к терапии СНнФВ, потребуется более тщательное применение препаратов, в то время как пациенты с известной СН могут быть либо переведены на более эффективные лекарства (с иАПФ на АРНИ), либо назначены дополнительные препараты. Либо при выписке, либо при необходимости пациенты должны получать АРНИ или ингибиторы АПФ, бетаадреноблокаторы, АМР и ингибиторы SGLT2. АРНИ могут применяться в соответствии с особенностями пациента и местными рекомендациями, которые постоянно обновляются (26). Повышение титрования до соответствующей и переносимой дозы следует проводить в любое время. Ограничения на повышение титрования следует контролировать путем мониторинга расчетной скорости клубочковой фильтрации и уровня калия в соответствии с рекомендациями для конкретных классов препаратов.
На рисунке 2 представлен терапевтический алгоритм, который соответствует рекомендациям основных руководств, но позволяет врачам применять препараты в соответствии с характеристиками пациента. К этому следует подходить гибко и учитывать, что клинические фенотипы пациентов могут регулярно меняться с течением времени. Необходимо учитывать вопросы стоимости и предпочтения пациентов. Цель состоит в том, чтобы пациенты как можно скорее получили как можно больше методов лечения, модифицирующих заболевание, поскольку исследования показали постепенную прогрессирующую пользу от интенсивного комбинированного лечения (53,54).
Вывод
Проведение медикаментозной терапии у пациентов с СНнФВ часто является сложной задачей, поскольку характеристики пациентов, включая их физиологические параметры и сопутствующие заболевания, ограничивают повышение титрования жизненно важных
препаратов. Доступ пациентов к лекарствам также может быть ограничен их доступностью, стоимостью и политикой назначения препаратов, с особыми проблемами в отдельных регионах мира (55). Фенотипирование пациента может способствовать персонализации лекарственной терапии, чтобы обеспечить пациентам индивидуальную терапию при одновременном использовании всех классов лекарств, доказавших свою эффективность в улучшении прогноза. Будущие рекомендации по СН должны пересмотреть алгоритмы лечения пациентов с СНнФВ, чтобы обеспечить быстрое внедрение всех препаратов для лечения СН в терапию. В будущем потребуются клинические исследования для определения наилучшей стратегии внедрения лекарств в клиническую практику, учитывая, что внедрение современной мультилекарственной терапии СНнФВ может увеличить ожидаемую продолжительность жизни до 8,4 лет (54).
Библиография
1. McMurray JJV, Solomon SD, Inzucchi SE, et al, DAPA-HF Trial Committees and Investigators. Dapagliflozin in patients with heart
failure and reduced ejection fraction. N Engl J Med. 2019;381: 1995–2008.
2. Packer M, Anker SD, Butler J, et al, EMPEROR- Reduced Trial Investigators. Cardiovascular and renal outcomes with empagliflozin in
heart failure. N Engl J Med. 2020;383:1413–1424.
3. Armstrong PW, Pieske B, Anstrom KJ, et al, VICTORIA Study Group. Vericiguat in patients with heart failure and reduced ejection
fraction. N Engl J Med. 2020;382:1883–1893.
4. Teerlink JR, Diaz R, Felker GM, et al, GALACTIC- HF Investigators. Cardiac myosin activation with omecamtiv mecarbil in systolic heart
failure. N Engl J Med. 2021;384:105–116.
5. SOLVD Investigators, Yusuf S, Pitt B, et al. Ef- fect of enalapril on mortality and the development of heart failure in asymptomatic
patients with reduced left ventricular ejection fractions. N Engl J Med. 1992;327:685–691.
6. CONSENSUS Trial Study Group. Effects of ena- lapril on mortality in severe congestive heart failure. Results of the Cooperative North
Scandi- navian Enalapril Survival Study (CONSENSUS). N Engl J Med. 1987;316:1429–1435.
7. CIBIS-II Investigators and Committees. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999;353:9–
13.
8. MERIT-HF Study Group. Effect of metoprolol CR/ XL in chronic heart failure: Metoprolol CR/XL Rand- omised Intervention Trial in
Congestive Heart Failure (MERIT-HF). Lancet. 1999;353:2001–2007.
9. Flather MD, Shibata MC, Coats AJS, et al. Ran- domized trial to determine the effect of nebivolol on mortality and cardiovascular
hospital admission
in elderly patients with heart failure (SENIORS). Eur Heart J. 2005;26:215–225.
10. McMurray JJV, Ostergren J, Swedberg K, et al. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet. 2003;362:767–771.
11. Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure.
Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999;341:709–717.
12. Swedberg K, Komajda M, Böhm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled
study. Lancet. 2010;376:875–885.
13. McMurray JJV, Packer M, Desai AS, et al. Angiotensin–neprilysin inhibition versus enalapril in heart failure. N Engl J Med.
2014;371:993–1004.
14. Seferovic PM, Ponikowski P, Anker SD, et al. Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices
and patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Cardiology.
Eur J Heart Fail. 2019;21: 1169–1186.
15. Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/ AHA guideline for the management of
heart fail- ure: a report of the American College of Cardiol- ogy/American Heart Association Task Force on Clinical Practice Guidelines
and the Heart Failure Society of America. J Am Coll Cardiol. 2017;70(6): 776–803.
16. Bhatt DL, Szarek M, Pitt B, et al, SCORED In- vestigators. Sotagliflozin in patients with diabetes
and chronic kidney disease. N Engl J Med. 2021;384:129–139.
17. Bhatt DL, Szarek M, Steg PG, et al, SOLOIST- WHF Trial Investigators. Sotagliflozin in patients with diabetes and recent worsening
heart failure. N Engl J Med. 2021;384:117–128.
18. Komajda M, Tavazzi L, Swedberg K, et al, SHIFT Investigators. Chronic exposure to ivabra- dine reduces readmissions in the
vulnerable phase after hospitalization for worsening systolic heart failure: a post-hoc analysis of SHIFT. Eur J Heart Fail. 2016;18:1182–1189.
19. Greene SJ, Fonarow GC, Vaduganathan M, Khan SS, Butler J, Gheorghiade M. The vulnerable phase after hospitalization for heart
failure. Nat Rev Cardiol. 2015;12:220–229.
20. Chioncel O, Lainscak M, Seferovic PM, et al. Epidemiology and one-year outcomes in patients with chronic heart failure and
preserved, mid- range and reduced ejection fraction: an analysis of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail.
2017;19:1574–1585.
21. Chioncel O, Mebazaa A, Harjola VP, et al, ESC Heart Failure Long-Term Registry Investigators. Clinical phenotypes and outcome of
patients hospitalized for acute heart failure: the ESC Heart Failure Long-Term Registry. Eur J Heart Fail. 2017;19:1242–1254.
22. Velazquez EJ, Morrow DA, DeVore AD, et al, PIONEER-HF Investigators. Angiotensin-neprilysin inhibition in acute decompensated
heart failure. N Engl J Med. 2019;380:539–548.
23. Butler J, Anstrom KJ, Felker GM, et al, Na- tional Heart Lung and Blood Institute Heart Failure Clinical Research Network. Efficacy
and safety of spironolactone in acute heart failure: the ATHENA- HF randomized clinical trial. JAMA Cardiol. 2017;2: 950–958.
Downloaded for Medicine VMMC (medicinevmmc@gmail.com) at Vardhman Mahavir Medical College and Safdarjung Hospital from
ClinicalKey.in by Elsevier on May 22, 2022. For personal use only. No other uses without permission. Copyright ©2022. Elsevier Inc. All
rights reserved.
JACC: HEART FAILURE VOL. 9, NO. 11, 2021 NOVEMBER 2021:775–783
24. Crespo-Leiro MG, Anker SD, Maggioni AP, et al, Heart Failure Association (HFA) of the Eu- ropean Society of Cardiology (ESC).
European Society of Cardiology Heart Failure Long-Term Registry (ESC-HF-LT): 1-year follow-up outcomes and differences across
regions. Eur J Heart Fail. 2016;18:613–625.
25. Maggioni AP, Anker SD, Dahlström U, et al, Heart Failure Association of the ESC. Are hospi- talized or ambulatory patients with heart
failure treated in accordance with European Society of Cardiology guidelines? Evidence from 12,440 pa- tients of the ESC Heart Failure
Long-Term Regis- try. Eur J Heart Fail. 2013;15:1173–1784.
26. Writing Committee, Maddox TM, Januzzi Jr. JL, et al. 2021 Update to the 2017 ACC expert consensus decision pathway for
optimization of heart failure treatment: answers to 10 pivotal is- sues about heart failure with reduced ejection fraction: a report of the
American College of Car- diology Solution Set Oversight Committee. J Am Coll Cardiol. 2021;77:772–810.
27. Marti CN, Fonarow GC, Anker SD, et al. Medi- cation dosing for heart failure with reduced ejec- tion fraction – opportunities and
challenges. Eur J Heart Fail. 2019;21:286–296.
28. Ouwerkerk W, Teng TH, Tromp J, et al. Effects of combined renin–angiotensin–aldosterone sys- tem inhibitor and beta-blocker
treatment on out- comes in heart failure with reduced ejection fraction: insights from BIOSTAT-CHF and ASIAN- HF registries. Eur J
Heart Fail. 2020;22:1472–1482.
29. Packer M, Poole-Wilson PA, Armstrong PW, et al. Comparative effects of low and high doses of the angiotensin-converting enzyme
inhibitor, lisi- nopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation. 1999;100: 2312–2318.
30. Konstam MA, Neaton JD, Dickstein K, et al, HEAAL Investigators. Effects of high-dose versus low-dose losartan on clinical outcomes
in patients with heart failure (HEAAL study): a randomised, double-blind trial. Lancet. 2009;374:1840–1848.
31. Allen LA, Fonarow GC, Liang L, et al, American Heart Association’s Get With The Guidelines Heart Failure (GWTG-HF) Investigators.
Medica- tion initiation burden required to comply with heart failure guideline recommendations and hospital quality measures.
Circulation. 2015;132: 1347–1353.
32. Willenheimer R, van Veldhuisen DJ, Silke B, et al, CIBIS III Investigators. Effect on survival and hospitalization of initiating treatment
for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: results of the randomized
Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation. 2005;112:2426–2435.
33. Khattab M, Parwani P, Abbas M, et al. Utili- zation of guideline-directed medical therapy in patients with de novo heart failure with
reduced ejection fraction: a Veterans Affairs study. J Family Med Prim Care. 2020;9:3065–3069.
34. Fonarow GC, Stough WG, Abraham WT, et al, OPTIMIZE-HF Investigators and Hospitals.
Characteristics, treatments, and outcomes of pa- tients with preserved systolic function hospital- ized for heart failure: a report from
the OPTIMIZE- HF Registry. J Am Coll Cardiol. 2007;50:768–777.
35. Desai AS, Vardeny O, Claggett B, et al. Reduced risk of hyperkalemia during treatment of heart failure with mineralocorticoid
receptor an- tagonists by use of sacubitril/valsartan compared with enalapril: a secondary analysis of the PARADIGM-HF trial. JAMA
Cardiol. 2017;2:79–85.
36. Shen L, Kristensen SL, Bengtsson O, et al. Dapagliflozin in HFrEF patients treated with mineralocorticoid receptor antagonists: an
anal- ysis of DAPA-HF. J Am Coll Cardiol HF. 2021;9: 254–264.
37. Bocchi EA, Böhm M, Borer JS, et al, SHIFT in- vestigators. Effect of combining ivabradine and b- blockers: focus on the use of
carvedilol in the SHIFT population. Cardiology. 2015;131:218–224.
38. Böhm M, Link A, Cai D, et al. Beneficial asso- ciation of b-blocker therapy on recovery from se- vere acute heart failure treatment:
data from the Survival of Patients With Acute Heart Failure in Need of Intravenous Inotropic Support trial. Crit Care Med. 2011;39:940–
944.
39. Prins KW, Neill JM, Tyler JO, Eckman PM, Duval S. Effects of beta-blocker withdrawal in acute decompensated heart failure: a
systematic review and meta-analysis. J Am Coll Cardiol HF. 2015;3(8):647–653.
40. Gattis WA, O’Connor CM,
Hasselblad V, Gheorghiade M, IMPACT-HF In- vestigators and Coordinators. Predischarge initia- tion of carvedilol in patients
hospitalized for decompensated heart failure: results of the Initi- ation Management Predischarge: Process for Assessment of
Carvedilol Therapy in Heart Failure (IMPACT-HF) trial. J Am Coll Cardiol. 2004;43: 1534–1541.
41. Jondeau G, Neuder Y, Eicher JC, et al, B- CONVINCED Investigators. B-CONVINCED: Beta- blocker CONtinuation Vs. INterruption in
patients with Congestive heart failure hospitalizED for a decompensation episode. Eur Heart J. 2009;30: 2186–2192.
42. Böhm M, Young R, Jhund PS, et al. Systolic blood pressure, cardiovascular outcomes and ef- ficacy and safety of sacubitril/valsartan
(LCZ696) in patients with chronic heart failure and reduced ejection fraction: results from PARADIGM-HF. Eur Heart J. 2017;38:1132–1143.
43. Serenelli M, Böhm M, Inzucchi SE, et al. Effect of dapagliflozin according to baseline systolic blood pressure in the Dapagliflozin and
Prevention of Adverse Outcomes in Heart Failure trial (DAPA- HF). Eur Heart. J. 2020;41:3402–3418.
44. Petrie MC, Verma S, Docherty KF, et al. Effect of dapagliflozin on worsening heart failure and cardiovascular death in patients with
heart failure with and without diabetes. JAMA. 2020;323:1353– 1368.
45. Anker SD, Butler J, Filippatos G, et al. Effect of Empagliflozin on cardiovascular and renal
Rosano et al 783 Drug Layering in Heart Failure
outcomes in patients with heart failure by baseline diabetes status: results from the EMPEROR-Reduced Trial. Circulation. 2021;143:
337–349.
46. Lam CSP, Butler J. Victims of success in fail- ure. Circulation. 2020;142(12):1129–1131.
47. McMurray JJV, Packer M. How should we sequence the treatments for heart failure and a reduced ejection fraction?: A redefinition
of evidence-based medicine. Circulation. 2021;143(9): 875–877. https://doi.org/10.1161/CIRCULATIONAHA. 120.052926
48. Packer M, McMurray JJV. Rapid evidence- based sequencing of foundational drugs for heart failure and a reduced ejection fraction.
Eur J Heart Fail. 2021;23(6):882–894.
49. Greene SJ, Butler J, Fonarow GC. Simulta- neous or rapid sequence initiation of quadruple medical therapy for heart failureoptimizing ther- apy with the need for speed. JAMA Cardiol. 2021;6(7):743–744.
50. Bhatt AS, Abraham WT, Lindenfeld J, et al. Treatment of HF in an era of multiple therapies: Statement from the HF Collaboratory. J
Am Coll Cardiol HF. 2021;9(1):1–12. https://doi.org/10. 1016/j.jchf.2020.10.014
51. Rosano GMC, Moura B, Metra M, et al. Patient profiling in heart failure for tailoring medical therapy. A consensus document of the
Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2021;23(6):872– 881.
Gallup DS,
52. McAlister
Leung AA, Armstrong PW. Meta-analysis: beta- blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern
Med. 2009;150(11):784–794.
53. Komajda M, Böhm M, Borer JS, et al. Incre- mental benefit of drug therapies for chronic heart failure with reduced ejection fraction:
a network meta-analysis. Eur J Heart Fail. 2018;20:1315– 1322.
54. Vaduganathan M, Claggett BL, Jhund PS, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological
therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three rando- mised controlled trials.
Lancet. 2020;396:121–128.
55. Psotka MA, Fiuzat M, Solomon SD, Chauhan C, et al. Challenges and potential improvements to patient access to pharmaceuticals:
examples from cardiology. Circulation. 2020;142(8):790–798.