Сердечно-сосудистые средства
Настоящая глава посвящена обзору физиологических основ применения сердечно-сосудистых препаратов. Все существующие препараты для лечения сердечно-сосудистых заболеваний можно объединить по фармакологическим свойствам в несколько групп. Кроме того, многие препараты используются для лечения различных заболеваний сердца.
ИНОТРОПНЫЕ ПРЕПАРАТЫ
Инотропные средства применяются для увеличения силы сокращения желудочков при нарушениях систолической функции миокарда. К фармакологическим препаратам этой группы относятся сердечные гликозиды, симпатомиметические амины и ингибиторы фосфодиэстеразы. Различаясь по механизмам своего действия, эти лекарственные средства усиливают сердечные сокращения за счет увеличения концентрации кальция в клетках, что сопровождается усилением взаимодействия между актином и миозином. Гемодинамический эффект инотропных препаратов’заключается в смещении сниженной кривой желудочковой функции (кривой Франка—Старлинга) вверх (рис. 17.1.) таким образом, чтобы ударный объем сердца и сердечный выброс возрастали без увеличения давления наполнения желудочков.
Дигиталис и другие сердечные гликозиды
Сердечные гликозиды часто называют «дигиталисом», поскольку типичные представители этого класса препаратов представляют собой экстракты наперстянки Digitalis purpurea. В данном контексте название дигиталис ис-
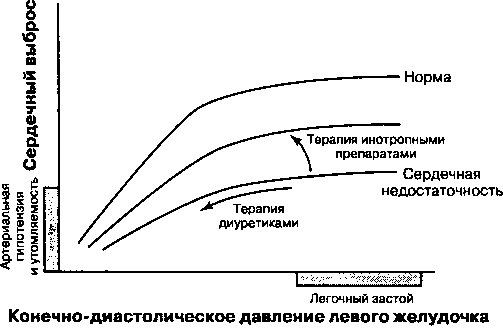
Рис. 17.1. Кривая сократительной способности желудочков (кривая Франка—Старлинга). При сердечной недостаточности кривая смещена вниз, так что при данном конечно-диастолическом давлении левого желудочка (КДДЛЖ) сердечный выброс ниже, чем у здорового человека. Диуретики снижают КДДЛЖ, но не изменяют положение кривой; таким образом, легочный застой уменьшается, но сердечный выброс продолжает снижаться. Инотропные препараты сдвигают кривую вверх к нормальному положению таким образом, что при любом КДДЛЖ сердечный выброс возрастает
пользуется для обозначения всей группы сердечных гликозидов, включая дигоксин, дигитоксин и уабаин. Эти соединения состоят из агликонового кольца (стероидное ядро и лактоновое кольцо), обеспечивающего их фармакологическую активность, и различного количества молекул сахара, которые влияют на фармакокинетические свойства препарата.
МЕХАНИЗМ ДЕЙСТВИЯ
Препараты дигиталиса обладают двумя положительными свойствами: 1) они улучшают нарушенную сократимость миокарда (механический эффект) и 2) удлиняют рефрактерный период АВ узла у больных с наджелудочковыми аритмиями (электрический эффект).
Механический эффект
Механизм действия, согласно которому дигиталис улучшает сократимость миокарда, заключается, по-видимому, в подавлении активности Ма+/К+-АТФазы (ионообменного насоса) сарколеммы, в норме обеспечивающей поддержание трансмембранного градиента Na+ и К+. Связываясь с Ма+/К+-АТФазой и угнетая ее активность, дигиталис способствует возрастанию уровня Na+ внутри клетки. Как показано на рис. 17.2., повышение содержания внутриклеточного натрия сопровождается снижением выхода из Са++ клетки за счет Ма+/Са++-обмена. Как следствие, в саркоплазматический ретикулум закачивается больше Са++. В результате,
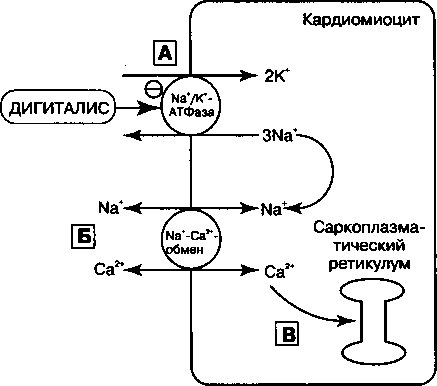
Рис. 17.2. Механизм действия дигиталиса (инотропный эффект). А. Дигиталис подавляет активность №+/К+-АТФазы сарколеммы, за счет чего внутриклеточноая концентрация Na+ возрастает. Б. При повышении в цитозоле [Na+] трансмембранный градиент Na+ падает; таким образом, Na+/ Са++-обмен обеспечивает снижение выхода Са++ из клетки. В. Избыток Са++ накапливается в саркоплазматическом ретикулуме так, что при последующих потенциалах действия к сократительным элементам в цитоплазме доставляется повышенное количество Са++ и сила сокращений возрастает
когда последующий потенциал действия возбуждает клетку, в миофиламенты высвобождается больше Са++, чем обычно, за счет чего сила сокращений увеличивается. Величина положительного инотропного эффекта препаратов коррелирует со степенью ингибирования 1Ча+/К+-АТФазы.
Электрический эффект
Дигиталис способен непосредственно влиять на электрические свойства миокарда. Помимо этого, он модифицирует эффекты вегетативной нервной системы, увеличивая тонус блуждающего нерва и снижая активность симпатической нервной системы.
В миокарде здорового человека основной терапевтический электрический эффект дигиталиса происходит в АВ узле (таблица 17.1), где он снижает скорость проведения импульса и увеличивает рефрактерность, в основном, за счет повышения тонуса блуждающего нерва. В результате дигиталис снижает частоту передачи предсердных импульсов через АВ узел к желудочкам. Это благоприятное воздействие приводит к уменьшению частоты желудочковых сокращений у больных с наджелудочковыми тахикардиями, в том числе мерцанием или трепетанием предсердий. Кроме того, увеличивая рефрактерность АВ узла, дигиталис способен купировать аритмии, обусловленные повторным входом волны возбуждения (re-entry), например, пароксизмальную наджелудочковую тахикардию.
В то же время, если концентрация дигиталиса возрастет до токсических пределов, дальнейшее увеличение тонуса блуждающего нерва и более выраженное торможение Ка+/К+-АТФазы может привести к нежелательным электрофизиологическим эффектам.
' Например, повышение концентрации дигиталиса оказывает три существенных воздействия на волокна Пуркинье предсердий и желудочков, которые могут привести к опасным аритмиям (рис. 17.3):
Таблица 17.1. Электрофизиологические эффекты дигиталиса
Область сердца |
Механизм действия |
Эффект |
|
Терапевтические эффекты АВ узел |
Вагусный эффект: |
1. Ф скорость передачи пред |
|
Ф скорость проведения импульса ? эффективный рефрактерный период |
сердных импульсов к желудочкам при наджелудочковых тахиаритмиях 2. Ф скорость проведения и Т рефрактерный период могут прервать re-entry ток, проходящий через АВ узел |
Область сердца |
Механизм действия |
Эффект |
|
Токсические эффекты Синоатриаль ный узел |
Т вагусное и непосредственной угнетение |
|
Предсердие |
Поздние постдеполяризации (триггерная активность), Т наклон фазы 4 деполяризации (Т автоматизм) Разнообразные воздействия на скорость проведения и Т рефрактерный период (возможна фрагментация проведения и аритмия re-entry) |
|
АВ узел |
Блокада прямого и опосредованного блуждающим нервом проведения импульса |
1. Блокада АВ узла (1, 2 или 3 степени) |
АВ-соединение (между АВ-узлом и пучком Гиса) |
Поздние постдеполяризации (триггерная активность), Т наклон фазы 4 деполяризации (? автоматизм) |
1. Ускоренный узловой ритм |
Волокна Пуркинье и миокард желудочков |
Поздние постдеполяризации (триггерная активность), Т наклон фазы 4 деполяризации (Т автоматизм), Ф скорость проведения и Т рефрактерный период (аритмия re-entry) Т наклон фазы 4 деполяризации (Т автоматизм) |
|
1. Смещение потенциала покоя в область менее отрицательных значений. Ингибирование №+/К+-АТФазы приводит к тому, что потенциал покоя становится менее отрицательным. Вспомним из главы 1, что под действием Ма+/К+-АТФазы из клетки обычно выходят 3 иона Na+ в обмен на 2 иона К+, движущихся внутрь клетки. Подавление активности ионообменного насоса приводит к снижению опосредованного им тока, направленного наружу, и сопровождается деполяризацией клетки. В результате происходит частичная потенциалзависимая инактивация быстрых На+-каналов и, как следствие, более медленный подъем фазы О деполяризации и снижение скорости проведения импульса (рис. 1.16). Замедление проведения, случайно возникающее в соседних клетках, увеличивает возможность развития аритмий по механизму re-entry.
2. Снижение длительности потенциала действия. При высоких концентрациях дигиталиса потенциал действия в миокарде укорачивается. Отчасти это связано с индуцируемым дигиталисом увеличением концентрации внутриклеточного [Са++], которое вызывает повышение активности Са++-зависимых К+-каналов. Открытие этих каналов способствует выходу К+ из клетки и сопровождается ее более быстрой реполяризацией. Кроме того, при высокой концентрации внутриклеточного [Са++] инактивируются Са++ каналы и уменьшается направленный внутрь клетки деполяризующий Са++ ток. Снижение длительности потенциала действия и сопряженное с ним укорочение рефрактерного периода увеличивают время, в течение которого волокна миокарда реагируют на внешнюю стимуляцию, обеспечивая, тем самым, большую возможность для возбуждения аритмических импульсов.
3. Усиленние автоматизма. Дигиталис усиливает клеточный автоматизм и способен генерировать эктопические ритмы в соответствии со следующими механизмами:
а. Менее отрицательный мембранный потенциал покоя индуцирует фазу 4 постепенной деполяризации даже в клетках, не являющихся водителями ритма (см. главу 11), при этом каждый раз при достижении величины порогового потенциала запускается потенциал действия.
б. Индуцируемое дигиталисом повышение концентрации внутриклеточного [Са++] инициирует поздние постдеполяризации (рис. 17.3). Если величина поздней постдеполяризации достигает порогового потенциала, генерируется потенциал действия (желудочковая экстрасистола). Желудочковые экстрасистолы могут привести к возникновению дополнительных поздних постдеполяризаций и развитию самоподдер-живающихся аритмий, например, желудочковой тахикардии.
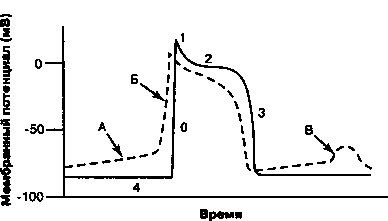
Рис. 17.3. Прямые эффекты дигиталиса на потенциал действия клеток Пуркинье. Сплошной линией показана деполяризация и реполяризация нормальной клетки; пунктирной линией показан эффект дигиталиса: максимальный диастолический потенциал менее отрицателен, что соответствует увеличению наклона фазы 4 деполяризации (А), обеспечивающей свойственный клетке автоматизм и потенциал для эктопических ритмов. Поскольку деполяризация клетки происходит при менее отрицательной разности потенциалов, скорость возрастания фазы 0 снижается (Б), а скорость проведения импульса замедляется; если такой же эффект гетерогенно возникает в соседних клетках, возникают условия для повторного входа волны возбуждения. При высоких концентрациях дигиталиса возникают поздние постдеполяризации (В), сопровождающиеся повышением внутриклеточной концентрации кальция, что в итоге приводит к развитию триггерных тахиаритмий
Таким образом, дигиталис в токсических концентрациях приводит к появлению нескольких видов эктопических ритмов или повторного входа волны возбуждения (таблица 17.1). Кроме того, усиление прямых и косвенных эффектов блуждающего нерва, обусловленное отравлением дигиталисом, замедляет проведение возбуждения в АВ узле, вызывая АВ-блокаду высокой степени, вплоть до полной блокады сердца.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
Препараты дигиталиса чаще всего применяют в качестве инотропного средства для лечения сердечной недостаточности, вызванной сниженной сократимостью желудочков (см. главу 9). Дигиталис повышает силу сердечных сокращений, усиливает сердечный выброс и, тем самым, улучшает изгнание крови из левого желудочка, а также способствует уменьшению его размеров и снижает повышенное диастолическое давление наполнения желудочков у больных с систолической дисфункцией. Дигиталис не оказывает благоприятного воздействия при сердечной недостаточности с нормальной сократимостью миокарда желудочков (например, при сердечной недостаточности с высоким сердечным выбросом вследствие тиреотоксикоза, при застое в легких, обусловленным стенозом митрального клапана или при изолированной диастолической дисфункции).
Использование дигиталиса как основы для терапии застойной сердечной недостаточности (ЗСН) несколько пошатнулось при появлении новых лекарственных препаратов, особенно ингибиторов ангиотензинпревращаю-щего фермента (АПФ; см. главу 9 и последующие). Тем не менее, дигиталис продолжает оставаться важным средством лечения больных с ЗСН, осложненной мерцанием предсердий (он обладает дополнительным свойством урежать ЧСС), или в тех случаях, когда назначение ингибиторов АПФ или диуретиков недостаточно эффективно. В отличие от ингибиторов АПФ, дигиталис не увеличивает ожидаемую продолжительность жизни у больных с хронической сердечной недостаточностью.
Дигиталис широко применяется и как антиаритмический препарат при лечении мерцания и трепетания предсердий и пароксизмальной наджелудочковой тахикардии (ПНЖТ). При мерцании и трепетании предсердий дигиталис снижает число импульсов, передаваемых через АВ узел, урежая тем самым ЧСС. Дигиталис, кроме того, эффективно прерывает ПНЖТ, вероятно, за счет усиления тонуса блуждающего нерва, который замедляет проведение возбуждения, удлиняет эффективный рефрактерный период и, таким образом, прерывает ток re-entry, протекающий через АВ узел.
В последние годы применение дигиталиса в качестве антиаритмиче-ского средства также сократилось, поскольку другие лекарственные препараты, в том числе p-блокаторы, антагонисты кальция и аденозин, более эффективны и быстрее оказывают свое действие. Вместе с тем, дигиталис остается препаратом выбора в лечении наджелудочковых аритмий при наличии застойной сердечной недостаточности.
ФАРМАКОКИНЕТИКА
Биодоступность дигиталиса, принимаемого перорально, колеблется в пределах 75-100%, и характеризуется большим объемом распределения. Основные лекарственные формы дигиталиса — дигоксин и дигитоксин — различаются между собой по способу выведения из организма: дигоксин в неизменном виде экскретируется почками, а дигитоксин метаболизируется в печени, поступает в желчь и подвергается кишечно-печеночной рециркуляции. Всасываемые метаболиты обладают сердечной активностью, и обеспечивают увеличенный период полувыведения для дигитоксина (168 часов по сравнению с 40 часами для дигоксина). Поскольку выведение дигитоксина практически не зависит от почек, его можно назначать больным с почечной недостаточностью. Из двух указанных препаратов дигоксин используется гораздо чаще.
Для достижения терапевтической концентрации дигиталиса в крови назначают насыщающие дозы. Величина поддерживающей дозы зависит от способности больного выделять лекарственный препарат (например, от его возраста или функции почек в случае дигоксина). Если насыщающие дозы не назначаются, постоянная концентрация дигоксина или дигитоксина устанавливается в течение 4—5 периодов полувыведения, то есть 7 дней и 3 недель, соответственно. Поддерживающую дозу дигиталиса необходимо постоянно контролировать с учетом состояния сердца больного (а также состояния почек при приеме дигоксина) с тем, чтобы избежать передозировки.
ТОКСИЧНОСТЬ
Возможность токсического эффекта дигиталиса весьма велика, что обусловлено небольшими различиями между токсической и терапевтической концентрациями. Многие побочные эффекты незначительны, однако возможно развитие опасных для жизни аритмий.
К внесердечным признакам острого отравления дигиталисом часто относятся нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, анорексия), которые, как полагают, опосредованы влиянием дигоксина на продолговатый мозг. К сердечным токсическим эффектам относят разнообразные аритмии (таблица 17.1), которые предшествуют внесердечным симптомам. Наиболее типичным нарушением ритма считается появление желудочковых экстрасистол. Кроме того, может развиться АВ-блокада различной степени, обусловленная влиянием препарата на проведение в АВ узле, как непосредственно, так и через воздействие на тонус блуждающего нерва. Токсический эффект дигиталиса является самой частой причиной не связанной с механизмом re-entry наджелудочковой тахикардии (вызванной усилением автоматизма или поздними постдеполяризациями).
На тяжесть интоксикации дигиталисом влияют многие факторы, самым типичным из них является гипокалиемия, часто обусловленная сочетанным приемом диуретиков. Гипокалиемия усиливает токсичность дигиталиса, поскольку еще более тормозит активность Ка+/К+-АТФазы. Среди других состояний, которые способствуют отравлению дигиталисом, следует назвать гипомагнезиемию и гиперкальциемию. Кроме того, одновременный прием хинидина приводит к увеличению концентрации дигоксина в крови за счет снижения его экскреции и уменьшения объема его распределения. Таким образом, чтобы избежать такого осложнения, при добавлении хинидина представляется благоразумным наполовину уменьшить дозу дигоксина.
Лечение тахиаритмий, вызванных приемом дигиталиса, заключается в назначении калия (если имеется гипокалиемия) и, зачастую, лидокаина (см. ниже). При АВ-блокаде высокой степени может возникнуть необходимость во временном водителе ритма. Больным с выраженной интоксикацией удается спасти жизнь назначением Fab-фрагментов антител к дигиталису.
Симпатомиметические амины
Симпатомиметические амины — это инотропные препараты, которые связываются с р(-рецепторами миокарда. Стимуляция этих рецепторов приводит к повышению активности аденилатциклазы и возрастанию продукции цАМФ (рис. 17.4). В свою очередь цАМФ активирует проте-инкиназы, которые участвуют в фосфорилировании медленных кальциевых каналов и способствуют, тем самым, поступлению кальция внутрь клетки. При увеличении поступления кальция в клетки запускается механизм высвобождения Са2+ из саркоплазматического ретикулума, за счет чего сила сокращений возрастает. Из симпатомиметических аминов в лечении острой сердечной недостаточности наилучшими оказываются внутривенные вливания допамина и добутамина. Норадреналин, адреналин и
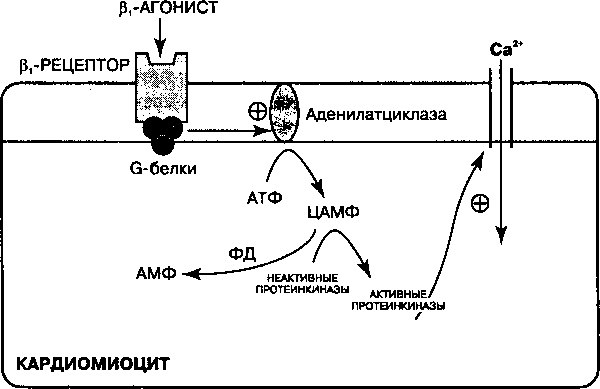
Рис. 17.4. Механизм увеличения содержания внутриклеточного [Са++] за счет стимуляции р-ад-ренергических рецепторов. При стимуляции 01 -рецепторов G-белки (белки, регулирующие гуаниновые нуклеотиды) активируют аденилатциклазу. В результате возрастает продукция цАМФ, который при участии протеинкиназы опосредует фосфорилирование клеточных белков, включая ионные каналы. Фосфорилирование медленных Са2+-каналов приводит к увеличению поступления кальция внутрь клетки. В деградации цАМФ участвует фосфодиэстераза (ФД)
изопротеренол применяют в особых случаях, о которых речь пойдет ниже. В таблице 17.2 приведены данные о влиянии этих препаратов на рецепторы и их основные гемодинамические эффекты.
Допамин — это эндогенный катехоламин и предшественник норадреналина. Он обладает необычным сочетанием свойств, которые делают его привлекательным для лечения сердечной недостаточности, сопровождающейся артериальной гипотонией и нарушением кровоснабжения почек. На поверхности клеток находится несколько типов рецепторов с различным сродством к допамину. В низких дозах, < 2 мкг/кг/мин, допамин взаимодействует, в основном, с D]-допаминергическими рецепторами, которые расположены в сосудах почек и брыжейки. Стимуляция этих рецепторов сопровождается местной вазодилатацией и увеличением почечного кровотока и клубочковой фильтрации, что способствует диурезу. Инотропный эффект средних доз допамина — от 2 до 10 мкг/кг/мин — осуществляется за счет непосредственной стимуляции Р)-рецепторов и опосредованной — за счет ускорения высвобождения норадреналина (НА) из окончаний симпатических нервных волокон. При этом повышается ЧСС, сократимость миокарда и ударный объем и, как результат, возрастает сердечный выброс.
Допамин, применяемый в высоких дозах, 10 мкг/кг/мин, стимулирует и системные а-рецепторы, вызывая, тем самым, вазоконстрикцию и увеличение общего сосудистого сопротивления. Допамин в высоких дозах показан при гипотензивных состояниях, например, при шоке. Однако, для большинства больных с сердечной недостаточностью такие дозы неприемлемы, поскольку сокращение периферических сосудов влечет за собой возрастание сопротивления, которое должно преодолевать сердце во время своего сокращения (т. е. имеет место более высокая постнагрузка), что еще более снижает выброс крови из левого желудочка.
Токсический эффект допамина проявляется при введении препарата в высоких дозах. Среди основных побочных эффектов следует отметить ускорение ЧСС (сопровождающееся увеличением потребности миокарда в кислороде) и развитие тахиаритмий.
Таблица 17.2. Эффекты симпатомиметических препаратов
Стимуляция рецепторов
Препарат |
Dj (Тпочечная перфузия) |
а (вазоконстрикция) |
(Усократимость) |
Р2 (вазодилатация) |
Допамин |
+ |
+ + + + |
+ + + + |
+ + |
(низкая доза) |
(высокая |
(средняя или |
' (средняя |
|
доза) |
высокая доза |
доза) |
||
Добутамин |
0 |
+ |
++++ |
+ |
Норадреналин |
0 |
++++ |
++++ |
0 |
Адреналин |
0 |
++++ |
++++ |
++ |
Изопротеренол |
0 |
0 |
++++ |
++++ |
Добутамин — синтетический аналог допамина, который стимулирует р(-, р2- и а-рецепторы. Он увеличивает сократимость миокарда путем прямого действия на pj-рецепторы, но не влияет на сопротивление периферических сосудов, поскольку уравновешивает вазоконстрикцию и вазодилатацию, опосредуемые, соответственно, а- и р2- рецепторами. Иными словами, он показан для лечения ЗСН, не сопровождающейся артериальной гипотонией. В отличие от допамина, добутамин не стимулирует допаминергические рецепторы (т. е. не оказывает вазодилатирующего эффекта на почечные сосуды), а также не ускоряет высвобождение норадреналина из окончаний периферических нервов. Подобно допамину, его применяют для кратковременной терапии (менее 1 недели), после чего эффективность препарата падает, в основном, за счет снижения чувствительности к нему адренергических рецепторов. Основным побочным эффектом до-бутамина является развитие тахиаритмий.
Норадреналин — эндогенный катехоламин, синтезируемый из допамина в адренергических постганглионарных нервах и клетках мозгового слоя надпочечников (где он является и конечным продуктом синтеза, и предшественником адреналина). Стимулируя Р]-адренергическую активность, норадреналин оказывает положительный инотропный и положительный хронотропный эффекты. Воздействуя на периферические а-рецепторы, норадреналин выступает также в роли мощного вазоконстриктора. Повышение общего периферического сосудистого сопротивления сопровождается повышением среднего артериального давления.
Благодаря наличию перечисленных эффектов, норадреналин находит применение в лечении больных, страдающих от «теплового шока», при котором сочетанное нарушение сократимости миокарда и периферической вазодилатации приводит к падению артериального давления. В то же время, способность этого препарата вызывать мощную вазоконстрикцию снижает его привлекательность в лечении большинства случаев шока по сравнению с другими лекарственными средствами. Среди побочных эффектов, вызываемых норадреналином, отмечают развитие ишемии (обусловленной увеличением постнагрузки и силы сокращений миокарда) и тахиаритмий.
Адреналин — основной эндогенный катехоламин, продуцируемый в мозговом слое надпочечников; он образуется при декарбоксилировании норадреналина. Как видно из таблицы 17.2., адреналин является агонистом а-, и |32-рецепторов. При внутривенном введении в низких дозах (< 0.01 мкг/кг/мин) адреналин стимулирует Pj-рецепторы, за счет чего повышается сократимость желудочков, укорачивается время систолы и ускоряется генерация импульса (например, за счет увеличения скорости фазы 4 деполяризации в клетках синусного узла). В результате возрастают ударный объем сердца, ЧСС и сердечный выброс. Вместе с тем, в этом диапазоне концентраций вазодилатация, опосредуемая стимуляцией р2-ре-цепторов, может вызвать падение общего периферического сосудистого сопротивления и артериального давления.
В более высоких дозах (> 0.2 мкг/кг/ мин) адреналин оказывает очень мощное сосудосуживающее действие, обусловленное тем, что опосредуемая а-рецепторами вазоконстрикция преобладает над стимулируемой через 02-рецепторы вазодилатацией. В этом случае эффекты положительной инотропии, положительной хронотропии и вазоконстрикции направлены на повышение артериального давления.
Поэтому адреналин чаще используют в тех случаях, когда необходима инотропная и хронотропная стимуляция, например, при остановке сердца. Вазоконстрикция, обусловленная стимуляцией а-рецепторов, окажется в данной ситуации благоприятной, поскольку будет препятствовать падению артериального давления. Типичным токсическим эффектом препарата является развитие тахиаритмий. Адреналин не следует назначать больным, принимающим 0-блокаторы, поскольку несбалансированная вазоконстрикция, опосредуемая стимуляцией сц-рецепторов, может спровоцировать развитие острой выраженной артериальной гипертензии и ее осложнений (см. главу 13).
Изопротеренол представляет собой синтетический аналог адреналина. В отличие от норадреналина и адреналина, это «чистый» агонист 0-рецеп-торов, стимулирующий исключительно 0Г и 02-рецепторы и практически не влияющий на а-рецепторы. Изопротеренол оказывает положительный инотропный и хронотропный эффект на миокард, чем способствует увеличению сердечного выброса. Стимуляция 02-рецепгоров периферических сосудов сопровождается их вазодилатацией и снижением периферического сопротивления, что может вызвать падение артериального давления.
Изопротеренол иногда применяют в экстренных ситуациях для увеличения ЧСС у больных с брадикардией или блокадой сердца (например, в качестве временной меры перед имплантацией водителя ритма). Он оказывает положительный эффект и у больных с систолической дисфункцией и низкой ЧСС в сочетании с высоким системным сосудистым сопротивлением (с такой ситуацией иногда сталкиваются у больных, перенесших операцию на сердце и принимавших до этого бета-блокаторы). Изопротеренол противопоказан больным с ишемией миокарда, у которых повышение ЧСС и инотропная стимуляция могут еще больше увеличить потребность миокарда в кислороде).
Ингибиторы фосфодиэстеразы
Амринон и милринон относятся к инотропным агентам, не принадлежащим ни к сердечным гликозидам, ни к катехоламинам. Их положительный инотропный эффект обусловлен торможением активности фосфодиэстеразы в кардиомиоцитах (рис. 17.4). За счет этого уменьшается деградация внутриклеточного цАМФ, который способствует повышенному поступлению [Са++] внутрь клетки и усилению силы сердечных сокращений. Кроме того, эти препараты оказывают сосудорасширяющее действие.
Амринон и милринон применяют для лечения ЗСН лишь в тех случаях, когда не удается добиться удовлетворительного эффекта с помощью обычных вазодилататоров, дигиталиса и диуретиков. Это обусловлено высокой частотой развития побочных эффектов ингибиторов фосфодиэстеразы, включая тяжелые желудочковые аритмии. Данные о том, что длительное применение амринона приводит к улучшению клинического состояния больных с ЗСН, отсутствуют, в то же время, при длительном применении милринона было реально продемонстрировано увеличение смертности. Использование этих препаратов в настоящее время ограничено кратковременной терапией больных, находящихся в стационаре.
Основные эффекты инотропных препаратов представлены в таблице 17.3.
Таблица 17.3. Инотропные лекарственные препараты
Препарат |
Механизм действия |
Основные побочные эффекты |
Сердечные гликозиды |
Ингибирование активности |
ЖКТ: тошнота, рвота |
.• Дигоксин |
Ка+/К+-АТФазы сарколем- |
Сердце: предсердные, уз |
|
• Дигитоксин Симпатомиметические амины |
мы |
ловые и желудочковые тахиаритмии; блокада АВ узла высокой степени |
• Допамин |
Низкие дозы (<2 мкг/кг/ мин): стимуляция Dj-реце-пторов приводит к дилатации почечных и мезентериальных артерий (облегчение . диуреза) Средние дозы (2-10 мкг/кг/ мин): стимуляция Pj-рецеп-торов и выброс норадреналина из окончаний симпатических нервов (инотропный эффект) Высокие дозы(>10 мкг/кг/ мин): стимуляция а-рецеп-торов (периферическая вазоконстрикция) |
Тахикардия, аритмии, артериальная гипертензия, привыкание к препарату |
• Добутамин |
Стимуляция рг, р2- и а-ре-цепторов |
Тахиаритмии, привыкание к препарату |
Ингибиторы фосфоди |
Повышение содержания |
ЖКТ: тошнота, рвота |
эстеразы |
внутриклеточного цАМФ за |
Сердце: аритмии, тром |
• Амринон |
счет торможения его дегра |
боцитопения (только ам |
• Милринон |
дации под действием фосфодиэстеразы |
ринон): |
ВАЗОДИЛАТАТОРЫ
Сосудорасширяющие препараты играют центральную роль в лечении сердечной недостаточности и артериальной гипертензии. Как было описано в главе 9, снижение сердечного выброса при ЗСН влечет за собой активацию двух важнейших компенсаторных систем: адренергической нервной системы и, вследствие снижения почечного кровотока, ренин-ангиотензиновой системы (рис. 9.9.). В результате такой активации в кровоток высвобождаются два мощных вазоконстриктора: норадреналин и ангиотензин II. Связываясь с рецепторами на поверхности артериол и вен, эти гормоны оказывают сосудосуживающее действие. Вначале такое сужение сосудов при ЗСН оказывается благоприятным, поскольку способствует максимальному увеличению преднагрузки левого желудочка (за счет сужения вен) и поддержанию на достаточном уровне системного артериального давления (за счет сужения артерий).
Однако сужение вен, в конце концов, может привести к избыточному венозному возврату крови в сердце, наряду с повышением гидростатического давления в легочных капиллярах и развитием застоя в малом круге кровообращения. Кроме того, спазм артериол сопровождается возрастанием сопротивления, которое должен преодолевать ЛЖ во время сокращения, и, в конечном итоге, препятствует сердечному выбросу. Сосудорасширяющая терапия, направленная на устранение избыточного сужения вен и артериол, снижает застой в малом круге и усиливает сердечный выброс (см. рис. 9.10).
Вазодилататоры обладают и антигипертензивным действием. Вспомним из главы 13, что артериальное давление представляет собой произведение сердечного выброса и общего сосудистого сопротивления. Вазодилататоры уменьшают сопротивление артериол и, тем самым, снижают повышенное артериальное давление.
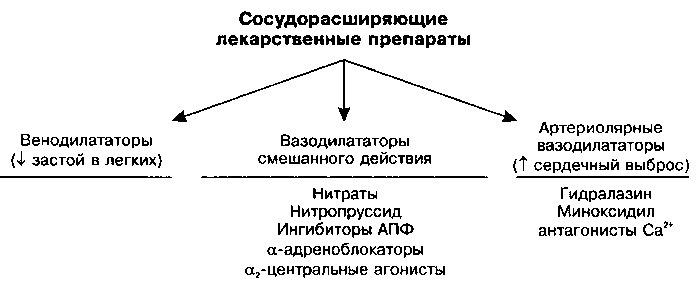
Сосудосуживающие препараты отдельных классов действуют на определенные участки сосудистого русла (рис. 17.5). Нитраты, например, являются преимущественно венодилататорами, а гидралазин — это препарат, расширяющий артериолы. Некоторые препараты, в том числе ингибиторы АПФ, а-блокаторы и нитропруссид натрия, являются комбинированными вазодилататорами и воздействуют как на вены, так и на артерии.
Ингибиторы ангиотензинпревращающего фермента
Ренин-ангиотензиновая система играет существенную роль в поддержании регуляции функций сердечно-сосудистой системы. Большое значение (рис. 17.6) при этом ангиотензин II (АП), который образуется при расщеплении ангиотензина I при участии ангиотензинпревращающего фермента (АПФ). Все эффекты АП, влияющие на регуляцию уровня артериального давления, опосредованы его связыванием с рецепторами к ангиотензину II подтипа АТ] (см. рис. 13.6). Взаимодействие с этим рецептором инициирует серию внутриклеточных реакций, которые, среди прочих эффектов, приводят к вазоконстрикции и выбросу из надпочечников альдостерона, способствующего реабсорбции Na+ из дистальных канальцев нефрона. Благодаря своему действию на сосудистый тонус и гомеостаз натрия, АП играет важную роль в регуляции артериального
Рис. 17.5. Сосудорасширяющие препараты и точки их приложения: вены, артериолы или вены + артерии.
Рис. 17.6. Ренин-ангиотензиновая система. Под действием ангиотензинпревращающего фермента (АПФ) образуется ангиотензин II, который вызывает вазоконстрикцию, задержку натрия и повышение активности симпатической нервной системы. Ингибиторы АПФ и антагонисты рецепторов ангиотензина II тип 1 (АТО устраняют эти эффекты. АПФ, кроме того, ускоряет деградацию природного вазодилататора брадикинина; следовательно, ингибирование АПФ, но не АТ!-рецепторов, сопровождается аккумуляцией брадикинина и усилением вазодилатации давления и объема циркулирующей крови. Ингибиторы АПФ, блокируя образование АП, снижают системное артериальное давление (уменьшают вазоконстрикцию) и ускоряют натрийурез (например, снижая уровень альдостерона и уменьшая реабсорбцию Na+ из дистальных канальцев).
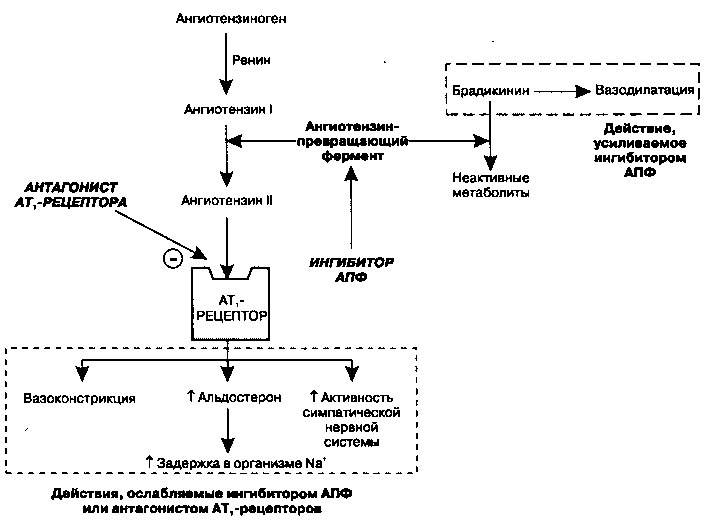
Еще одно свойство ингибиторов АПФ, которым, вероятно определяются их гемодинамические эффекты, связано с метаболизмом брадикинина (БК), как это показано на рис. 17.6. Естественный вазодилататор БК обычно под действием ангиотензинпревращающего фермента деградирует до неактивных метаболитов, следовательно, ингибиторы АПФ препятствуют его распаду. В результате БК накапливается и вносит определенный вклад в антигипертензивный эффект этих препаратов, вероятно за счет стимуляции высвобождения из эндотелиальных клеток оксида азота и биосинтеза сосудорасширяющих простагландинов.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
Артериальная гипертензия
У больных с артериальной гипертензией без ЗСН ингибиторы АПФ снижают уровень артериального давления, практически не влияя на сердечный выброс и ЧСС. Можно было бы полагать, что, воздействуя на ре-нин-ангиотензиновую систему, препараты этого класса будут эффективны только в лечении больных с «высоко-рениновой» гипертензией, однако, это не так. Напротив, они эффективны у большинства больных артериальной гипертензией независимо от уровня ренина в сыворотке крови. Причины такого явления остаются неясными и могут быть связаны с антигипертензивным эффектом брадикинина и упоминавшихся выше сосудорасширяющих простагландинов. Кроме того, в ряде исследований была обнаружена активность ренин-ангиотензиновой системы в тканях, в том числе, в сосудистой стенке, где эффект ингибиторов АПФ может осуществляться независимо от концентрации ренина в крови.
У больных артериальной гипертензией ингибиторы АПФ повышают почечный кровоток, обычно не изменяя скорость клубочковой фильтрации (СКФ), что обусловлено дилатацией как афферентных, так и эфферентных клубочковых артериол. Ингибиторы АПФ в качестве монотерапии при артериальной гипертензии оказались столь же эффективными, как диуретики и 0-блокаторы, но лучше переносились больными. В отличие от диуретиков, они не обладали нежелательным действием на уровень глюкозы или липидов в сыворотке крови. Было показано, что ингибиторы АПФ являются препаратами первого ряда в терапии артериальной гипертензии у больных сахарным диабетом, поскольку они замедляют прогрессирование диабетической нефропатии (включающей в себя прогрессирующую почечную недостаточность, протеинурию и артериальную гипертензию), положительно влияя на давление внутри клубочков.
Застойная сердечная недостаточность
При ЗСН ингибиторы АПФ снижают периферическое сосудистое сопротивление (уменьшают постнагрузку) и давление наполнения желудочков (уменьшают преднагрузку), а также увеличивают сердечный выброс. Степень увеличения сердечного выброса обычно соответствует падению периферического сосудистого сопротивления, так что артериальное давление остается неизменным (вспомним, что АД = СВ х ОПСС). Исключение составляют больные со сниженным внутрисосудистым объемом крови, что может быть результатом чрезмерно агрессивной терапии диуретиками. Увеличение сердечного выброса при ЗСН влечет за собой уменьшение нейрогуморальной стимуляции (см. главу 9), поэтому исходно повышенный уровень норадреналина падает. Кроме того, было показано, что выживаемость больных с симптомами сердечной недостаточности при лечении их ингибиторами АПФ существенно возрастает, и оказывается выше, чем при лечении ЗСН любым другим лекарственным препаратом.
Из множества принимаемых внутрь ингибиторов АПФ лучше всего изучены три препарата: каптоприл, эналаприл и лизиноприл; в таблице 17.4. приведены препараты, доступные в настоящее время. Основной путь экскреции большинства ингибиторов АПФ — это их выведение с мочой, поэтому для больных с дисфункцией почек их дозировку следует уменьшить.
В главе 7 описано положительное влияние терапии ингибиторами АПФ на ремоделирование желудочков и выживаемость больных, перенесших инфаркт миокарда.
ТОКСИЧНОСТЬ
Побочные эффекты ингибиторов АПФ потенциально опасны, но довольно редки.
Артериальная гипотензия
Этот редкий побочный эффект появляется при использовании ингибиторов АПФ в лечении артериальной гипертензии. Наиболее вероятно его развитие у больных с сердечной недостаточностью, у которых в результате активной терапии развилась внутрисосудистая гиповолемия. У таких пациентов отмечается выраженная активация ренин-ангиотензиновой системы, вследствие чего повышенное артериальное давление удерживается, в основном, за счет сосудосуживающего действия ангиотензина II, циркулирующего в крови. Применение в такой ситуации ингибитора АПФ может вызвать артериальную гипотензию, обусловленную резким снижением уровня АП. Этот побочный эффект можно избежать путем временного уменьшения приема диуретиков и началом лечения ингибитором АПФ с низких доз.
Таблица 17.4. Лекарственные препараты, влияющие на активность ренин-ангиотензиновой системы
Частота применения |
Метаболический путь выведения |
|
|
Ингибиторы АПФ Доказана эффективность при АГ и ЗСН Каптоприл |
2—3 раза в день |
Почки |
Эналаприл |
2-4 раза в день |
Почки |
Фозиноприл |
4 раза в день |
Почки/печень |
Лизиноприл |
4 раза в день |
Почки |
Квинаприл |
2-4 раза в день |
Почки |
Рамиприл |
2—4 раза в день |
Почки |
Доказана эффективность только при АГ Беназеприл |
4 раза в день |
Почки |
Моэксиприл |
4 раза в день |
Печень/почки |
Трандолаприл |
4 раза в день |
Печень/почки |
|
Антагонисты рецепторов ангиотензина II Лозартан |
4 раза в день |
Печень/почки |
Вальсартан |
4 раза в день |
Печень/почки |
Гиперкалиемия
Поскольку ингибиторы АПФ опосредованно снижают концентрацию альдостерона в сыворотке, содержание калия в крови возрастает, однако клинически выраженная гиперкалиемия развивается редко. Среди состояний, при которых может иметь место дальнейшее увеличение концентрации в крови калия, влекущее за собой опасную гиперкалиемию, следует назвать почечную недостаточность, сахарный диабет (в связи с гипорени-немическим гипоальдостеронизмом, часто наблюдаемым у пожилых больных сахарным диабетом) и сопутствующий прием калийсберегающих диуретиков. Поэтому при назначении ингибиторов АПФ следует избегать применения таких диуретиков, равно как и препаратов калия.
Почечная недостаточность
Как упоминалось выше, назначение ингибиторов АПФ пациентам с внутрисосудистой гиповолемией может привести к развитию артериальной гипотензии, а также к снижению перфузии почек и азотемии. Устранить это осложнение обычно удается путем нормализации объема циркулирующей крови или снижения дозы ингибитора АПФ.
У больных с двусторонним стенозом почечной артерии терапия ингибиторами АПФ может привести к развитию почечной недостаточности, поскольку у таких пациентов давление внутри клубочков и фильтрация определяются высоким сопротивлением эфферентных артериол клубочков (которое во многом зависит от АП). Прием ингибиторов АПФ резко снижает тонус эфферентных артериол и гидростатическое давление в клубочках, за счет чего СКФ в такой ситуации может ухудшиться.
Кашель
Раздражение верхних дыхательных путей, вызывающее сухой кашель, отмечается у 15 % больных, принимающих ингибиторы АПФ. Механизм этого явления остается неясным и может быть связан с повышением концентрации брадикинина. Этот побочный эффект проходит при отмене препарата.
Другие эффекты
К крайне редким побочным эффектам ингибиторов АПФ относятся ангионевротический отек и агранулоцитоз.
Антагонисты рецепторов ангиотензина II типа 1
Антагонисты рецепторов ангиотензина II типа 1 (называемые также антагонистами ATt-рецепторов) являются самым последним новшеством в ряду пероральных антигипертензивных препаратов. На сегодня известны рецепторы АП, по крайней мере, двух типов: АТ1 и АТ2. Все эффекты АП, влияющие на регуляцию уровня артериального давления, опосредованы его связыванием с рецепторами к ангиотензину II подтипа АТ] (в том числе вазоконстрикция, секреция альдостерона, реабсорбция Na+ в почках, повышенная активность симпатической нервной системы). АТ2-ре-цепторы в изобилии представлены во время внутриутробного развития, а также обнаружены в некоторых тканях взрослого человека, однако их роль неизвестна.
Антагонисты ATj-рецепторов относятся к непептидным лекарственным средствам, которые подавляют эффекты АП, конкурируя с ним на уровне АТ]-рецепторов. В результате угнетаются эффекты, опосредуемые АП, включая вазоконстрикцию, секрецию альдостерона и реабсорбцию Na+ в почках (рис. 17.6), это сопровождается снижением артериального давления у больных с артериальной гипертензией. Антагонисты АТгре-цепторов вызывают более полную блокаду ренин-ангиотензиновой системы, чем ингибиторы АПФ, поскольку последние не полностью блокируют образование АП (некоторое количество AI превращается в АП при участии иных, чем АПФ ферментов). В отличие от ингибиторов АПФ, антагонисты ATj -рецепторов не влияют на уровень брадикинина в сыворотке крови (рис. 17.6). В клинических исследованиях было показано, что антагонисты АТ!-рецепторов обладают антигипертензивным эффектом, сравнимым с таковым для ингибиторов АПФ и р-блокаторов.
Прототип антагонистов ATt-рецепторов, лозартан, быстро всасывается из ЖКТ, в течение часа его концентрация в сыворотке крови достигает максимальных значений. Выводится он, в основном, с желчью и частично с мочой. Его основной метаболит более активен, чем сам препарат и характеризуется более длительным периодом полувыведения. Аналогично ингибиторам АПФ, гипотензивный эффект лозартана усиливается при его назначении с тиазидными диуретиками. В отличие от ингибиторов АПФ, лозартан не вызывает кашель. Еще одно потенциальное преимущество лозартана заключается в том, что он снижает уровень мочевой кислоты (хотя механизм этого неизвестен); это является важным свойством, которое может оказаться полезным в лечении больных артериальной гипертензией, страдающих подагрой.
В клинических исследованиях было показано, что лозартан хорошо переносится больными. К возможным его побочным эффектам следует отнести артериальную гипотензию и гиперкалиемию (за счет сниженного уровня альдостерона), которые являются вполне предсказуемыми последствиями ингибирования АП.
Вазодилататоры прямого действия
В таблице 17.5 перечислены вазодилататоры прямого действия: гидралазин, миноксидил, нитропруссид и диазоксид. Гидралазин и миноксидил в основном используют перорально для длительной терапии, тогда как нитропруссид и диазоксид применяют внутривенно при более острых ситуациях.
Гидралазин является мощным прямым вазодилататором, осуществляющим свое действие на уровне прекапиллярных артериол, не оказывая никакого влияния на системные вены. Тонкие клеточные механизмы его действия остаются неизвестными. Падение артериального давления, обусловленное дилатацией артериол, приводит к опосредуемому барорецепторами повышению тонуса симпатической нервной системы и стимуляции сердечной деятельности (например, рефлекторная тахикардия). В результате у больных, страдающих коронарной болезнью сердца, может развиться ишемия миокарда. Чтобы смягчить эту нежелательную реакцию, гидралазин часто назначают в комбинации с 0-блокатором.
Гидралазин применяют, в основном, в качестве антигипертензивного средства второго ряда в комбинации с другими лекарственными препаратами, если не удается должным образом контролировать артериальное давление с помощью ингибиторов АПФ, антагонистов кальция, бета-блокаторов и диуретиков. Иногда для лечения сердечной недостаточности у больных с систолической дисфункцией гидралазин применяют в комбинации с венозным вазодилататором изосорбида динитратом. При такой комбинации у больных с мягкой и умеренной сердечной недостаточностью наблюдается улучшение состояния и снижение смертности, однако не столь эффективно, как при использовании ингибиторов АПФ.
Гидралазин характеризуется низкой биодоступностью, что обусловлено его интенсивным метаболизмом при первом прохождении через печень. Вместе с тем, превращение этого препарата зависит от скорости его ацетилирования, характерной для конкретного больного; в среднем, у 50% американцев скорость ацетилирования в печени высокая, а у остальных 50% — низкая. У лиц с низкой скоростью ацетилирования гидралазина его деградация в печени снижена, биодоступность повышена и, соответственно, антигипертензивный эффект более выражен; лица с высокой скоростью ацетилирования отличаются противоположными свойствами. Гидралазин характеризуется коротким временем полувыведения (2—4 часа), однако его эффект сохраняется в течение 12 часов, поскольку существенная часть препарата прочно связывается с сосудистой тканью
Таблица 17.5. Вазодилататоры прямого действия
Препарат |
Клиническое применение |
Способ назначения |
Основные побочные эффекты |
Гидралазин |
|
Перорально, в/в болюсы, внутримышечно |
|
Миноксидил |
• Хроническая терапия артериальной гипертензии |
Перорально |
|
Нитропруссид |
|
Внутривенные инъекции |
|
Диазоксид |
• Неотложная терапия артериальной гипертензии |
Внутривенный болюс |
|
К типичным побочным эффектам гидралазина относятся головная боль (расширение мозговых сосудов), учащенное сердцебиение (рефлекторная тахикардия), приливы (повышение системной вазодилатации), тошнота и анорексия. Как отмечалось выше, если гидралазин не комбинировать с p-блокатором, тахикардия, обусловленная рефлекторной стимуляцией активности симпатической нервной системы, может вызвать приступы стенокардии у больных с ишемической болезнью сердца. Наконец, у некоторых пациентов, особенно у больных с низкой скоростью ацетилирования гидралазина, может развиться волчаночноподобный синдром, для которого характерны арталгии, миалгии, сыпь и лихорадка. Этот синдром развивается примерно у 10 % лиц с низкой скоростью ацетилирования препарата и исчезает при его отмене.
Миноксвдил, аналогично гидралазину, вызывает дилатацию артериол, практически не влияя на венозный тонус. Механизм его действия заключается, возможно, в увеличении проницаемости калиевых каналов, в результате чего развивается гиперполяризация гладкомышечных клеток и происходит релаксация. Как и при приеме других соединений, избирательно вызывающим дилатацию артериол, рефлекторная стимуляция активности симпатической нервной системы сопровождается появлением ряда нежелательных эффектов, в том числе, увеличением ЧСС и сократимости миокарда, которые устраняются при параллельном назначении 0-блока-торов. Кроме того, снижение почечной перфузии часто приводит к задержке жидкости, поэтому обычно в качестве сопутствующей терапии назначают диуретики.
Миноксидил применяют в клинике, в основном, для лечения выраженной или трудно поддающейся лечению артериальной гипертензии; особенно он показан больным с почечной недостаточностью, у которых часто не удается добиться положительных результатов с помощью других антигипертензивных средств. Препарат хорошо всасывается из желудочно-кишечного тракта и метаболизируется, главным образом, в печени путем образования глюкуронидов, однако примерно пятая часть его выводится в неизменном виде с мочой. Несмотря на короткий период полувыведения, фармакологический эффект миноксидила сохраняется даже после снижения его концентрации в сыворотке крови; это, вероятно, обусловлено тем, что препарат, аналогично гидралазину, прочно связывается с сосудистой стенкой.
К побочным эффектам миноксидила, помимо рефлекторной стимуляции симпатической нервной системы и задержки жидкости в организме, относятся гипертрихоз (избыточный рост волос) и иногда экссудативный перикардит, механизм которого неизвестен.
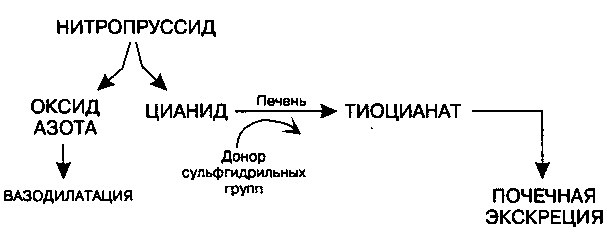
Нитропруссид натрия представляет собой мощный вазодилататор, влияющий на тонус как артериол, так и вен; его применяют для купирования гипертонического криза, а также в палатах интенсивной терапии внутривенно для контроля уровня артериального давления. Кроме того, этот препарат используют для уменьшения преднагрузки и постнагрузки на сердце при тяжелой ЗСН. Нитропруссид натрия представляет собой комплексное соединение железа, цианидных групп и нитрозной части; в результате его метаболизма в эритроцитах образуется оксид азота (рис. 17.7.). Оксид азота, активируя гуанилатциклазу в гладкомышечных клетках, вызывает вазодилатацию (см. главу 6 и ниже).
Гемодинамический эффект нитропруссида натрия обусловлен его способностью снижать артериальное сопротивление и повышать венозную емкость. У пациентов с ненарушенной функцией ЛЖ он вызывает снижение сердечного выброса за счет уменьшения венозного возврата (см. рис. 9.10). Однако у больных с нарушением сократительной функции ЛЖ
Рис. 17.7. Нитропруссид натрия представляет собой комплексное соединение железа, цианида (ЦН) и нитрозного кольца. В процессе его метаболизма в эритроцитах образуются ЦН и активный вазодилататор — оксид азота. ЦН метаболизируется в печени с образованием тиоцианата, который элиминируется через почки
индуцируемое нитропруссидом натрия снижение общего сосудистого сопротивления сопровождается увеличением сердечного выброса, так как венодилатация приводит к снижению преднагрузки и уменьшению возврата крови в сердце. При этом гидростатическое давление в легочных капиллярах падает, в результате чего уменьшается застой крови в малом круге кровообращения.
Нитропруссид натрия является препаратом выбора при гипертонических кризах (см. главу 13), что обусловлено его высокой эффективностью и быстротой действия. Поскольку терапия нитропруссидом натрия может сопровождаться опосредуемой барорецепторами рефлекторной активацией симпатической нервной системы, его часто комбинируют с симпа-толитиками, например, с 0-блокаторами.
Нитропруссид натрия следует применять в виде непрерывной внутривенной инфузии. Его эффект развивается в течение 30 с после введения; максимальный эффект достигается через 2 минуты и исчезает через несколько минут после окончания введения. В эритроцитах нитропруссид натрия метаболизируется до оксида азота и цианида, последний в присутствии донора сульфгидрильных групп трансформируется в печени в тиоцианат, который выводится с мочой. При длительном применении препарата, особенно при нарушении функции почек, происходит накопление тиоцианата и развивается токсическое действие, что проявляется в виде «пелены перед глазами», шума в ушах, потери ориентации и/или тошноты. Таким образом, если нитропруссид натрия применяется более 24 часов, крайне важно мониторировать уровень тиоцианата в сыворотке крови. Кроме того, слишком быстрое введение нитропруссида натрия или дефицит в печени источника сульфгидрильных групп могут привести к летальному исходу вследствие отравления цианидом, первыми признаками которого служат метаболический ацидоз, головная боль и тошнота с последующей потерей сознания.
Диазоксид представляет собой еще один мощный дилататор артериол. Механизм его действия заключается в активации АТФ-чувствительных калиевых каналов, в результате чего происходит гиперполяризация гладкомышечных клеток артериол и вазодилатация. Как и у других вазодилататоров, падение сопротивления сопровождается рефлекторной активацией симпатической нервной системы и тахикардией, а также задержкой в организме жидкости, обусловленной активацией ренин-ангиотензиновой системы. Ранее диазоксид использовали, в основном, при гипертонических кризах, однако, его применение сократилось в связи с появлением новых препаратов, которые лучше переносятся больными.
Диазоксид применяют только внутривенно, его действие наступает довольно быстро. Основными побочными действиями являются избыточная артериальная гипотензия и рефлекторная стимуляция симпатической нервной системы. Кроме того, диазоксид угнетает выделение инсулина клетками поджелудочной железы, что может привести к развитию гипергликемии.
Блокаторы кальциевых каналов (БКК)
Блокаторы кальциевых каналов (БКК) или антагонисты кальция (АК) рассматриваются здесь как единая группа препаратов, однако между отдельными представителями этого класса лекарственных средств имеются различия по целому ряду параметров. Общим свойством блокаторов Са++-каналов является их способность препятствовать входу Са++ через мембранные каналы в кардиомиоциты и гладкомышечные клетки. В ткани миокарда было обнаружено два типа потенциалзависимых Са++-кана-лов, называемых, соответственно каналами L- и Т-типов. Каналы L-типа ответственны за вход Са++, который создает фазу 2 потенциала действия («плато» на рис. 1.13). Роль Са++-каналов Т-типа, вероятно, состоит в обеспечении начальной деполяризации узловых тканей. Современные БКК влияют на каналы L-типа.
В настоящее время клеточные механизмы действия антагонистов кальция частично расшифрованы. Повышение концентрации внутриклеточного Са++ сопровождается усилением сократимости как миокарда, так и гладкой мускулатуры сосудов. В обоих случаях конечным результатом блокады Са++-каналов оказывается снижение количества Са++, доступного для сократительных белков внутри клетки, что выражается в расслаблении гладких мышц сосудов и негативном инотропном эффекте на миокард.
Гладкомышечные клетки сосудов
Сокращение гладких мышц сосудов зависит от концентрации Са++в цитоплазме клеток, которая регулируется трансмембранным потоком Са++ через потенциалзависимые Са++-каналы при деполяризации клетки. Внутри клетки Са++ взаимодействует с кальмодулином с образованием Са++-кальмодулинового комплекса. Этот комплекс стимулирует киназу легких цепей миозина, которая участвует в их фосфорилировании и обеспечивает, тем самым, взаимодействие миозина и актина, приводящее к сокращению гладких мышц. БКК способствуют расслаблению гладкой мускулатуры кровеносных сосудов за счет торможения поступления Са++ в клетку через потенциалзависимые каналы. Все органы, имеющие гладкую мускулатуру, включая желудочно-кишечный тракт, матку и бронхиальную ткань, подвержены расслабляющему действию этих препаратов.
Кардиомиоциты
Взаимодействие сократительных белков кардиомиоцитов тоже зависит от поступления Са++ в клетку при ее деполяризации, однако механизм, обеспечивающий такое взаимодействие, в данном случае иной, чем в гладкомышечных клетках. Вход Са++в кардиомиоциты во время деполяризации запускает дополнительное высвобождение Са++из саркоплазматического ретикулума, вызывая, тем самым, их сокращение (см. главу 1). БКК, блокируя вход Са++, препятствуют сопряжению возбуждения и сокращения и уменьшают силу сокращений. Поскольку очаги автоматизма сердца (синусовый и АВ узлы) в наибольшей степени нуждаются в поступлении Са++ для их деполяризации, можно полагать, что АК должны уменьшать соотношение между возбуждением в синусовом узле и проведением импульса в АВ узле. Эти свойством обладают не все АК (Таблица 17.6). Влияние этих препаратов на проведение возбуждения в миокарде зависит, по-видимому, не только от того, уменьшает ли тот или иной АК поток входящего в клетку Са++, но и от того, способен ли он задерживать возвращение Са++-каналов в исходное состояние до активации. Верапамил и дилтиазем обладают такой способностью, а нифедипин и другие производные дигидропиридина — нет (см. Ниже).
Таблица 17.6. Блокаторы кальциевых каналов
Препарат |
Вазодилатация |
Отрицательный инотропный эффект |
Торможение проведения в АВ узле |
Основные побочные эффекты |
Верапамил |
+ |
4-4-4- |
4-4-4- |
|
|
Дилтиазем Производные |
4-4- |
4-4- |
4-4- |
|
Динидропи-ридина: Амлодипин Фелодипин Исрадипин Никардипин Нифедипин Нисолдипин |
+++ |
ОТ 0 до 4- |
0 |
|
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
Благодаря своему влиянию на гладкомышечные клетки кровеносных сосудов и кардиомиоциты, АК показаны для лечения целого ряда сердечно-сосудистых заболеваний; механизмы их действия перечислены в таблице 17.7. Положительный эффект при стенокардии обусловлен способностью этих препаратов снижать потребность миокарда в кислороде и повышать обеспечение тканей кислородом за счет дилатации коронарных артерий. Это свойство оказывается важным и при лечении спазма.
БК.К. часто применяют для лечения артериальной гипертензии; в отличие от 0-блокаторов и ингибиторов АПФ, они особенно эффективны у пожилых людей. Наиболее мощными вазодилататорами этого класса являются нифедипин и другие производные дигидропиридина, тем не менее, дилтиазем и верапамил тоже достаточно эффективны.
Обычно БКК назначают для приема внутрь; каждый из этих препаратов существует в лекарственных формах для приема один раз в день. Способы выведения их из организма различны. Например, нифедипин и верапамил элиминируются, главным образом, с мочой, а дилтиазем выводится через печень. К типичным побочным эффектам (таблица 17.7) относятся развитие артериальной гипотензии, обусловленной избыточной дилатацией, а также отек лодыжек, вызываемый местной вазодилатацией периферических сосудов. Верапамил и дилтиазем иногда вызывают брадиаритмии, поэтому у больных, получающих терапию 0-блокаторами, их следует применять с осторожностью (или не применять вовсе).
В последние годы возник вопрос о безопасности блокаторов кальциевых каналов короткого действия. В ряде исследований была выявлена высокая частота развития инфаркта миокарда и смертности от- него у принимавших эти препараты больных с артериальной гипертензией или ишемической болезнью сердца. Для окончательного выяснения вопроса относительно такого риска необходимы данные рандомизированных контролируемых клинических испытаний. Тем не менее, рекомендуется отдавать предпочтение препаратам длительного действия (т. е. принимаемым один раз в день). Бальным, страдающим ИБС, в качестве начальной терапии предпочтение следует отдавать бета-блокаторам и/или нитратам, о чем говорилось в главе 6.
Таблица 17.7. Клинические эффекты блокаторов кальциевых каналов
Клиническое состояние Механизм
1. Стенокардия ф Потребность миокарда в кислороде
4- артериальное давление
Ф сократимость
Ф ЧСС (верапамил и дилтиазем)
Т Снабжение миокарда кислородом
Т дилатация коронарных артерий
Клиническое состояние |
Механизм |
2. Спазм коронарных артерий |
Дилатация коронарных артерий |
3. Артериальная гипертензия |
Релаксация гладких мышц артериол |
4. Наджелудочковые аритмии |
(Верапамил и дилтиазем): Снижение скорости проведения и увеличение рефрактерности АВ узла за счет блокады медленного входа Са++. |
Органические нитраты
Нитраты являются одними из старейших медикаментозных средств для лечения стенокардии; их применяют и при других ишемических состояниях, а также при сердечной недостаточности.
МЕХАНИЗМ ДЕЙСТВИЯ
Нитраты вызывают расслабление гладкой мускулатуры. Механизм их действия заключается в превращении лекарственного препарата в оксид азота (NO) на плазматической мембране гладкомышечных клеток или вблизи них (рис. 17.8). Оксид азота активирует гуанилатциклазу в результате чего образуется циклический ГМФ (цГМФ). Внутриклеточное накопление цГМФ сопровождается расслаблением гладкой мускулатуры сосудов. Такой механизм релаксации гладкой мускулатуры кровеносных сосудов аналогичен механизму действия нитропруссида и эндогенного эндотелиального оксида азота.
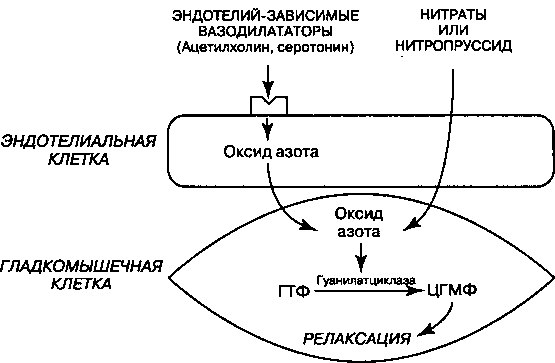
Рис. 17.8. Органические нитраты, превращаясь в оксид азота (NO) в мембране клеток или вблизи от нее, вызывают релаксацию гладкой мускулатуры (ГМ) сосудов. Нитропруссид и эндотелий-зависимые вазодилататоры тоже ускоряют высвобождение NO в гладкомышечные клетки кровеносных сосудов и вызывают их расслабление. В ГМ клетках NO стимулирует образование циклического ГМФ (цГМФ), который и опосредует релаксацию
ГЕМОДИНАМИЧЕСКИЕ И АНТИАНГИНАЛЬНЫЕ ЭФФЕКТЫ
Прототипом органических нитратов является нитроглицерин; в низких дозах его сосудорасширяющее действие направлено, в основном, на вены, а не на артериолы. В результате расширения вен в них задерживается кровь, снижается венозный возврат и, следовательно, уменьшается преднагрузка на правый и левый желудочки. Общее артериальное сопротивление обычно не меняется, а сердечный выброс может уменьшиться за счет сниженной преднагрузки, особенно у больных с внутрисосудистой гиповолемией (см. рис. 9.10). Артериальная дилатация в некоторой степени затрагивает коронарные сосуды, а также сосуды лица и менинги-альные артериолы, усиливая побочные эффекты, соответственно, в виде приливов и головной боли.
Применение нитратов в высоких дозах сопровождается усилением дилатации артериол и вен. Дилатация артериол может вызвать системную гипотензию и рефлекторную тахикардию. Однако у больных с сердечной недостаточностью рефлекторной активации симпатической нервной системы не происходит, поскольку снижение у них постнагрузки в действительности улучшает сердечный выброс и снижает активность симпатической нервной системы.
Наибольшее применение нитраты находят в лечении стенокардии. Основной терапевтический эффект нитратов при данной патологии состоит в вызываемом ими снижении преднагрузки на сердце вследствие венодилатации и уменьшения наполнения ЛЖ. Снижение преднагрузки сопровождается уменьшением давления на стенку желудочка и снижением потребности миокарда в кислороде, за счет чего уменьшается характерный для ишемии кислородный дисбаланс. Нитраты показаны и пациентам со спазмом коронарных артерий (стенокардия Принцметала), поскольку эти препараты индуцируют дилатацию коронарных артериол.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ И ФАРМАКОКИНЕТИКА
Нитраты представлены множеством лекарственных форм. Если целью лечения является купирование острого приступа стенокардии, важно достичь быстрого эффекта. В то же время, при длительной профилактике ангиналь-ных приступов у больных хронической ИБС продолжительность действия препарата и его ожидаемый эффект гораздо важнее скорости его достижения.
Нитроглицерин в форме сублингвальных таблеток или аэрозоля неоценим в купировании острых приступов стенокардии. Максимальный эффект этих препаратов развивается в течение 3-х минут, поскольку они быстро всасываются в кровь через слизистую оболочку полости рта. Вместе с тем, эффект быстро — в течение 15—30 минут — снижается по мере того, как препарат теряет свою активность, попадая в печень. Эти же лекарственные формы нитроглицерина эффективны и в качестве профилактического средства, принимаемого непосредственно перед ситуациями, которые, как уже знает больной, могут вызвать приступ стенокардии (например, ходьба в горку или подъем по лестнице).
Нитраты «пролонгированного действия» применяют для профилактики болей в грудной клетке при хроническом лечении стенокардии. Нитроглицерин, принимаемый внутрь в низких дозах, оказывается неэффективным из-за быстрой деградации; в этой связи для насыщения дезактивационной емкости печени в качестве профилактических следует назначать медикаментозные средства длительного действия и в достаточных дозах. В таких ситуациях обычно применяют нитроглицерин замедленного высвобождения, изосорбида динитрат или изосорбида мононитрат. Продолжительность действия этих препаратов колеблется от 2 до 14 часов. Трансдермальные пластыри или нитроглицериновая паста, наклеиваемые или наносимые на кожу, также обеспечивают постепенное высвобождение нитроглицерина. Однако эффективность нитратов длительного действия ослабляется за счет быстрого развития привыкания при их продолжительном применении. По этой причине крайне важно, чтобы в схеме лечения был предусмотрен ежедневный перерыв в приеме лекарства длительностью в несколько часов, что позволит сохранить его эффективность.
Внутривенные инъекции нитроглицерина и титрование дозы осуществляются при его непрерывном вливании. Этот способ введения используют для лечения стационарных больных с нестабильной стенокардией или острой сердечной недостаточностью.
ПОБОЧНЫЕ ЭФФЕКТЫ
Среди основных побочных эффектов нитратов следует назвать артериальную гипотензию, рефлекторную тахикардию, головную боль и приливы.
АНТИАДРЕНЕРГИЧЕСКИЕ ПРЕПАРАТЫ
Лекарственные средства, влияющие на симпатическую нервную систему, широко используются в лечении сердечно-сосудистых заболеваний. Эти препараты оказывают свое действие на многие участки центральной и вегетативной нервной систем. На рис. 17.9. изображены точки воздействия препаратов, включая центральную нервную систему (ЦНС), постганглионарные нервные окончания и периферические а- и р-рецепторы.
В нормальных физиологических условиях при стимуляции симпатической нервной системы в синаптическую щель высвобождается норадреналин (НА), который и стимулирует а- и p-рецепторы постсинаптической мембраны. Последствия такой рецепторной стимуляции зависят от иннервируемого органа (таблица 17.8). Результатом стимуляции а-рецепто-ров является спазм гладкой мускулатуры сосудов, тогда как стимуляция Р2-рецепторов вызывает вазодилатацию. При стимуляции центральных а2-рецепторов снижается тонус симпатической нервной системы, посылающей свои волокна к периферическим органам, за счет чего, отчасти, обеспечивается расслабление сосудов.
Помимо этого, в синапсе НА способен связываться с пресинаптиче-скими р- и а2-рецепторами, обеспечивая механизм обратной связи, регулирующей дальнейшее высвобождение гормона. Стимуляция р-рецепторов усиливает дальнейшее высвобождение НА, а стимуляция аг-рецепторов — подавляет.
Ингибиторы адренорецепторов центральной нервной системы
В пресинаптических нейронах ЦНС локализованы а2-рецепторы, стимуляция которых с помощью а2-агонистов сопровождается уменьшением адренергических импульсов, исходящих из продолговатого мозга. Следствием этого оказывается падение периферического сосудистого сопротивления и снижение сердечной стимуляции, сопровождающееся уменьшением
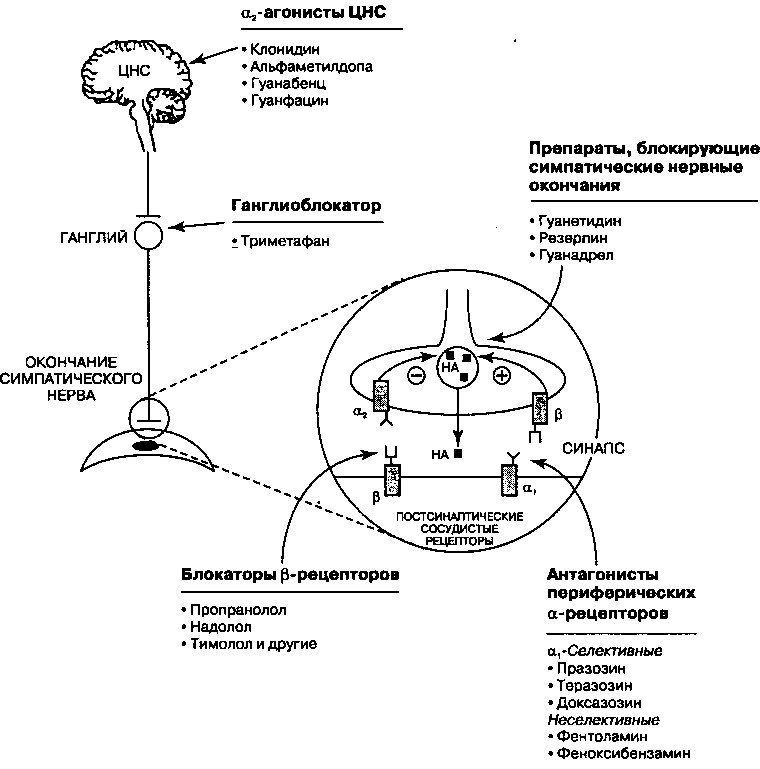
Рис. 17.9. Центры действия антиадренергических препаратов. Обратите внимание, что рецепторы, расположенные в окончаниях симпатических нервов, связывают норадреналин (НА) и обеспечивают обратную связь: 0-рецептор стимулирует, а а2-рецептор ингибирует дальнейшее высвобождение НА. ЦНС — центральная нервная система
артериального давления и урежением ЧСС. Таким образом, адреноблокаторы центрального действия в действительности являются центральными агонистами а2-рецепторов. Агонисты а2-рецепторов применяют в качестве препаратов второго ряда для лечения артериальной гипертензии. Они не обладают достаточной мощностью, чтобы использоваться в качестве сосудорасширяющих средств при лечении сердечной недостаточности.
Типичные представители агонистов а2-рецепторов приведены на рис. 17.9. Они все предназначены для приема внутрь, а клонидин иногда применяют в виде пластыря, который наклеивается на кожу и оставляется там на неделю, что облегчает больным соблюдение режима лечения. К побочным эффектам агонистов а2-рецепторов относят их седативное действие, сухость во рту, брадикардию и при резкой отмене препарата возможность внезапного парадоксального повышения артериального давления.
Средства, действующие на окончания симпатических нервных волокон
К этой группе препаратов относятся гуанетидин, резерпин и гуанадрел. Гуанетидин и гуанадрел активно транспортируются в постганглионарные нейроны посредством обратного захвата НА, а оказавшись там, связываются с мембраной везикул, препятствуя высвобождению НА при стимуляции симпатической нервной системы. Постепенно содержимое везикул истощается, и НА, попадая в цитоплазму, подвергается деградации.
Таблица 17.8. Эффекты, обусловленные стимуляцией адренорецепторов
Тип рецептора |
Локализация |
Эффект |
«1 |
Гладкая мускулатура сосудов (артериолы и вены) |
Вазоконстрикция |
а2 |
Окончания пресинаптических адренергических нервных волокон Гладкая мускулатура сосудов (коронарные и почечные артериолы) |
Торможение выброса НА Вазоконстрикция |
₽1 |
Сердце Почки (юкстагломерулярные клетки) Окончания пресинаптических адренергических нервных волокон Жировая ткань |
Повышение ЧСС Повышение сократимости Ускорение проведения АВ узла Повышение выброса ренина Повышение выброса НА Стимуляция липолиза |
На первых этапах лечения гуанетидин за счет снижения уровня НА вызывает падение АД и уменьшение сердечного выброса, урежая ЧСС и повышая венозное сопротивление. Компенсаторного подъема периферического сопротивления не происходит, поскольку препарат эффективно блокирует опосредуемое симпатической нервной системой рефлекторное сужение сосудов. В начале 70-х годов прошлого века гуанетидин широко применялся в качестве антигипертензивного средства, однако наличие у него побочных эффектов (в основном, ортостатической гипотензии), а также появление новых более совершенных медикаментозных препаратов перевели его в статус «редко используемого» соединения. Гуанадрел характеризуется меньшей продолжительностью действия и имеет меньше побочных эффектов.
Резерпин был первым лекарственным препаратом, снижающим активность симпатической нервной системы, а его применение дало толчок развитию общих представлений, используемых в настоящее время в лечении артериальной гипертонией. Резерпин связывается с мембранами везикул постганглионарных и центральных нейронов, в которых депонируется НА, в результате чего эти везикулы разрушаются, происходит высвобождение и деградация НА. Антигипертензивный эффект резерпина обусловлен снижением концентрации катехоламинов, за счет чего сила сердечных сокращений и общее периферическое сосудистое сопротивление снижаются.
Токсическое действие резерпина на ЦНС является основным препятствием для его применения в качестве антигипертензивного средства. Он часто оказывает седативное действие и может нарушить внимание. Наиболее серьезным следствием потенциальной токсичности резерпина является депрессия, поэтому больным, у которых в анамнезе отмечается депрессия, назначать этот препарат не следует. Новые, лучше переносимые антигипертензивные лекарственные средства сильно потеснили резерпин.
Антагонисты периферических а-рецепторов
Антагонисты периферических а-рецепторов (таблица 17.8.) подразделяются на те, которые влияют и на а]-, и на а2-рецепторы, и те, которые угнетают только а!-рецепторы. Селективные антагонисты а-рецепторов (празозин, теразозин, доксазозин) применяются для лечения артериальной гипертензии. Способность этих препаратов вызывать рефлекторную тахикардию в меньшей степени, чем неселективные антагонисты, объясняется их избирательным действием на а—рецепторам. В норме индуцируемая препаратом вазодилатация путем барарецепторного рефлекса приводит к стимуляции симпатической нервной системы и нежелательному повышению ЧСС. Этот эффект усиливается под действием препаратов, блокирующих пресинаптический а2-рецептор, поскольку предотвращается торможение выброса НА по механизму обратной связи. Однако, ац-селективные препараты не блокируют механизм отрицательной обратной связи через а2-рецептор. Таким образом, дальнейшее высвобождение НА и побочные эффекты, обусловленные рефлекторной активацией симпатической нервной системы, смягчаются.
Тип рецептора |
Локализация |
Эффект |
02 |
Гладкая мускулатура сосудов (артериолы, за исключением кожных и мозговых) Гладкая мускулатура бронхов Печень |
Вазодилатация Бронходилатация Стимуляция глюконеогенеза |
Основным показанием для назначения антагонистов а!-рецепторов является артериальная гипертензия. Одно из преимуществ препаратов этого класса заключается в том, что в отличие от других антигипертензивных средств (в том числе диуретиков и p-блокаторов), они не оказывают негативного влияния на концентрацию холестерина и триглицеридов в сыворотке крови. Предпринимались попытки использовать антагонисты cq-рецепторов для лечения сердечной недостаточности, однако оказалось, что их эффективность со временем снижается (вследствие привыкания к препарату). В отличие от других схем приема сосудорасширяющих средств (ингибиторы АПФ или гидралазин в комбинации с нитратами), антагонисты а!-рецепторов не снижают смертность среди больных хронической ЗСН. Теразозин и доксазозин показаны также для симптоматического лечения доброкачественной гиперплазии простаты, поскольку они снижают тонус гладких мышц простаты.
Фентоламин и феноксибензамин относятся к неселективным а-блокато-рам. Они применяются, в основном, для лечения феохромоцитомы — опухоли, которая аномально секретирует катехоламины в кровоток. В других ситуациях эти препараты используются редко, поскольку угнетение ^-рецепторов сопряжено с таким нежелательным эффектом, как нарушение торможения выброса НА по принципу обратной связи, о чем говорилось выше.
Таблица 17.9. Блокаторы альфа-рецепторов
Механизм действия/ Препарат |
Показания |
Основные побочные эффекты |
|
Селективные антагонисты периферических а^-рецепто-ров Празозин Теразозин Доксазозин |
|
|
|
Неселективные антагонисты а-рецепторов Фентоламин Феноксибензамин |
• Феохромоцитома |
|
Антагонисты p-адренорецепторов
Антагонисты 0-адренорецепторов применяют в терапии целого ряда сердечно-сосудистых заболеваний, включая ишемическую болезнь сердца, артериальную гипертензию и тахиаритмии.
Известно, что катехоламины повышают инотропию, хронотропию и скорость проведения импульса в миокарде; отсюда следует, что антагонисты 0-рецепторов должны снижать инотропную функцию сердца, урежать ЧСС и замедлять скорость проведения импульсов. При незначительной стимуляции 0-рецепторов, как это имеет место у здорового человека в покое, эффект антагонистов также невелик. В то же время, при активации симпатической нервной системы (например, во время физической нагрузки) антагонисты 0-рецепторов способны существенно уменьшить влияние катехоламинов.
0-блокаторы отличаются друг от друга по своим свойствам (таблица 17.10): 1) относительному сродству препарата к 0Г и 02-рецепторам; 2) наличию частичной активности в качестве агонистов', 3) способности блокировать а]-рецепторы и 4) фармакокинетическим характеристикам. Цель применения 0j-селективных препаратов заключается в блокаде рецепторов миокарда без существенного угнетения гладкой мускулатуры кровеносных сосудов и бронхов (эти ткани содержат 02-рецепторы), чтобы не вызвать у предрасположенных больных бронхоспазм и вазоконстрикцию.
При кратковременном применении неселекгивных антагонистов 0-ре-цепторов отмечается тенденция к уменьшению сердечного выброса, что связывают с урежением ЧСС и снижением сократимости миокарда; кроме того, они слегка повышают периферическое сосудистое сопротивление, что обусловлено блокадой 02-рецепторов. Антагонисты 0-рецепторов с внутренней симпатомиметической активностью (пиндолол), или способные блокировать а-рецепторы (лабетолол), могут на самом деле уменьшить периферическое сопротивление за счет взаимодействия с 02- и а-рецепторами, соответственно.
Таблица 17.10. Блокаторы 0-адренорецепторов
Неселективные р-блокаторы |
Pj-селективные Р-блокаторы |
|
Отсутствие активности р-агониста |
Пропранолол |
Атенолол |
Надолол |
Бетаксолол |
|
Тимолол |
Эсмолол# |
|
Лабеталол* |
Метопролол |
|
Наличие активности р-агониста |
Картеолол Пенбутолол Пиндолол |
Ацебутолол |
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
Ишемическая болезнь сердца
Положительный эффект p-блокаторов при лечении стенокардии обусловлен их способностью уменьшать потребность миокарда в кислороде (см. главу 6): они снижают ЧСС, артериальное давление (постнагрузку) и сократимость миокарда. Негативный инотропный эффект этих препаратов непосредственно связан с блокадой p-рецепторов сердца (рис. 17.4), в результате чего снижается вход кальция в кардиомиоциты. Кроме того, было показано, что p-блокаторы улучшают показатели выживаемости после острого ИМ и снижают число повторных инфарктов. Точные механизмы, лежащие в основе снижения смертности, остаются неизвестными, частично оно может быть обусловлено антиаритмической активностью Р-блокаторов (см. ниже).
Артериальная гипертензия
У больных артериальной гипертензией p-блокаторы снижают артериальное давление, но у нормотоников этот эффект часто отсутствует. Фактически, несмотря на широкое применение этих препаратов в качестве антигипертензивных средств, механизмы, обеспечивающие этот эффект, окончательно не выяснены. Полагают, что на первых этапах лечения в основе антигипертензивного действия p-блокаторов лежит их способность снижать сердечный выброс в связи с урежением ЧСС и незначительным уменьшением сократимости миокарда. Однако при длительном применении препарата включаются, по-видимому, другие механизмы, в том числе снижение секреции ренина и, возможно, влияние на ЦНС.
Среди других патологических состояний, когда показано лечение Р-блокаторами, следует назвать тахиаритмии (см. ниже) и гипертрофическую кардиомиопатию (см. главу 10).
ТОКСИЧНОСТЬ
В ходе лечения p-блокаторами иногда появляется утомляемость, как наиболее вероятный побочный эффект препарата на ЦНС. p-блокаторы с низкой жирорастворимостью (например, надолол) не проникают через гемато-энцефалический барьер и оказывают на ЦНС значительно меньшее действие, чем более липофильные препараты, например пропранолол. Другие побочные эффекты связаны с вполне предсказуемым последствиями угнетения р-рецепторов:
1. Блокада р2-рецепторов неселективными антагонистами (или большими дозами pt-селективных блокаторов) усиливает бронхоспазм, усугубляя течение имеющейся у больного астмы или хронических обструктивных заболеваний легких.
2. Нарушение проведения в АВ узле, связанное с блокадой р,-рецепторов, может привести к АВ-блокаде.
3. Обусловленные блокадой ргрецепторов отрицательные инотропный и хронотропный эффекты у больных с дисфункцией ЛЖ иногда приводят к усугублению симптомов .сердечной недостаточности^.
4. Блокада р2-рецепторов вызывает артериальный вазоспазм. Это может привести к развитию синдрома Рейно или усугубить заболевания периферических сосудов, в результате чего появляется перемежающаяся хромота или развивается гангрена (см. главу 15).
5. Резкая отмена антагонистов p-блокаторов после их длительного применения у больных ИБС теоретически может спровоцировать стенокардию или инфаркт миокарда («рикошетная ишемия»); это обусловлено увеличением числа p-рецепторов во время адренергической блокады, за счет чего после отмены препарата сердце становится более восприимчивым к действию катехоламинов. Нежелательное снижение уровня холестерина ЛВП и повышение триглицеридов посредством неизвестного механизма. Этот эффект, по-видимому, менее выражен у препаратов, обладающих, частичной активностью р-агонистов или проявляющих свойства и р-, и а-блокаторов (см. таблицу 17.10).
6. Нежелательное снижение уровня холестерина ЛВП и повышение триглицеридов посредством неизвестного механизма. Этот эффект, по-видимому, менее выражен у препаратов с внутренней симпатомиметической активностью или проявляющих свойства и р-, и а-блокаторов (см. таблицу 17.10).
7. p-блокаторы способны усугубить гипогликемию под действием инсулина у больных сахарным диабетом. Кроме того, p-блокаторы маскируют такие предвестники гипогликемии со стороны симпатической нервной системы, как тахикардия. При назначении p-блокаторов больным сахарным диабетом предпочтение следует отдавать селективным блокаторам Ргрецепторов.
И последнее, антагонисты p-рецепторов в сочетании с верапамилом (или дилтиаземом) следует применять с осторожностью, поскольку каждый из этих препаратов способен ухудшать сократимость миокарда и проведение импульса в АВ узле и, тем самым, приводить к развитию сердечной недостаточности или АВ блокаде.
АНТИАРИТМИЧЕСКИЕ ПРЕПАРАТЫ
Медикаментозная терапия считается общепринятым подходом к лечению сердечных тахиаритмий. В то же время, несмотря на положительное действие антиаритмических средств, из-за часто возникающих серьезных побочных эффектов они относятся к наиболее опасным фармакологическим препаратам. В этой связи особую важность приобретает необходимость четкого понимания механизмов их действия, показаний и токсических эффектов.
Существует несколько систем классификации антиаритмических препаратов, но чаще всего их разделяют на четыре группы в зависимости от основного механизма действия (таблица 17.11):
1. Препараты Iкласса блокируют быстрые натриевые каналы, ответственные за фазу 0 деполяризации потенциала действия. Далее, исходя из степени блокирования натриевых каналов и влияния на продолжительность рефрактерного периода клетки, эти препараты подразделяются на три подтипа.
2. К препаратам II класса относятся блокаторы p-адренергических рецепторов.
3. Препараты III класса представлены соединениями, которые значительно удлиняют потенциал действия, оказывая незначительный эффект на увеличение фазы 0 деполяризации. Механизм действия некоторых из препаратов этого класса заключается, по-видимому, в блокаде реполяризующего калиевого тока К+ (во время 2 и 3 фаз потенциала действия).
4. Препараты IVкласса блокируют медленные кальциевые каналы L-типа.
Аденозин и сердечные гликозиды являются препаратами, не вписывающимися в эту классификацию.
Терапия антиаритмическими препаратами (о которой пойдет речь в данном разделе), независимо от их принадлежности к тому или иному классу, направлена на блокаду механизмов развития тахиаритмий. Это следующие механизмы (согласно главе 11): 1) повышение автоматизма пейсмекерных и непейсмекерных клеток; 2) повторный вход волны возбуждения и 3) триггерная активность.
Целью лечения аритмий, обусловленных повышенным автоматизмом, является: 1) снижение наклона спонтанной фазы 4 диастолической деполяризации и/или 2) увеличение пороговой величины потенциала. Этим достигается снижение или гашение избыточного возбуждения клеток.
Механизмы действия антиаритмических препаратов на аритмии, возникающие по механизму re-entry (повторный вход волны возбуждения), различны. Вспомним, что re-entry ток инициируется в участке однонаправленной блокады и замедленного ретроградного проведения (рис. 17.10). Для поддержания re-entry период времени, необходимый для кругового движения импульса к точке его возникновения, должен превышать эффективный рефрактерный период ткани. Если импульс возвращается в тот уча-
Рис. 17.10. Два способа прерывания механизма re-entry: (А) удлинение рефрактерного периода, когда ткань не способна возбудиться под действием возвратившегося импульса, и (Б) дальнейшее ослабление проведения, когда импульс «затухает» при медленном ретроградном проведении
сток миокарда, который только что был деполяризован, но его возбудимость еще не восстановилась, он не сможет вновь стимулировать миокард. Таким образом, одним из подходов к прекращению аритмий по типу re-entry является увеличение рефрактерного периода ткани-. Когда рефрактерный период удлиняется под действием препарата, на пути распространяющегося импульса оказываются неактивные натриевые каналы, дальнейшее распространение импульса становится невозможным, и он угасает.
Вторым способом прерывания циркуляции возбуждения является дальнейшее ухудшение проведения импульса в ретроградном направлении. Этого удается достичь при фармакологической блокаде Ма+-каналов, ответственных за фазу 0 деполяризации. Такая блокада полностью останавливает ретроградное проведение аномального импульса и прерывает его самоподдерживающееся круговое движение.
Для устранения третьей причины тахиаритмий, триггерной активности, необходимо подавить ранние и поздние постдеполяризации (см. главу 11).
В идеале лекарственный препарат должен подавлять эктопические водители ритма и прерывать вхождение повторных импульсов, но не затрагивать нормальные проводящие пути. К сожалению, если концентрация антиаритмического препарата превышает довольно узкий терапевтический диапазон, угнетается даже нормальная электрическая активность. Кроме того, большинство антиаритмических препаратов потенциально способны усугублять нарушения ритма (так называемый «проаритмиче-ский эффект»). Например, он развивается, когда антиаритмический препарат удлиняет потенциал действия и индуцирует ранние постдеполяризации, что приводит к развитию аритмии по триггерному механизму (см. главу 11). Проаритмическое действие препарата может приводить к развитию желудочковой тахикардии или фибрилляции желудочков, что особенно часто встречается у больных со сниженной функцией левого желудочка или с удлинением интервала QT на ЭКГ (признак, свидетельствующий об удлинении потенциала действия).
Таблица 17,11, Классификация антиаритмических препаратов
Антиаритмические препараты IA класса
МЕХАНИЗМ ДЕЙСТВИЯ
Влияние на аритмии, вызванные повышенным автоматизмом
Препараты класса IA осуществляют умеренную блокаду быстрых натриевых каналов. В результате уменьшения числа каналов, через которые натрий входит внутрь клетки, пороговая величина потенциала возрастает и снижается скорость развития потенциала действия (фаза 0). Кроме того, снижается наклон 4 фазы деполяризации, что, возможно, связано с блокадой пейсмекерных каналов (рис. 17.11); при этом для достижения пороговой величины и инициации потенциала действия требуется больше времени. Эти эффекты в наибольшей мере выражены в волокнах Пуркинье и аномальных эктопических водителях ритма. Поскольку препараты класса IA на автоматизм синусового узла влияют слабо, после подавления эктопических водителей ритма он способен возобновить свою функцию в качестве основного водителя ритма сердца.
Класс |
Основной механизм действия |
Отдельные представители |
I |
Блокаторы Ма+-каналов |
|
IA |
Умеренная блокада: 44 скорости развития потенциала действия (фаза 0) Пролонгация реполяризации |
Хинидин Прокаинамид Дизопирамид |
IB |
Слабая блокада: скорости развития потен циала действия (фаза 0) Укорочение реполяризации |
Лидокаин Токаинид Мексилетин Фенитоин (ДФД) |
IC |
Выраженная блокада: ффф скорости развития потенциала действия (фаза 0) Реполяризация не изменяется |
Флекаинид Пропафенон |
II |
|3-блокаторы |
Пропранолол Эсмолол Метопролол и др. |
III |
Выраженное удлинение фазы реполяризации |
Амиодарон Соталол Бретилий Ибутилид |
IV |
Блокаторы Са++-каналов |
Верапамил Дилтиазем |
Рис. 17.11. Электрофизиологические эффекты антиаритмических препаратов 1 класса (А) на потенциал действия клеток Пуркинье и (Б) на потенциал действия клеток-водителей ритма
Влияние на аритмии, обусловленные механизмом re-entry
Поскольку блокада натриевых каналов сопровождается замедлением скорости деполяризации в фазу 0 за счет снижения величины входящего тока, одновременно снижается скорость проведения импульса в клетках и тканях. Если циркулирующий импульс подавлен в достаточной мере, он угасает при ретроградном проведении, и аномальный ритм прерывается. Кроме того, удлинение потенциала действия, вызываемое антиарит-мическими препаратами этого класса, а также их относительно медленная диссоциация от На+-каналов после реполяризации удлиняют рефрактерный период клетки (рис. 17.11), так что циркулирующий импульс попадает в неспособную возбудиться ткань и угасает.
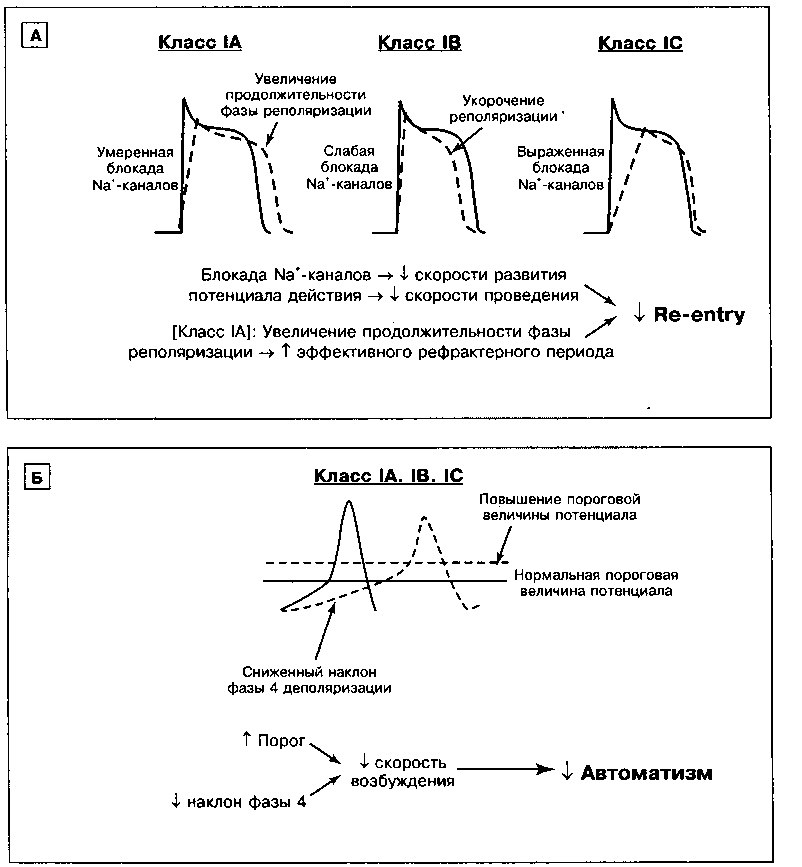
Изменения на электрокардиограмме
Антиаритмические препараты класса IA незначительно увеличивают ширину комплекса QRS и удлиняют интервал QT (таблица 17.12), что обусловлено замедлением проведения, а также удлинением потенциала действия и реполяризации. При более высоких дозах препарата эти интервалы увеличиваются существенно, что указывает на возможность постдеполяризации и аритмогенного действия препаратов.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
Антиаритмические препараты класса IA применяют для лечения широкого спектра обусловленных механизмом re-entry и эктопических наджелудочковых и желудочковых тахикардий (таблица 17.13). Чаще всего их используют для купирования трепетания или мерцания предсердий, а также для длительного лечения наджелудочковых re-entry тахикардий, желудочковых экстрасистол и желудочковой тахикардии
•
Таблица 17.12. Влияние антиаритмических препаратов на показатели электрокардиограммы
Класс |
PR |
QRS |
QT |
IA |
0 |
т |
т |
IB |
0 |
0 |
0 или 4- |
IC |
t |
т |
0 или Т |
II |
0 или T |
0 |
0 или 1 |
III |
0 или Т |
7 |
7 |
IV |
7 |
0 |
0 |
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ АНТИАРИТМИЧЕСКИХ
ПРЕПАРАТОВ IA КЛАССА
Хинидин — наиболее часто назначаемое для приема внутрь антиарит-мическое средство. Помимо электрофизиологических эффектов, присущих всем антиаритмическим препаратам IA класса, он проявляет также антихолинергическую активность, за счет чего усиливает проводимость в ■ АВ узле, выступая, таким образом, в роли антагониста своего прямого блокирующего эффекта. Хинидин способен блокировать а-адренорецеп-торы, что может стать причиной артериальной гипотензии, особенно при парентеральном введении препарата. В связи с этим хинидин обычно назначается только для приема внутрь. Хинидин метаболизируется в основном в печени, поэтому больным с заболеваниями печени его следует назначать в более низких дозах.
Таблица 17.13. Клиническое применение антиаритмических препаратов
Класс Применение
IA • Мерцание и трепетание предсердий
• Пароксизмальная НЖТ
• Желудочковая тахикардия
IB • Желудочковая тахикардия
• Аритмии, индуцируемые дигиталисом
IC • Желудочковая тахикардия
• (Иногда): мерцание предсердий, парксизмальная НЖТ
II • Предсердная или желудочковая экстрасистолия
• Пароксизмальная НЖТ
• Мерцание и трепетание предсердий
• Желудочковая тахикардия (обусловленная ишемией)
III • Желудочковая тахикардия
'(Амиодарон и соталол, но не бретилий)'.
• Мерцание и трепетание предсердий
• ПНЖТ, обусловленная дополнительным путем проведения
IV • ПНЖТ
• Мерцание и трепетание предсердий (Ф ЧСС)
• Мультифокальная предсердная тахикардиия (Ф ЧСС)
ПНЖТ — пароксизмальная наджелудочковая тахикардия; ЧСС — частота сердечных сокращений
Терапия хинидином часто сопровождается побочными эффектами как со стороны сердца, так и других органов. Чаще всего это нарушения со стороны желудочно-кишечного тракта, в том числе диарея, отмечаемая у трети больных. Побочные эффекты со стороны сердечно-сосудистой системы весьма серьезны и потенциально смертельны. Например, избыточное удлинение интервала QT (обычно > 0,5 с) ассоциируется с опасной для жизни формой желудочковой тахикардии, известной как аритмия типа torsade de pointes («пируэтная» желудочковая тахикардия), описанной в главе 12.
Хинидин повышает уровень дигоксина в крови, уменьшая его клиренс и объем распределения; в этой ситуации могут возникнуть аритмии, обусловленные приемом сердечных гликозидов. Начиная терапию хинидином, дозу дигоксина необходимо снизить вдвое.
Наконец, благодаря своей антихолинергической активности, хинидин действительно способен повышать проводимость в АВ узле, что является противодействием его прямому эффекту на возбудимость тканей. Это может приводить к учашению сокращений желудочков у больных с мерцанием или трепетанием предсердий. Этого можно избежать с помощью комбинации хинидина с препаратом, оказывающим отрицательный инотропный эффект, например с сердечным гликозидом, p-блокатором, верапамилом или дилтиаземом.
Электрофизиологические эффекты прокаинамида аналогичны таковым хинидина. Оба препарата подавляют фазу 0 деполяризации в предсердиях и желудочках, снижают проводимость, удлиняют потенциал действия и рефрактерный период. В то же время, между ними имеется и ряд существенных различий. Во-первых, прокаинамид не так сильно удлиняет потенциал действия (и интервал QT), как хинидин, хотя он может индуцировать развитие такой формы лекарственной аритмии, как torsade de pointes. Во-вторых, у прокаинамида антихолинергический эффект проявляется в меньшей степени, чем у хинидина, поэтому ускорение проводимости в АВ узле менее выражено. Кроме того, прокаинамид не обладает свойствами а-блокатора, но способен оказывать слабое ганглиоблокирующее действие, которое может вызывать дилатацию периферических сосудов и отрицательный инотропный эффект на сердце, особенно при внутривенном введении препарата. Тем не менее, если необходимо внутривенное введение препарата, применяют именно прокаинамид, поскольку при таком способе введения он реже вызывает гипотензию, чем хинидин.
Прокаинамид назначают для приема внутрь, а также внутримышечно и внутривенно. Более 50 % прокаинамида выводится с мочой; оставшийся препарат подвергается ацетилированию в печени с образованием N-ацетилпрокаинамида (NAHA), который затем выводится через почки. У больных с почечной недостаточностью или у лиц, для которых характерно быстрое ацетилирование, НАПА может накапливаться. НАПА сохраняет свойство прокаимнамида пролонгировать потенциал действия и рефрактерный период, но он не изменяет ни скорость фазы 4 деполяризации, ни наклон потенциала действия.
Ранние кардиальные побочные эффекты прокаинамида аналогичны таковым хинидина: у больных с мерцанием или трепетанием предсердией может наблюдаться парадоксальное увеличение частоты сокращения желудочков, что обусловлено антихолинергической активностью препарата. Проаритмические эффекты, в том числе, развитие аритмий типа torsade de pointes, являются дозозависимыми.
Довольно типичны и экстракардиальные побочные эффекты. Нарушения со стороны ЖКТ встречаются реже, чем при терапии хинидином, но довольно часты лихорадка и сыпь. Примерно у трети пациентов через полгода применения препарата развивается волчаночноподобный синдром, проявляющийся арталгиями, высыпаниями на коже и воспалением соединительной ткани. Чаще этот синдром развивается у лиц с низкой скоростью ацетилирования лекарства и исчезает при отмене препарата.
Дизопирамид по своим электрофизиологическим и антиаритмическим свойствам сходен с хинидином. Вместе с тем существует четыре основных пункта, по которым эти препараты между собой различаются:
1. Терапия дизопирамидом сопровождается гораздо более редкими побочными эффектами со стороны ЖКТ.
2. Дизопирамид не повышает в крови уровень дигоксина.
3. Дизопирамид обладает намного более мощным антихолинергическим действием, поэтому к его типичным побочным эффектам относятся запоры, задержка мочи (тонус сфинктера мочевого пузыря зависит от концентрации ацетилхолина) и обострение глаукомы (антихолинерги-ческий эффект — повышение внутриглазного давления).
4. Дизопирамид в большей степени, чем хинидин или прокаинамид, оказывает отрицательный инотропный эффект, поэтому его следует применять с осторожностью у больных с нарушениями сократительной функции левого желудочка.
Дизопирамид назначают для приема внутрь. Основной путь выведения — почки, у больных с почечной недостаточностью препарат может накапливаться до токсических концентраций.
К наиболее существенным побочным эффектам дизопирамида следует отнести развитие застойной сердечной недостаточности и перечисленные выше эффекты, обусловленные его антихолинергической активностью. Кроме того, в силу его отрицательного инотропного эффекта дизопирамид следует назначать с осторожностью или не назначать вовсе в комбинации с лекарственными препаратами, которые уменьшают сократимость желудочков, например, с p-блокаторами или верапамилом. Среди других побочных эффектов необходимо отметить удлинение интервала QT и развитие желудочковых аритмий (в том числе, torsade de pointes), характерное для других антиаритмических препаратов класса IA.
Антиаритмические препараты IB класса
Лекарственные препараты IB класса блокируют быстрые натриевые каналы и обычно сокращают длительность потенциала действия и рефрактерного периода. Укорочение потенциала действия объясняют блокадой мальгх натриевых токов, которые в нормальных условиях продолжаются в течение фазы 2 потенциала действия.
Антиаритмические препараты IB класса в терапевтических концентрациях не вызывают существенных изменений электрической активности ткани; скорее их преимущественным местом действия оказываются поврежденные или ишемизированные клетки. Такие характерные для ишемии нарушения, как ацидоз, ускоренная стимуляция клеток, повышенная концентрация внеклеточного калия и менее отрицательный мембранный потенциал во время диастолы, увеличивают способность препаратов IB класса блокировать натриевые каналы. Эти препараты приводят к блокаде проводимости в ишемизированной клетке за счет уменьшения наклона фазы 0 деполяризации и замедления скорости проведения, подавляя, тем самым, определенные виды аритмий типа re-entry (рис. 17.11). Подобно другим лекарственным препаратам класса I, они снижают автоматизм эктопических водителей ритма за счет уменьшения наклона фазы 4 спонтанной деполяризации и (отдельные представители IB класса) повышения пороговой величины потенциала. Кроме того, внутривенное вливание лидокаина оказывает благоприятное действие за счет подавления поздних постдеполяризаций.
В терапевтических концентрациях препараты IB класса на ткань предсердий оказывают слабый эффект, что связано со слишком коротким потенциалом действия предсердий (особенно при тахикардии) и, соответственно, с более коротким временем, в течение которого лекарство оказывается связанным с Ка+-каналом и блокирует его. Таким образом, препараты IB класса оказываются неэффективными при мерцании и трепетании предсердий и наджелудочковых тахикардиях. Чаще всего их используют для подавления желудочковых аритмий, особенно при наличии ишемии или передозировке дигиталиса.
Поскольку препараты этой группы не удлиняют интервал QT, ранние постдеполяризации не наступают, поэтому вряд ли можно ожидать такого осложнения, как torsade de pointes.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ АНТИАРИТМИЧЕСКИХ
ПРЕПАРАТОВ IB КЛАССА
Лидокаин представляет собой антиаритмический препарат, чаще всего используемый для экстренного купирования желудочковых аритмий у больных, находящихся в стационаре. Его применяют только внутривенно, поскольку при пероральном применении концентрация препарата в плазме крови непредсказуема. Из-за высокой скорости распределения и метаболизма в печени лидокаин следует использовать в виде непрерывных вливаний из 2—3 болюсов. Время полувыведения препарата зависит в основном от скорости печеночного кровотока: при сниженном кровотоке (при сердечной недостаточности или у пожилых больных) или заболеваниях печени концентрация лидокаина в сыворотке крови резко повышается и может достичь токсического уровня. У таких больных скорость вливания должна быть снижена.
Типичные побочные эффекты лидокаина не затрагивают сердечно-сосудистую систему; они, в основном связаны с действием на центральную нервную систему и включают в себя спутанность сознания, головокружение и эпилептические припадки. Эти эффекты зависят от дозы препарата, во избежания побочного действия у больных с заболеваниями печени или сниженным печеночным кровотоком необходимо определять концентрацию лидокаина в сыворотке крови или снижать скорость его введения.
Токаинвд является аналогом лидокаина; структура этого препарата препятствует его метаболизму при первом прохождении через печень, поэтому его можно применять перорально. Электрофизиологические эффекты этого препарата аналогичны таковым для лидокаина. Токсические эффекты довольно типичны, к ним относятся влияние на ЦНС (головокружение, тремор, нарушение чувствительности) и ЖКТ (тошнота, диарея). Возможность возникновения серьезных осложнений со стороны крови, в том числе, лейкопении, ограничивает применение этого препарата. Приблизительно половина принятого токаинида выводится в неизменном виде с мочой, поэтому у больных с нарушением функции почек необходимо снизить дозу препарата.
Мексилетин близок к лидокаину по своей структуре и электрофизиологическим свойствам. В отличие от лидокаина, но аналогично токаини-ду, его применяют перорально. 90% мексилетина метаболизируется в печени до неактивных соединений; дозу препарата у больных с заболеваниями печени следует уменьшать.
Дозозависимые побочные эффекты мексилетина довольно типичны, особенно его влияние на ЦНС (головокружение, тремор, неразборчивая речь) и на ЖКТ (тошнота, рвота). Присущее токаиниду токсическое действие на гематологические показатели у мексилетина отсутствует.
Дифенилгидантоин (дифенин) — это противосудорожный препарат, который иногда применяют как антиаритмическое средство. Его применение ограничивается, в основном, лечением аритмий, вызванных отравлением дигиталисом, поскольку он тормозит триггерный автоматизм (индуцируемые дигиталисом поздние постдеполяризации), не усугубляя вызванную дигиталисом блокаду АВ узла.
Дифенин применяют как внутривенно, так и перорально. Метаболизируется он, в основном, в печени. Деградация дифенина у больных с заболеваниями печени замедлена, на его метаболизм влияют препараты, конкурирующие с ним за связывание с печеночными ферментами, например, фенотиазины и изониазиды. Серьезные побочные эффекты дифенина касаются ЦНС (атаксия, сонливость, нистагм) и ЖКТ (тошнота, анорексия); длительное применение препарата может привести к гиперплазии десен и лимфатических узлов.
Антиаритмические препараты IC класса
Антиаритмические препараты IC класса являются наиболее мощными блокаторами натриевых каналов. Они существенно снижают скорость развития потенциала действия и проведения в предсердиях, желудочках и волокнах Пуркинье (рис. 17.11). Несмотря на то, что их влияние на длительность потенциала действия, реполяризацию или рефрактерный период в волокнах Пуркинье незначительно, рефрактерные периоды АВ узла и дополнительных путей заметно увеличиваются.
Препараты IC класса относятся к наиболее сильнодействующим лекарственным средствам, назначаемым для лечения желудочковых аритмий. В то же время, их применение вызывает ряд вопросов, поскольку эти препараты обладают выраженными проаритмическими свойствами. В ряде исследований было показано увеличение смертности среди больных, принимавших те или иные препараты этого класса (флекаинид, энкаинид, которые уже изъяты из продажи, или морицизин) при бессимптомной желудочковой экстрасистолии после инфаркта миокарда. Более того, при длительном применении препарата IC класса пропафенона возросла смертность среди пациентов, перенесших внезапную остановку сердца. Таким образом, антиаритмические препараты этого подкласса применяются для эпизодического лечения желудочковых аритмий у больных, страдающих другими сердечно-сосудистыми заболеваниями, в том числе ишемической болезнью сердца или сердечной недостаточностью. Недавно было показано, что препараты IC класса эффективны (и вполне безопасны) в профилактике наджелудочковых аритмий у пациентов, не имеющих других заболеваний сердца.
Помимо электрофизиологического действия, флекаинид оказывает отрицательный инотропный эффект, что у пациентов со сниженной функцией левого желудочка может привести к развитию застойной сердечной недостаточности. В связи с этим его применение в настоящее время ограничено лечением опасных для жизни желудочковых аритмий и некоторых наджелудочковых аритмий (таблица 17.13) у больных без каких-либо структурных изменений сердца. Флекаинид хорошо всасывается при приеме внутрь. Около 40% препарата выводится с мочой в неизменном виде, остаток превращается в печени в неактивные метаболиты. Как упоминалось выше, побочные эффекты со стороны сердца включают усугубление желудочковых аритмий и развитие застойной сердечной недостаточности у больных с дисфункцией левого желудочка. Среди других побочных эффектов отмечают влияние препаратов этого класса на центральную нервную систему, которое проявляется в виде спутанности сознания, головокружения, «пелены перед глазами».
Пропафенон по своим электрофизиологическим свойствам сходен с флекаинидом, но наряду с этим он оказывает и слабое р-адреноблокиру-ющее действие. Метаболизируется он в печени, однако, в силу большой генетической вариабельности индивидуальные дозы следует подбирать при тщательном титровании и контроле за эффектом препарата. До сих пор остается неясным, обладает ли пропафенон проаритмическими свойствами, характерными для других представителей класса IC. Внесердечные побочные эффекты встречаются редко и включают в себя головокружение и нарушения вкусового восприятия.
Морицизину присущи свойства как препаратов класса IB, так и IC. Связанные с ЦНС побочные эффекты проявляются в виде головокружения и возбуждения.
Антиаритмические препараты II класса
Антиаритмические препараты II класса — это антагонисты 0-адрено-рецепторов, которые и применяются для лечения как наджелудочковых, так и желудочковых аритмий (таблица 17.13). Большинство антиаритмических свойств препаратов этого класса обусловлено угнетением активности симпатической нервной системы в сердце. Способность некоторых 0-блокаторов оказывать 0!-селективное или «мембрано-стабилизирующее действие», по-видимому, не влияет на их антиаритмические эффекты.
В Главе 11 описано, каким образом стимуляция 0-адренорецепторов вызывает повышение скорости проведения возбуждения в синусовом узле. Антагонисты 0-адренорецепторов подавляют эти эффекты, уменьшая, тем самым, автоматизм (рис. 17.12). Это их действие распространяется на волокна Пуркинье в миокарде, где они прерывают аритмии, вызванные повышенным автоматизмом. Кроме того, поскольку увеличенное содержание катехоламинов может вызвать постдеполяризации, 0-бло-каторы способны предотвращать триггерные аритмии, индуцируемые согласно этому механизму. Все 0-блокаторы удлиняют эффективный рефрактерный период АВ узла, поэтому эти препараты эффективно прерывают проходящие через него ритмы, связанные с механизмом re-entry. Помимо этого, положительный антиаритмический эффект 0-блокаторов состоит в снижении потребности миокарда в кислороде и уменьшении ишемии миокарда. Было показано, что некоторые представители этого класса препаратов снижают смертность от инфаркта миокарда (см. главу 11), что отчасти связано с их антиаритмическими свойствами.
Увеличивая время проведения в АВ узле, 0-блокаторы вызывают удлинение интервала PR на ЭКГ (таблица 17.12). Интервалы QRS и QT обычно не изменяются.
Рис. 17.12. Электрофизиологический эффект антиаритмических препаратов класса 11 на потенциал действия клеток-водителей ритма
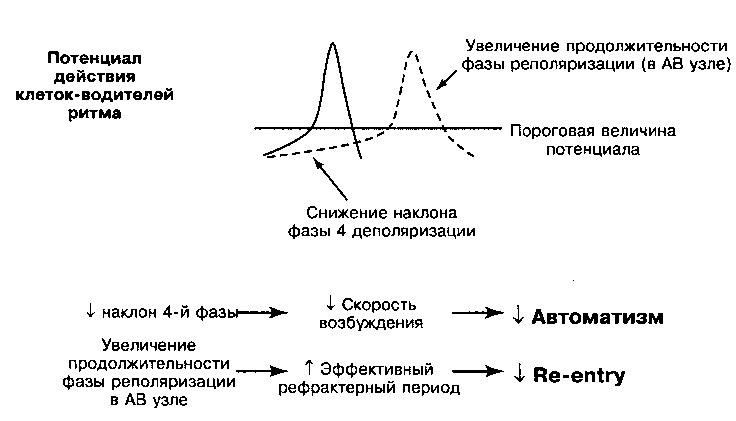
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
Наиболее эффективны p-блокаторы в подавлении тахиаритмий, индуцируемых избытком в крови катехоламинов (например, при физических нагрузках, эмоциональном возбуждении). Их часто используют и для снижения ЧСС при трепетании и мерцании предсердий, что достигается за счет уменьшения проведения и увеличения рефрактерности АВ узла. Кроме того, p-блокаторы способны прерывать наджелудочковые аритмии типа re-entry (в том числе ПНЖТ), при которых АВ узел составляет одну из ветвей пути re-entry.
Р-блокаторы эффектавно подавляют желудочковые экстрасистолы и другие желудочковые аритмии, особенно вызванные физической нагрузкой; благодаря способности p-блокаторов уменьшать ишемию, их с успехом применяют в терапии ишемической болезни сердца. Они также хороши в лечении желудочковых аритмий при наличии удлиненного интервала QT, поскольку в отличие от препаратов класса IA, они не удлиняют QT.
Побочные эффекты p-блокаторов описаны в настоящей главе выше.
Антиаритмические препараты III класса
Антиаритмические препараты III класса различаются друг от друга по своей структуре, но обладают одинаковым свойством значительно удлинять потенциал действия и рефрактерность волокон Пуркинье и мышечных волокон желудочков сердца (рис. 17.13). В отличие от препаратов I класса, они слабо влияют на фазу 0 деполяризации и скорость проведения импульса.
Амиодарон является мощным антиаритмическим препаратом со множеством побочных эффектов. Его основное терапевтическое действие заключается в увеличении продолжительности потенциала действия и рефрактерного периода всех волокон миокарда. Вместе с тем он обладает свойствами присущими представителям других классов антиаритмических препаратов: блокируя натриевые каналы, он снижает наклон фазы О деполяризации (эффект препаратов I класса), он обладает свойствами p-блокатора (класс И), а также оказывает слабое блокирующее действие на кальциевые каналы (класс IV). В результате амиодарон влияет на электрофизиологические свойства клеток, снижая скорость возбуждения в синусовом узле, подавляя автоматизм, прерывая токи типа re-entry и увеличивая интервалы PR, QRS и QT ЭКГ (таблица 17.12).
Помимо этого, амиодарон оказывает сосудорасширяющее действие (благодаря способности блокировать а-рецепторы и кальциевые каналы). При этом вазодилатирующее действие препарата выражено в большей степени, чем его отрицательный инотропный эффект, поэтому у больных, принимающих амиодарон, сердечный выброс обычно не изменяется.
Применение амиодарона несколько ограничено его побочными реакциями и слишком большим периодом полувыведения, тем не менее, он намного более эффективен по сравнению с другими антиаритмическими
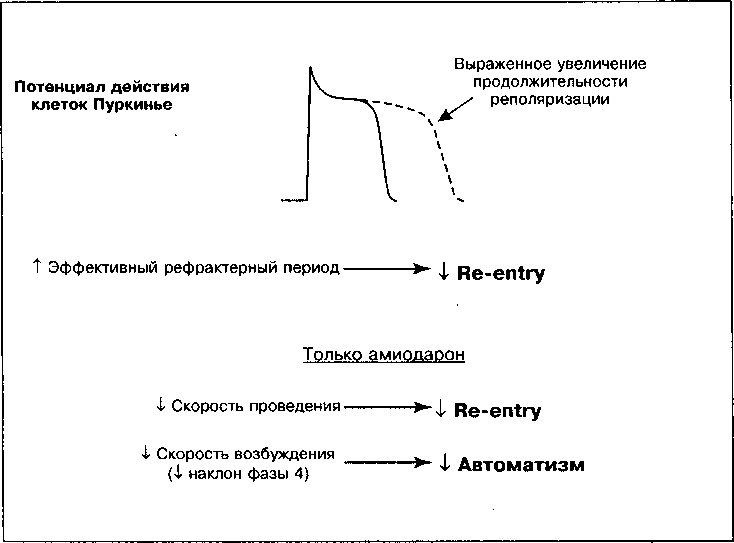
Рис. 17.13. Электрофизиологический эффект антиаритмических препаратов класса III на потенциал действия клеток Пуркинье
препаратами в лечении широкого спектра желудочковых и наджелудочковых тахиаритмий включая мерцание и трепетание предсердий, желудочковую тахикардию, трепетание желудочков и пароксизмальные наджелудочковые тахикардии, в том числе при наличии дополнительных путей проведения. Следствием этого является все большее его применение, особенно у больных с нарушением функции желудочков, у которых часто развиваются проаритмические побочные эффекты других антиаритмических препаратов. Кроме того, применение амиодарона в низких дозах обычно высокоэффективно для длительной профилактики мерцания и трепетания предсердий; при этом препарат хорошо переносится больными.
Амиодарон медленно всасывается из ЖКТ, пик его концентрации в плазме крови достигается только через 5—6 часов. Это крайне липофильное соединение, поэтому препарат активно захватывается тканями и метаболизируется в печени крайне медленно. Период его полувыведения длительный и весьма вариабельный и колеблется от 25 до 60 дней. Выводится амиодарон с желчью, через слезные железы и кожу, почки не участвуют в этом процессе, поэтому у больных с почечной недостаточностью нет необходимости изменять дозу препарата. Вместе с тем проявление побочных эффектов амиодарона контролировать трудно, что обусловлено отсроченным развитием его эффекта и длительностью его действия.
Известен целый ряд побочных эффектов амиодарона. К наиболее серьезным относится токсическое поражение легких, проявляющееся в виде пневмонита, приводящего к фиброзу легких. Этиология этого заболевания не выяснена, полагают, что оно может быть вызвано гиперчувствительностью к препарату; при ранней диагностике оно обратимо.
Другие опасные для жизни побочные эффекты амиодарона связаны с его кардиотоксичностью: это выраженная брадикардия и усиление желудочковых аритмий, которые отмечаются примерно у 2% больных, принимающих препарат. Поскольку амиодарон существенно удлиняет интервал QT, могут развиваться ранние постдеполяризации и аритмия типа torsade de pointes. Кроме того, благодаря тому, что амиодарон оказывает отрицательный инотропный эффект, иногда при его внутривенном введении развивается застойная сердечная недостаточность.
К побочным эффектам со стороны желудочно-кишечного тракта относятся анорексия, тошнота и увеличение активности печеночных ферментов, которые исчезают при снижении дозы препарата. Довольно типичными являются и нарушения функции щитовидной железы, поскольку амиодарон тормозит превращение Т4 в Т3; при этом уровень Т4 в сыворотке крови возрастает, а уровень Т3 — падает. Примерно у 10% пациентов нарушения функции щитовидной железы протекают бессимптомно, однако у 3—5% больных развивается выраженный гипертиреоз или гипотиреоз. К неврологическим побочным эффектам амиодарона относятся слабость проксимальных мышц, периферическая нейропатия, атаксия, тремор, головная боль и нарушения сна. Еще одним типичным побочным эффектом является появление микроотложений в эпителии роговицы, которые обнаруживают практически у всех больных, принимающих амиодарон, при этом нарушения зрения возникают редко.
Из-за возможного развития перечисленных побочных эффектов больным, принимающим амиодарон в течение длительного времени, проводят регулярные исследования, включая электрокардиограмму, рентгенографию грудной клетки, а также анализ функции щитовидной железы и печеночные тесты. Амиодарон взаимодействует с некоторыми лекарствами и влияет на их активность, в том числе с варфарином и дигоксином, что предполагает снижение их дозы. Поскольку амиодарон удлиняет интервал QT, его не следует назначать в комбинации с другими лекарствами, обладающими таким же свойством, например, антиаритмическими препаратами IA класса. Следует также избегать препаратов, оказывающих отрицательный хронотропный или отрицательный инотропный эффекты (0-блокаторы, верапамил, дилтиазем).
Соталол представляет собой неселективный 0-блокатор с антиаритмическими свойствами. Он увеличивает продолжительность потенциала действия, удлиняет рефрактерный период ткани предсердий и желудочков и угнетает проводимость в дополнительных проводящих путях. В обычных дозах не вызывает изменения скорости развития потенциала действия. Соталол эффективен в терапии как наджелудочковых, так и желудочковых аритмий. Его эффективность в профилактике рецидивов мерцания предсердий после кардиоверсии сопоставима с таковой для хинидина, однако, соталол лучше переносится больными. В терапии тяжелых желудочковых аритмий он оказывается более мощным, чем антиаритмические препараты класса I.
Соталол выделяется исключительно почками, поэтому при почечной недостаточности необходима коррекция дозы. К возможным побочным эффектам относятся обычные эффекты p-блокаторов (см. выше). Подобно другим лекарственным препаратам, удлиняющим интервал QT, наиболее серьезным побочным действием соталола является возникновение тахикардии типа torsade de pointes.
Бретилия тозилат — это препарат для внутривенного введения, применяющийся для купирования опасной для жизни желудочковой тахикардии или фибрилляции желудочков. Его часто используют в тех случаях, когда внутривенное вливание лидокаина и/или прокаинамида оказалось неэффективным, например, при остром инфаркте миокарда. Отличие механизма действия бретилия тозилата от других антиаритмических препаратов состоит в том, что он влияет на постганглионарные нервные окончания, где поначалу он способствует высвобождению норадреналина, а затем тормозит его последующую секрецию. Таким образом, после начальной стимуляции активность симпатической нервной системы сердца снижается. Выброс катехоламинов в начале лечения временно усугубляет аритмию, но продолжение терапии сопровождается увеличением продолжительности потенциала действия и рефрактерности предсердий, желудочков и волокон Пуркинье, а также существенным повышением порога фибрилляции желудочков.
Сразу же после применения бретилия может наблюдаться повышение артериального давления, связанное с выбросом катехоламинов. Однако вслед за этим возможна ортостатическая гипотензия, обусловленная ан-тиадренергической активностью препарата.
Ибутилид — это антиаритмический препарат для внутривенного введения, применяемый для купирования пароксизма мерцания или трепетания предсердий. Этот препарат увеличивает продолжительность потенциала действия и повышает рефрактерность предсердий и желудочков. Механизм его действия связан скорее с активацией медленного входящего тока, за счет чего увеличивается плато (фаза 2) потенциала действия, чем с блокированием выходящих токов, что характерно для других представителей антиаритмических препаратов класса III. В клинических испытаниях было показано, что с его помощью удается купировать приблизительно 60% трепетания предсердий и только 30 % случаев мерцания предсердий.
Ибутилид удлиняет интервал QT, поэтому вероятно развитие потенциально смертельной желудочковой тахикардии типа torsade de pointes; в связи с этим введение препарата следует сочетать с тщательным электрокардиографическим мониторированием.
Антиаритмические препараты IV класса
Электрофизиологические эффекты антиаритмических препаратов IV класса обусловлены их способностью селективно блокировать медленные кальциевые каналы сердца L-типа; к ним относятся верапамил и дилтиазем, но не нифедипин и другие производные дигидропиридина. Наиболее мощное действие эти препараты оказывают в тканях, где потенциал действия определяется кальциевыми токами, а именно: в синусовом и атривентрику-лярном узлах. Внутри узла блокада кальциевых каналов сопровождается снижением фазы 4 спонтанной деполяризации (что приводит к снижению автоматизма), повышением пороговой величины потенциала, падением скорости подъема фазы 0 деполяризации и скорости проведения импульса, а также увеличением рефрактерного периода АВ узла (рис. 17.14). Результатом таких электрофизиологических изменений оказываются следующие клинические эффекты:
1. Уменьшение ЧСС.
2. Снижение передачи быстрых импульсов от предсердий через АВ узел к желудочкам, и за счет этого замедление скорости сокращения желудочков при фибрилляции и трепетании предсердий.
3. Возможное прерывание проходящих через АВ узел ритмов типа re-entry.
Основное применение антиаритмических препаратов IV класса, особенно верапамила, заключается в лечении пароксизмальной наджелудочковой тахикардии типа re-entry. Исходно средством первого выбора для купирования острых приступов таких аритмий было внутривенное введе-
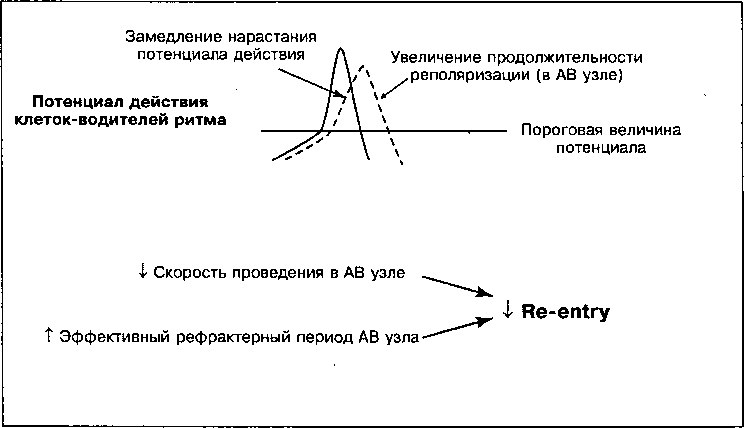
Рис. 17.14. Электрофизиологический эффект антиаритмических препаратов класса IV на потенциал действия клеток-водителей ритма
ние верапамила, однако в настоящее время ему предпочитают внутривенное вливание аденозина (см. ниже). Антиаритмические препараты IV класса показаны также при необходимости снизить частоту сокращения желудочков при фибрилляции и трепетании предсердий.
Фармакология и токсичность антагонистов кальция уже были изложены в настоящей главе. Наиболее важным побочным эффектом внутривенного введения верапамила и дилтиазема, применяемых в качестве антиаритмических средств, является развитие артериальной гипотонии. Кроме того, эти препараты не следует комбинировать с 0-блокаторами из-за возможного аддитивного отрицательного инотропного и хронотропного эффекта.
Аденозин
Аденозин представляет собой эндогенный нуклеозид с очень коротким периодом полувыведения. Внутривенное вливание аденозина считается в настоящее время наиболее адекватным способом купирования пароксизмальной наджелудочковой тахикардии.
Аденозин влияет на электрофизиологические свойства специализированных проводящих тканей, особенно синусового и атриовентрикулярного узлов. Связываясь с рецепторами на поверхности кардиомиоцитов, он активирует специфические калиевые каналы (рис. 17.15). Повышение выходящего калиевого тока вызывает гиперполяризацию мембранного потенциала и за счет этого снижает спонтанную деполяризацию синусового узла.
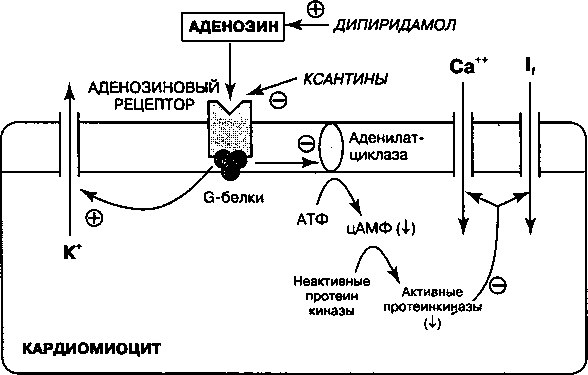
Рис. 17.15. Механизм антиаритмического действия аденозина. При стимуляции аденозиновых рецепторов на кардиомиоцитах активируются калиевые каналы и результирующий выходящий К+-ток гиперполяризует мембрану (снижается автоматизм). Аденозин, кроме того, подавляет активность мембранной аденилатциклазы; последующее угнетение активности протеинкиназ сопровождается падением входящих Са++-токов в клетках водителях ритма (If) (уменьшаются автоматизм и проводимость через АВ узел). Ксантины конкурируют с аденозином за связывание с его рецепторами и блокируют его эффекты. Дипирамидол препятствует захвату аденозина клетками и его деградации, тем самым, усиливая эффект
Помимо этого, аденозин, ингибируя активность аденилатциклазы, снижает внутриклеточную концентрацию циклического АМФ (цАМФ), следствием чего становится уменьшение входящего пейсмекерного тока (If), а также уменьшение входящего кальциевого тока (рис. 17.15). Таким образом, итоговый эффект аденозина заключается в замедлении возбуждения синусового узла и снижении проводимости АВ узла. Кардиомиоциты желудочков относительно устойчивы к этим эффектам, по крайней мере, частично, поскольку в этих клетках отсутствуют специфические калиевые каналы, реагирующие на аденозин.
Преходящая АВ-блокада, индуцированная аденозином, прерывает повторный вход волны возбуждения, в том числе и в АВ узле.
Поскольку время полувыведения аденозина составляет всего 10 с, побочные эффекты (головная боль, боли в груди, приливы, бронхостеноз) носят преходящий характер. Больным, принимающим метилксантины (кофеин, теофиллин) могут потребоваться более высокие дозы аденозина, поскольку эти соединения конкурируют с ним за связывание с аденозиновыми рецепторами. И наоборот, дипиридамол тормозит деградацию аденозина и усиливает его эффект.
В заключение следует отметить, что эффекты антиаритмических препаратов весьма непростые и сопровождаются развитием множества сердечных и внесердечных побочных действий. Большинству этих препаратов присуща потенциальная возможность индуцировать опасные аритмии.
Следует отметить, что в последнее время превалирует тенденция не назначать антиаритмические средства в случаях, когда аритмия, даже опасная, не вызывает субъективных ощущений, и это при том, что в целом антиаритмическая терапия признается необходимой. Это связано с потенциальными побочными эффектами антиаритмических лекарственных средств. В самом деле, до сих пор нет доказательств того, что лечение бессимптомных желудочковых аритмий у больных, перенесших инфаркт миокарда, увеличивает их выживаемость; в то же время установлено, что антиаритмические препараты IC класса увеличивают смертность среди таких больных (см. выше). Эта ситуация стимулировала необходимость разработки нефармакологических средств лечения аритмий, таких как хирургическая или катетерная аблация дополнительных путей и эктопических очагов и имплантация электрических дефибрилляторов.
В любом случае применения антиаритмических препаратов больные должны находиться под наблюдением врача; более того, необходимо убедиться в эффективности препарата и длительно контролировать его токсичность посредством повторных осмотров, определения концентрации препарата в крови, мониторирования электрокардиограммы, а иногда и инвазивного электрофизиологического исследования.
ДИУРЕТИКИ
Мочегонные средства (диуретики) обладают способностью увеличивать экскрецию ионов Na+ и Н2О и применяются весьма часто для лечения сердечной недостаточности и артериальной гипертензии. У больных с сердечной недостаточностью реабсорбция натрия и воды почками усилена, соответственно, повышен и объем внеклеточной жидкости, что во многом обусловливает развитие периферических отеков и застой в малом круге кровообращения. Диуретики уменьшают количество натрия и воды в организме, являясь, тем самым, основным видом терапии, направленной на устранение симптомов застоя (см. главу 9). Лечение артериальной гипертензии с помощью диуретиков отчасти основано на их способности уменьшать объем внутрисосудистой жидкости, а в ряде случаев и на их вазодилатирующем эффекте.
У здоровых взрослых людей скорость клубочковой фильтрации в почках колеблется от 135 до 180 л в день. Большая часть профильтрованного Na+ подвергается реабсорбции в почечных канальцах, в моче остается лишь его незначительное количество натрия (рис. 17.16). Около 65—70 % Na+ реабсорбируется в проксимальных канальцах изоосмотически путем активного транспорта. Оставшиеся 25 % Na+ подвергаются обратному всасыванию в восходящей части петли Генле (ПГ) посредством системы котранспорта Na+ /К+, сопряженного с захватом двух ионов СГ. Поскольку в данном участке реабсорбция воды отсутствует, здесь образуется гипотоническая жидкость, а внеклеточная жидкость становится гипертонической. В дистальных извитых канальцах реабсорбируется еще некоторая часть
Рис. 17.16. Схематическое изображение почечных канальцев. Приблизительно 70 % натрия из клубочкового фильтрата реабсорбируется в проксимальных извитых канальцах (ПИК), 25 % — в широкой восходящей части петли Генле, 5 % — в дистальных извитых канальцах (ДИК) и 1-2 % — в собирательных трубочках кортикального отдела почек (под действием альдостерона). Антидиуретический гормон (АДГ) увеличивает проницаемость дистальных участков нефрона для воды. Диуретики секретируются в ПИК и оказывают свое действие на нижележащих участках
NaCl (около 5 %). В кортикальном отделе собирательной трубки проницаемость для Na+ регулируется таким образом, что в присутствии альдостерона Na+ подвергается обратному всасыванию в эпителиальные клетки канальцев. При этом между клеткой и просветом канальца генерируется разность потенциалов, за счет которой усиливается экскреция К+ и Н+. В этом участке реабсорбируется приблизительно 1—2 % ионов натрия.
За исключением терминального сегмента дистального канальца, все остальные его участки проницаемы для воды. В то же время, в кортикальном отделе собирательных трубок проницаемость для воды и реабсорбция увеличиваются в присутствии антидиуретического гормона (АДГ), а движущей силой этих процессов является осмотический градиент между клетками канальцев и гипертонической внеклеточной жидкостью. Поэтому соединения, которые препятствуют действию АДГ, например, этиловый спирт, оказывают мочегонное действие.
В настоящее время выделяют три основных группы диуретиков: это петлевые, тиазидные и калийсберегающие диуретики (таблица 17.14 и рис. 17.16). Препараты этих трех классов различают, в основном, в зависимости от места их действия в нефроне, а также от их диуретической активности. Петлевые диуретики нарушают всасывание в широкой восходящей части петли Генле, тиазидные диуретики осуществляют свое действие в дистальных канальцах и собирательных трубках, а калийсберегающие диуретики влияют на альдостерон-чувствительные процессы в кортикальном отделе собирательных трубок. Четвертая группа мочегонных препаратов представлена ингибиторами Карбоангидразы; эти довольно слабые диуретики для лечения артериальной гипертензии или сердечной недостаточности применяются редко. Местом их действия являются проксимальные извитые канальцы, где они препятствуют потере ионов бикарбоната (и натрия) с мочой.
Диуретики, как активные фармакологические соединения, секретируются в проксимальных почечных канальцах; на рис. 17.16 схематически показаны основные участки их действия.
Петлевые диуретики
Эти соединения получили свое название в связи с тем, что местом их действия является восходящая часть петли Генле (ПГ). Это мощные мочегонные средства, которые, ингибируя активность системы котранспор-та Na+/ 2СГ/ К+, увеличивают на 20—25 % экскрецию отфильтрованного Na+. При уменьшении реабсорбции в этом участке нефрона нарушается образование гипертонической внеклеточной жидкости, поэтому градиент для пассивного выхода воды из собирательных трубок падает и диурез увеличивается.
Петлевые диуретики находят широкое применение в неотложной терапии отека легких (при внутривенном введении), лечении хронической застойной сердечной недостаточности или периферических отеков (при приеме внутрь). В отличие от многих других диуретиков, препараты этого
класса оказываются эффективными при нарушении функции почек. Дополнительным, если не основным свойством петлевых диуретиков является их способность индуцировать венодилатацию, положительный эффект которой состоит в снижении венозного возврата и легочного застоя (см. главу 9). Механизм венодилатации заключается, по-видимому, в том, что диуретики индуцируют продукцию простагландинов, вызывающих релаксацию гладкой мускулатуры сосудов.
Среди наиболее типичных побочных эффектов петлевых диуретиков следует назвать снижение объема внутрисосудистой жидкости, гипокалиемию и метаболический алкалоз. Гипокалиемия развивается вследствие того, что: 1) эти препараты ухудшают реабсорбцию натрия в петле Генле, при этом содержание Na+ в дистальных канальцах оказывается повышенным, за счет чего более, чем обычно возрастает его обмен на К+ (соответственно, больше К+ выводится с мочой); и 2) индуцируемое диуретиками снижение объема внутрисосудистой жидкости приводит к активации ренин-ангиотензиновой системы. Повышение в результате этого уровня альдостерона способствует дальнейшему Ка+-К+-обмену и, следовательно, развитию гипокалиемии. Назначение диеты, обогащенной К+, или калийсберегающих диуретиков предотвращает развитие гипокалиемии.
Таблица 17.14. Наиболее распространенные диуретики
Диуретик |
Начало эффекта (часы) |
Продолжительность эффекта (часы) |
Потенциальные побочные эффекты |
Тиазидные диуретики Хлортиазид |
ВН: 1 |
6-12 |
Гипокалиемия, гипомаг-незиемия, гипонатрие |
В/В: 0.25 |
2 |
мия, гиперкальциемия гипергликемия, гиперу- |
|
Гирохлортиазид |
ВН: 2 |
12 |
рикемия, гиперхолесте |
Хлорталидон |
ВН: 2 |
24 |
ринемия, гипертригли |
Метол азон |
ВН: 1 |
12-24 |
церидемия, метаболический алкалоз |
Индапамид |
ВН: 1-2 |
16-36 |
|
|
Петлевые диуретики Фуросемид |
ВН: 1 |
6 |
Гипотензия, гипокалиемия, гипомагнезиемия |
В/В: 5 мин |
2 |
гипергликемия, гиперу-рикемия, метаболиче |
|
Буметанид |
ВН: 0.5-1 |
4-6 |
ский алкалоз |
Торсемид |
В/В: 0.25 ВН: <1 |
0.5-1 6-8 |
|
Этакриновая |
В/В: 10 мин В/В: 0.25 |
6-8 3 |
|
кислота |
Примечание: ВН — внутрь; В/В — внутривенно.
В основе метаболического алкалоза, развивающегося при использовании петлевых диуретиков, лежат два механизма: 1) повышение секреции Н+ в дистальных канальцах (и, соответственно, выделение Н+ с мочой), обусловленное вторичным гиперальдостеронизмом (см. выше), и 2) уменьшение объема внутрисосудистой жидкости, которое сопровождается усилением реабсорбции бикарбоната натрия в проксимальных канальцах (рис. 17.16).
При лечении петлевыми диуретиками развиваются и другие побочные эффекты. Поскольку препараты этого класса блокируют транспорт NaCl в широкой части восходящего колена ПГ, от которого зависит реабсорбция магния, возможно снижение в крови концентрации магния. Иногда развивается ототоксичность (токсическое действие на восьмую пару черепных нервов), сопровождающаяся нарушениями слуха и функционирования вестибулярного аппарата. Полагают, что причиной ототоксичности является электролитный дисбаланс эндолимфатической системы, обусловленный, скорее всего тем, что в этом участке под действием петлевого диуретика угнетен котранспорт Na+/ 20’/ К+.
Наиболее часто применяемым представителем петлевых диуретиков является фуросемид. Его лекарственная форма, предназначенная для приема внутрь, хорошо всасывается в желудочно-кишечном тракте, но характеризуется коротким периодом действия (от 4 до 6 часов), что ограничивает его использование при лечении хронической артериальной гипертензии. Буметанцц — близкородственное с фуросемидом соединение, он обладает такими же свойствами и ему присущи те же побочные эффекты; вместе с тем, буметанид является более мощным диуретиком с более высокой биодоступностью. Он, по-видимому, реже, чем другие препараты этого класса, вызывает ототоксичность. Буметанид иногда назначают при ЗСН, когда не удается устранить отеки с помощью других лекарств, а также больным, имеющим аллергию на фуросемид. Недавно появился новый препарат из класса петлевых диуретиков — торсемид, который в низких дозах с успехом применяется для лечения артериальной гипертензии (с минимальным диуретичским эффектом), а в высоких дозах по своему диуретическому действию сходен с фуросемидом. Этакриноваяя кислота является единственным представителем петлевых диуретиков, не принадлежащих к сульфонамидам, поэтому ее назначают больным, не переносящим сульфонамидные препараты. Этакриновая кислота не находит особо широкого применения вследствие ее сравнительно высокой ототоксичности.
Начало |
Продолжитель |
Потенциальные |
эффекта |
ность эффекта |
побочные |
Диуретик (часы) |
(часы) |
эффекты |
Калийсберегающие ди |
Г иперкал иемия, нару |
|
уретики |
шения со стороны ЖКТ, |
|
Спиронолактон ВН: 1-2 дня |
2-3 дня |
гинекомастия (спиронолактон) |
Триамтерен ВН: 2 |
12-16 |
|
Амилорид ВН: 2 |
24 |
Тиазидные диуретики
Тиазидные диуретики и их производные (хлорталидон, индапамид и метолазон) применяются чаще всего; это связано с тем, что при приеме внутрь они очень быстро всасываются в ЖКТ и хорошо переносятся больными. Они менее мощные, чем петлевые диуретики, но благодаря своему длительному действию показаны больным с такими хроническими заболеваниями, как эссенциальная артериальная гипертензия и нетяжелая застойная сердечная недостаточность.
Местом действия препаратов этого класса являются дистальные почечные канальцы, где они подавляют реабсорбцию примерно 3—5 % отфильтрованного натрия (рис. 17.16). Реабсорбция Na+ в этом участке нефрона осуществляется через Na+/ Cl'-котранспортер, локализованный на мембране со стороны просвета канальца. Механизм, с помощью которого тиазидные диуретики ингибируют этот перенос, остается неясным и может заключаться в конкуренции препарата за места связывания СГ. Вначале антигипертензивный эффект связан со снижением сердечного выброса за счет уменьшения объема внутрисосудистой жидкости и постоянства периферического сосудистого сопротивления. Однако при длительном использовании тиазидных диуретиков сердечный выброс часто возвращается к нормальным значениям, тогда как общее периферическое сосудистое сопротивление снижается за счет необъяснимой вазодилатации. Индапамид является единственным представителем этого класса диуретиков, который обладает выраженным вазодилатирующим эффектом.
Тиазидные диуретики обычно назначают для приема внутрь. Диурез наступает через 1—2 часа, однако полный антигипертензивный эффект может проявиться лишь через 12 недель непрерывной терапии (что, возможно, связано с вазодилатирующим эффектом, упоминавшимся выше). Хлоротиазид, родоначальник препаратов этого класса, обладает низкой жирорастворимостью и, следовательно, низкой биодоступностью: в связи с этим для достижения терапевтического эффекта его необходимо назначать в более высоких дозах, чем более распространенный гидрохлоротиа-звд. Хлорталидон всасывается медленно, поэтому продолжительность его действия больше. Метолазон, в отличие от других препаратов этого класса, иногда оказывается эффективным у больных со сниженной почечной функцией.
Отличие терапевтического действия тиазидных диуретиков от петлевых состоит в том, что они менее мощные, характеризуются более длительным периодом действия и (за исключением метолазона) малоэффективны как мочегонные средства у больных с нарушениями функции почек: обычно они неэффективны при скорости клубочковой фильтрации < 25 мл/мин.
Традиционно тиазидные диуретики используют в качестве основного средства антигипертензивной терапии, что связано с их низкой стоимостью и высокой эффективностью. Особенно эффективны они у больных с артериальной гипертензией, «зависимой от объема», у лиц негроидной расы и пожилых пациентов (см. главу 13). Однако из-за потенциального побочного действия диуретики уступают позицию антигипертензивных препаратов первого ряда другим лекарственным средствам, включая ингибиторы АПФ и блокаторы Са++-каналов.
Иногда тиазидные диуретики применяют при умеренной сердечной недостаточности. Кроме того, их комбинируют с петлевыми диуретиками при рефрактерности устойчивых к последним. Комбинация препаратов двух классов позволяет снизить дозозависимые побочные эффекты, характерные для каждого из них, а поскольку их действие направлено на последовательно расположенные сегменты почечного канальца, натрийуретический эффект сочетанной терапии оказывается более выраженным, чем при монотерапии каждым из препаратов.
К наиболее серьезным побочным эффектам тиазидных диуретиков относятся: 1) гипокалиемия и метаболический алкалоз, которые частично обусловлены повышенным поступлением ионов Na+ в дистальные канальцы, где происходит их обмен на К+ и Н+, а частично уменьшением объема жидкости и вторичным гиперальдостеронизмом, как это было описано выше для петлевых диуретиков; 2) гипонатриемия, которая развивается при длительном лечении за счет непрерывной экскреции Na+ в условиях постоянного избыточного потребления жидкости; 3) гиперурикемия (вплоть до развития подагры), причиной которой является сниженный клиренс мочевой кислоты; 4) гипергликемия, которая возникает либо из-за нарушенной секреции инсулина поджелудочной железой, либо из-за сниженной утилизации глюкозы в периферических тканях; 5) дислипидемия, характеризующаяся повышенным уровнем ХС ЛНП и триглицеридов; и 6) слабость, утомляемость и парестезии, которые появляются при длительном лечении и обусловлены гиповолемией и гипокалиемией. В ходе терапии тиазидными диуретиками часто отмечают небольшое повышение уровня кальция в сыворотке крови, которое, однако, клинически незначимо.
В прошлые десятилетия стандартные дозы тиазидных диуретиков были завышены по сравнению с современной практикой. Используя низкие дозы препаратов, можно увеличить положительный эффект мочегонных препаратов этого класса, одновременно сведя к минимуму перечисленные выше их побочные действия.
Калийсберегающие диуретики
Препараты этого класса являются относительно слабыми диуретиками. Они препятствуют физиологической реабсорбции Na+ в дистальных извитых канальцах и собирательных трубочках кортикального отдела. Ка-лийсберегающие диуретики уменьшают экскрецию К+, снижая, тем самым, риск гипокалиемии. Их применяют с целью поддержания нормального уровня калия в сыворотке крови, а также при избытке альдостерона (первичный или вторичный гиперальдостеронизм). В эту группу входят представители двух групп лекарственных средств: 1) антагонисты альдостерона (например, спиронолактон) и 2) препараты, непосредственно уменьшающие проницаемость собирательных протоков для Na+, действие которых не зависит от альдостерона (например, триамтерен и амилорид).
Na+-K+ -обменом в собирательных трубках можно объяснить лишь небольшую часть обратного всасывания натрия, поэтому с помощью монотерапии этими препаратами не удается получить клинически значимый диурез. Эти средства скорее применяют в комбинации с петлевыми и тиазидными диуретиками для получения дополнительного мочегонного действия, а также для профилактики клинически значимой гипокалиемии.
Спиронолактон представляет собой синтетический стероид, который конкурирует с цитоплазматическими рецепторами к альдостерону, угнетая, тем самым, альдостерон-чувствительные №+-каналы. Поскольку реабсорбция Na+ через этот канал подавлена, отрицательный потенциал в просвете канальцев отсутствует; это препятствует экскреции ионов К+ и Н+ в дистальных участках нефрона, поэтому ионы К+ и Н+ остаются в кровотоке.
Наиболее серьезным осложнением применения спиронолактона является развитие гиперкалиемии, обусловленной нарушением экскреции этого иона. Таким образом, при использовании калийсберегающих диуретиков следует избегать постоянного приема препаратов калия или применения ингибиторов АПФ (которые также снижают концентрацию альдостерона в сыворотке крови), поскольку эти лекарства вносят свой вклад в развитие гиперкалиемии. Спиронолактон обладает и антиандрогенной активностью, что может стать причиной гинекомастии у мужчин и нарушений менструального цикла у женщин.
Триамтерен и амилорид — близкие по структуре калийсберегающие диуретики, обладающие сходными фармакодинамическими свойствами и оказывающие свое действие независимо от спиронолактона. В дистальных канальцах они блокируют Ка+-каналы, поэтому экскреция К+ и Н+ уменьшается. Триамтерен метаболизируется в печени, а его активный метаболит секретируется в проксимальные канальцы с помощью системы транспорта органических катионов. Амилорид секретируется непосредственно в проксимальные канальцы и в неизменном виде выводится с мочой. Как и для спиронолактона, наиболее серьезным потенциальным побочным эффектом этих препаратов является развитие гиперкалиемии.
АНТИТРОМБОТИЧЕСКИЕ ПРЕПАРАТЫ
Тромбоциты и белки свертывающей системы крови играют ключевую роль в патогенезе многих сердечно-сосудистых заболеваний, включая острые коронарные синдромы (нестабильная стенокардия, острый инфаркт миокарда), тромбоз глубоких вен и образование тромбов, осложни-ющих мерцательную аритмию, дилатационную кардиомиопатию или работу протезов клапанов сердца. В связи с этим регуляция функции тромбоцитов и системы свертывания крови часто оказывается крайне важной в терапии сердечно-сосудистых заболеваний.
Формирование сосудистого тромба, будь то при остановке кровотечения в норме или при патологическом образовании сгустка, включает три этапа: 1) взаимодействие форменных элементов крови с тромбогенным материалом (например, обнажение субэндотелиального коллагена в результате разрыва атеросклеротической бляшки; 2) активацию тромбоцитов и 3) инициацию каскада свертывания крови, приводящего в конечном итоге к образованию фибринового сгустка. Процессы остановки кровотечения, осуществляемые тромбоцитами и свертывающей системой крови, тесно связаны друг с другом: активированные тромбоциты ускоряют свертывания крови, а определенные белки свертывающей системы (например, тромбин) вносят свой вклад в агрегацию тромбоцитов.
В данном разделе мы, прежде всего, остановимся на препаратах, влияющих на функционирование тромбоцитов, а затем рассмотрим лекарства, которые тормозят каскад коагуляции. Тромболитические агенты (называемые еще фибринолитическими), которые растворяют уже сформировавшийся кровяной сгусток, описаны в главе 7.
Ингибиторы агрегации тромбоцитов
Тромбоциты участвуют в процессе первичной остановки кровотечения. Их активация включает три стадии: 1) адгезию к пораженному участку, 2) реакцию высвобождения (секрецию тромбоцитарных продуктов и активацию ключевых рецепторов) и 3) агрегацию. Например, при повреждении кровеносного сосуда тромбоциты при помощи мембранных гликопротеиновых рецепторов быстро прилипают к ставшим доступными компонентам субэндотелиального пространства (к коллагену); этот процесс регулируется фактором Виллебранда. Вслед за адгезией тромбоцитов к сосудистой стенке высвобождается содержимое их цитоплазматических гранул (включая кальций, АДФ, серотонин и тромбин). Активация тромбоцитов и секреция содержимого гранул стимулируются при их связывании с агонистами (в частности, с коллагеном и тромбином). В ходе этого процесса активация тромбоцитов индуцирует синтез de novo и секрецию тромбоксана А2 (ТХА2), мощного вазоконстриктора и индуктора агрегации (рис. 17.17). АДФ, тромбин и ТХА2 способствуют агрегации тромбоцитов и, тем самым, вносят вклад в формирование первичного кровяного сгустка. В процессе активации тромбоцитов происходят важные конформационные изменения гликопротеиновых мембранных рецепторов Ilb/IIIa. Эти изменения приводят к тому, что ранее неактивные IIb/IIIa-рецепторы связывают молекулы фибриногена, в результате чего тромбоциты прочно соединяются друг с другом, образуя агрегаты.
Регуляция активации тромбоцитов в значительной мере осуществляется за счет высвобождения Са++ из депо тромбоцитов. В результате этого повышается концентрация кальция в цитозоле клетки, активируются протеинкиназы и, в конечном итоге, происходит фосфорилирование регуляторных белков внутри тромбоцитов. Повышение [Са++] в цитозоле клетки стимулирует, кроме того, фосфолипазу А2, вызывая высвобождение арахидоновой кислоты — предшественника ТХА2 (рис. 17.17). Высвобождение кальция регулируется несколькими факторами. При связывании тромбина и других агонистов с соответствующими рецепторами на мембране тромбоцитов, образуются промежуточные соединения, которые стимулируют высвобождение кальция из депо. ТХА2 повышает уровень внутриклеточного [Са++], связываясь на поверхности тромбоцитов со своим
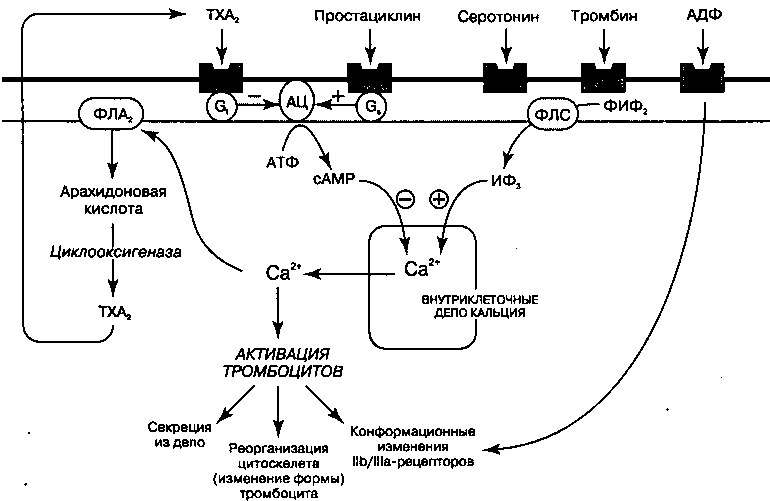
Рис. 17.17. Активация тромбоцитов опосредуется внутриклеточным [Са++]. Показаны факторы, ускоряющие и тормозящие высвобождение кальция из его депо в тромбоцитах. Тромбин и серотонин, связываясь со специфическими рецепторами, стимулируют продукцию инозитолтрифосфата (ИФ3) из фосфатидилинозитолдифосфата (ФИФ2) под действием фосфолипазы С (ФЛС). ИФ3 усиливает выход кальция в цитоплазму клетки. Тромбоксан А2 (ТХА2) также способствует высвобождению кальция: он угнетает активность аденилатцик-лазы (АЦ), что сопровождается снижением продукции циклического АМФ (цАМФ). При нормальных условиях цАМФ препятствует высвобождению [Са++] из ЭР, поэтому уменьшение этого эффекта, обусловленное действием ТХА2, повышает выход кальция в цитоплазму. Образующийся в клетках эндотелия простациклин оказывает противоположное действие: стимулируя активность АЦ и образование цАМФ, он уменьшает высвобождение кальция внутри тромбоцитов. Кальций усиливает активность фосфолипазы А2 (ФЛА2), под действием которой из фосфолипидов клеточной мембраны образуются предшественники ТХАг. При активации тромбоцитов [Са++] изменяется, в результате чего высвобождается содержимое кальциевых депо, происходит реорганизация цитоскелета и существенно меняется конформация гликопротеиновых IIb/IIIa-рецепторов, т. е. происходят процессы, необходимые для агрегации тромбоцитов. Определенный вклад в агрегацию тромбоцитов вносит и АДФ, однако посредники этого процесса пока не установлены
рецептором, который подавляет активность аденилатциклазы, снижая, тем самым, продукцию цАМФ и повышая выход [Са++] из депо (рис. 17.17). В отличие от этого, продуцируемый эндотелиальными клетками простациклин (PGI2) стимулирует активность аденилатциклазы, повышает концентрацию цАМФ в тромбоцитах и тормозит секрецию [Са++] из депо.
Современные антитромбоцитарные средства влияют на функцию тромбоцитов на разных стадиях процессов их активации и агрегации. Самым распространенным антитромбоцитарным препаратом является аспирин. Среди других применяемых в клинике лекарственных средств следует назвать дипиридамол и тиклопидин. Активно изучаются потенциальные новые препараты, блокирующие IIb/IIIa-рецепторы тромбоцитов, уточняется их значение в терапии сердечно-сосудистых заболеваний.
АСПИРИН
Как было сказано в предыдущем разделе, ТХА2, метаболит арахидоновой кислоты, является важнейшим медиатором активации тромбоцитов и образования кровяного сгустка. Механизм действия аспирина (ацетилсалициловой кислоты) заключается в обратимом ацетилировании (и, тем самым, угнетении активности) циклооксигеназы — ключевого фермента синтеза простагландина и тромбоксана из арахидоновой кислоты (рис. 17.17). Поскольку в тромбоцитах нет ядра и они, соответственно не способны осуществлять синтез новых белков, аспирин необратимо тормозит продукцию ТХА2 в этих клетках.
Продукция в эндотелиальных клетках PGI2, основного антагониста ТХА2, также зависит от активности циклооксигеназы, поэтому аспирин в высоких дозах может угнетать и его синтез. Однако, в отличие от тромбоцитов, эндотелиальные клетки способны синтезировать новые порции циклооксигеназы взамен фермента, инактивированного путем ацетилирования. Таким образом, применение аспирина в низких дозах сопровождается эффективным торможением синтеза ТХА2 в тромбоцитах и не оказывает существенного влияния на продукцию и положительное действие PGI2.
Антитромботический эффект аспирина ограничивается ингибированием продукции ТХА2, поэтому этот препарат практически не препятствует агрегации тромбоцитов, индуцируемой другими факторами (в частности, АДФ и коллагеном). Иными словами, аспирин не относится к «полноценным» антитромботическим средствам.
Клиническое применение
Положительный эффект терапии аспирином у больных с сердечно-сосудистыми заболеваниями доказан во многих клинических исследованиях (таблица 17.15). Убедительно показано, что у больных с нестабильной стенокардией, острым инфарктом миокарда или у лиц, перенесших ИМ, аспирин снижает частоту возникновения новых смертельных и несмертельных коронарных эпизодов. Аналогичным образом, у пациентов с хронической стабильной стенокардией, но не перенесших ИМ, аспирин успешно снижает вероятность развития инфаркта миокарда и смертность от него. У больных, перенесших легкий мозговой инсульт или преходящие нарушения мозгового кровообращения, аспирин снижает вероятность развития мозгового инсульта и сердечно-сосудистых осложнений в будущем. У пациентов, перенесших аорто-коронарное шунтирование, аспирин уменьшает вероятность появления рестенозов.
Положительный эффект применения аспирина с целью первичной профилактики (среди лиц, не страдающих сердечно-сосудистыми заболеваниями и не имеющих их симптомов) не столь очевиден. В исследовании, проведенном на большой когорте здоровых американцев среднего возраста, была выявлена положительная ассоциация между терапией аспирином и снижением заболеваемости несмертельным ИМ, но обнаружено повышение вероятности развития несмертельного геморрагического мозгового инсульта и желудочно-кишечного кровотечения; на показатели общей смертности аспирин не влиял. Таким образом, хотя аспирин оказывается крайне ценным терапевтическим средством для лечения больных с уже выявленным заболеванием сердечно-сосудистой системы, совсем не очевидно, что вполне здоровые люди должны постоянно принимать аспирин в качестве «профилактического» средства. В настоящее время проводятся крупномасштабные исследования, целью которых является получить более определенные данные по этому вопросу.
В настоящее время аспирин в малых дозах (75—325 мг в день) рекомендуется назначать больным с клиническими проявлениями ишемической болезни сердца в отсутствие противопоказаний (в том числе, аллергии на аспирин или перечисленных ниже побочных эффектов). Его не следует назначать здоровым людям для постоянного применения в целях первичной профилактики. Опираясь на результаты еще не законченных исследований, многие врачи считают возможным говорить о пользе применения аспирина у мужчин старше 50 лет с наличием нескольких факторов риска (т. е. с высокой вероятностью развития коронарной болезни сердца, как описано в главе 5). Наконец, аспирин менее эффективен, чем варфарин (см. ниже) в профилактике мозгового инсульта у пациентов с мерцанием предсердий, составляющих группу высокого риска; его следует применять только в тех ситуациях, когда применение варфарина небезопасно.
Побочные эффекты
Типичные побочные эффекты аспирина отмечаются со стороны желудочно-кишечного тракта и включают диспепсию и тошноту, которые часто можно устранить путем снижения дозы и/или применением покрытых оболочкой или забуференных таблеток. К более серьезным потенциальным побочным эффектам относятся желудочно-кишечное кровотечение и геморрагический инсульт. Из организма аспирин выводится почками, где он конкурирует с мочевой кислотой за транспортер органических анионов в проксимальных почечных канальцах, поэтому иногда он вызывает развитие подагры.
Таблица 17.15, Применение антитромбоцитарных лекарственных препаратов
Препарат |
Стабильная стенокардия |
Нестабильная стенокардия |
Острый ИМ |
Перенесенный ИМ |
После АКШ |
Преходящее нарушение мозгового кровообращения |
Проксимальный ТГВ |
Искусственный клапан |
Мерцание предсердий |
Антитромбоци-тарные: |
|||||||||
Аспирин |
+ |
+ |
+ |
+ |
+ |
+ |
(1) |
(2) |
|
|
Дипиридамол Тиклопидин Абциксимаб (4) |
+ |
(3) |
|||||||
Антикоагулянты: |
|||||||||
Гепарин |
4- |
(5) |
+ |
(6) |
(6) |
||||
НМГ |
(7) |
||||||||
Варфарин |
(8) |
(9) |
+ |
+ |
+ |
(1) Применяют иногда в комбинации с варфарином
(2) Если у больного невысокий риск развития мозгового инсульта или если противопоказан варфарин
(3) Применяют иногда в комбинации с варфарином при рецидивирующих эмболиях, однако предпочтительнее комбинация аспирин + варфарин
(4) Применение этого ингибитора тромбоцитарного гликопротеина Па/ШЬ в настоящее время оправдано только для лечения больных высокого риска после ангиопластики
(5) После тромболитической терапии ТАП или при наличии распространенного участка акинеза
(6) У стационарных больных, которым противопоказан варфарин
(7) В профилактических целях после протезирования тазобедренного или коленного суставов или после операции на брюшной полости
(8) В течение 3—6 месяцев при наличии акинеза во многих сегментах сердца
(9) Если установлен источник эмболии
НМГ — низкомолекулярный гепарин; ТГВ — тромбоз глубоких вен
ДРУГИЕ АНТИТРОМБОЦИТАРНЫЕ ПРЕПАРА ТЫ
Дипиридамол иногда назначают пациентам, которые не переносят аспирин, однако он менее эффективен. Он препятствует адгезии тромбоцитов в местах сосудистого поражения, потенцирует антитромбоцитарный эффект PGI2, а в высоких дозах повышает в тромбоцитах уровень цАМФ, который, в свою очередь, снижает [Са++] в цитозоле и тормозит агрегацию тромбоцитов (рис. 17.17).
Доказательства положительного действия самого дипиридамола отсутствуют, поэтому его не следует назначать вместо аспирина, если только у больного нет непереносимости ацетилсалициловой кислоты. Его изредка используют в комбинации с варфарином для усиления антитромботиче-ского эффекта у больных с рецидивирующей тромбоэмболией, связанной с установкой искусственных клапанов сердца. Эта комбинация аспирина с варфарином является более эффективной. Гораздо чаще дипиридамол используют при фармакологическом стресс-тесте (см. главы 3 и 6), когда его вводят внутривенно, чтобы блокировать удаление аденозина и усилить, тем самым, его вазодилатирующее действие на коронарные сосуды.
Среди побочных эффектов дипиридамола отмечают раздражение желудочно-кишечного тракта, головную боль, головокружение, приливы, а иногда и стенокардию, вызванную избыточной коронарной вазодилатацией.
Для агрегации тромбоцитов и образования сгустка необходимы соответствующие изменения IIb/IIIa-гликопротеиновых (ГП)-рецепторов мембран, которые связываются с фибриногеном. Тиклопидин необратимо блокирует эти рецепторы и делает невозможным их связывание с фибриногеном; вследствие этого предотвращается возможность агрегации тромбоцитов и образование тромбоцитарного сгустка.
Тиклопидин эффективен в профилактике ишемического инсульта у больных, перенесших ранее мозговой инсульт или преходящую ишемию головного мозга. Вместе с тем, его применение ограничено из-за наиболее серьезного побочного действия — агранулоцитоза, который может оказаться опасным для жизни. Таким образом, этот препарат назначают, в основном, тем пациентам, которые не переносят аспирин. Использование коротких курсов тиклопидина может оказаться полезным для профилактики окклюзии, развивающейся после установки внутрикоронарных стентов.
Принципиальный механизм агрегации тромбоцитов заключается в связывании молекул фибриногена с ГП IIb/Ша-рецепторами, в результате чего тромбоциты слипаются друг с другом. К этим тромбоцитарным рецепторам были получены моноклональные антитела, которые связываются с рецептором и тормозят агрегацию. Первый из таких агентов, аб-циксимаб, эффективно предотвращает связывание фибриногена, фактора Виллебранда и других молекул адгезии с IIb/Ша-рецепторами; было показано, что при этом снижается частота эпизидов ишемии после коронарной ангиопластики. В настоящее время активно изучаются другие положительные свойства этих препаратов.
Антикогулянты
Антикоагулянты вмешиваются в каскад свертывания крови и нарушают вторичный гемостаз. Поскольку конечным результатом как внутреннего, так и внешнего пути свертывания крови является образование фибринового сгустка под действием тромбина, основная цель антикоагулянтной терапии состоит в подавлении активности тромбина (например, с помощью гепарина и подобных соединений) или в снижении продукции функционально активного протромбина (с помощью варфарина).
ГЕПАРИН
Гепарин представляет собой полимер мукополисахарид, несущий на себе сильный отрицательный заряд и оказывающий многофакторное воздействие на процесс коагуляции. Антикоагулянтный эффект гепарина как такового довольно слабый, однако при связывании в кровотоке с антитромбином III (AT III) его антикоагулянтная способность возрастает. AT III — это белок, который угнетает действие тромбина и других факторов свертывания. При образовании комплекса гепарина с AT III, его сродство к тромбину возрастает в 1000 раз, в значительной мере подавляя способность тромбина опосредовать образование фибрина из фибриногена. Комплекс гепарин- AT III ингибирует и активность фактора X, внося дополнительный вклад в антикоагулянтное действие препарата. Более того, гепарин, связываясь с фактором Виллебранда и блокируя его активность, оказывает и антитромботическое действие.
Гепарин применяют парентерально, поскольку он не всасывается в ЖКТ. При острых состояниях применяют внутривенное болюсное введение гепарина с последующей непрерывной инфузией препарата. Биодоступность гепарина у разных людей различна, поскольку препарат представляет собой гетерогенную смесь молекул, связывающихся с плазменными белками, макрофагами и эндотелиальными клетками. Из-за возможной нейтрализации действия гепарина индивидуальная зависимость эффекта от дозы часто оказывается непредсказуемой. В связи с этим, для обеспечения надежного контроля скорости введения лекарственного препарата необходимо проводить мониторирование антикоагулянтного эффекта (чаще всего на основании величины активированного частичного тромбопластинового времени).
Внутривенные инъекции гепарина показаны при следующих сердечно-сосудистых заболеваниях: 1) нестабильная стенокардия (см. главу 6), 2) острый ИМ с последующей тромболитической терапией тканевым активатором плазминогена или при распространенном обширного нарушении сократимости ЛЖ (см. главу 7), 3) эмболия легочной артерии или проксимальный тромбоз глубоких вен (ТГВ) (см. главу 15) и 4) если больной, нуждающийся в длительной антикоагулянтной терапии, не может принимать препарат per os (например, больные с искусственным клапаном сердца в послеоперационном периоде). Часто больным, находящимся в стационаре или на постельном режиме и не получающим гепарин внутривенно, для профилактики ТГВ назначают подкожные инъекции гепарина в фиксированных низких дозах.
Наиболее серьезным побочным эффектом гепарина является кровотечение, в том числе, возможность внутричерепного кровоизлияния при избытке антикоагулянта. Примерно у 2,5 % пациентов развивается индуцированная гепарином тромбоцитопения. В мягких формах (когда считается, что тромбоцитопения вызвана индуцированной гепарином агрегацией тромбоцитов) она протекает бессимптомно, однако, в более тяжелых случаях может стать причиной кровотечения или тромбоза (обусловленного выработкой антител к тромбоцитам, результатом чего будет их агрегация). У больных, находящихся на длительном лечении гепарином, может развиться остеопороз (сниженное образование и ускоренная резорбция костной ткани), механизмы этого процесса, однако, пока не установлены.
При передозировке гепарина или при опасных для жизни кровотечениях, возникших при его применении, используют внутривенные инъекции протамин-сульфата, который образует с гепарином стабильный комплекс и немедленно блокирует его антикоагулянтное действие.
НИЗКОМОЛЕКУЛЯРНЫЙ ГЕПАРИН
Некоторые недостатки стандартных препаратов гепарина (в частности, короткий период полувыведения, непредсказуемая биодоступность) удалось устранить с помощью создания гепарина с низким молекулярным весом (НМГ), который недавно появился в арсенале клиницистов. НМГ получают деполимеризацией стандартного гепарина, при этом образуются фрагменты, составляющие примерно треть исходной молекулы. НМГ взаимодействует с AT III, а образующийся комплекс угнетает активность фактора свертывания крови Ха. С теоретической точки зрения НМГ обладает рядом преимуществ по сравнению со стандартным препаратом, а именно: 1) он способен ингибировать связанный с тромбоцитами фактор Ха и за счет этого оказывать более выраженный антикоагулянтный эффект, 2) он в меньшей степени связывается с белками плазмы и эндотелиальными клетками, поэтому характеризуется более предсказуемой биодоступностью и большей продолжительностью действия, и 3) он в меньшей степени затрагивает функцию тромбоцитов и поэтому вызывает меньше геморрагических осложнений. С практической точки зрения основным преимуществом НМГ является то, что он гораздо более удобен в применении: его назначают подкожно 1 раз в день в фиксированной дозе, при этом лабораторного контроля за его действием не требуется.
В клинических испытаниях было показано, что НМГ столь же эффективен и безопасен для профилактики ТГВ, как и стандартный гепарин. Более того, частота развития тромбоцитопении при использовании НМГ гораздо ниже. Во время подготовки настоящей книги появились доказательства того, что НМГ эффективен в профилактике ТГВ после операции на тазобедренном или коленном суставах, или на брюшной полости; вполне вероятно, что клинические показания к его применению будут расширяться.
ИНГИБИТОРЫ ТРОМБИНА ПРЯМОГО ДЕЙСТВИЯ
Антикоагулянтный эффект гепарина ограничен зависимостью его активности от AT III, а также тем, что он ингибирует только тромбин, находящийся в крови. Тромбин же, связанный с фибрином в составе кровяного сгустка, оказывается устойчивым к антикоагулянтному действию большого гепарин- АТ Ш-комплекса. К прямым ингибиторам тромбина относятся исследуемые в настоящее время соединения, которые угнетают активность тромбина независимо от AT III и влияют как на тромбин, циркулирующий в кровотоке, так и на связанный в сгустке. В этой связи они могут оказаться более эффективными антикоагулянтами. В отличие от гепарина, они не вызывают тромбоцитопению.
ВАРФАРИН
Варфарин представляет собой препарат, назначаемый для приема внутрь с целью долговременного антикоагулянтного действия. Он тормозит свертывание крови, выступая в роли антагониста синтеза в печени витамин К-зависимых факторов коагуляции (это фактор II, или протромбин, а также факторы VII, IX, X). В норме восстановленная форма витамина К ускоряет карбоксилирование остатка глутаминовой кислоты в молекулах перечисленных факторов, что является необходимым условием для последующего связывания ими ионов кальция и участия в процессе свертывания крови (рис. 17.18). Вмешиваясь в образование восстановленной формы витамина К, варфарин косвенно тормозит карбоксилирование факторов свертывания, оставляя их неактивными. Поскольку некоторые природные ингибиторы процесса свертывания (протеин С и протеин S) являются тоже витамин К-зависимыми, варфарин нарушает их функционирование, что в ряде случаев может нейтрализовать антикоагулянтный эффект препарата.
Антикоагулянтный эффект варфарина развивается лишь через 2—7 дней, поэтому если необходимо получить немедленный эффект, в первые несколько дней одновременно следует назначать внутривенные инъекции геаприна. Период полувыведения варфарина составляет 37 часов. Дозу лекарства необходимо подбирать индивидуально, чтобы достичь те-
Рис. 17.18. Механизм действия варфарина. В норме факторы II, VII, IX и X подвергаются карбоксилированию в печени в присутствии витамина К. Варфарин тормозит образование восстановленной формы витамина К, в результате факторы свертывания остаются функционально неактивными рапевтического эффекта с минимальным риском кровотечения. Степень антикоагулянтного действия препарата контролируют путем измерения протромбинового времени, которое в целях единой стандартизации выражают в виде Международного Нормализационного Отношения (МНО). Существуют два «целевых» диапазона интенсивности антикоагулянтной терапии. У больных с очень высоким риском развития патологического тромбоза (например, при искусственном клапане сердца) целевое значение МНО составляет 2,5—3,5. При менее выраженном риске тромбоза (в частности, у больных с мерцательной аритмией) целевой уровень МНО равен 2,0—3,0.
На антикоагулянтный эффект варфарина влияют самые разные факторы, при этом возникает необходимость изменения дозы препарата. Например, при заболеваниях печени или сердечной недостаточности потребность в варфарине уменьшается, тогда как при потреблении пищи, обогащенной витамином К (к примеру, зелень) необходимо увеличение дозы варфарина. Аналогичным образом, многие фармакологически активные соединения изменяют антикоагулянтный эффект варфарина (в таблице 17.16 приведены примеры таких веществ). Наконец, сочетанное использование варфарина с аспирином или другими антитромбоцитарными препаратами увеличивает риск кровотечения.
Если в ходе терапии варфарином развивается серьезное кровотечение, эффект препарата можно устранить в течение нескольких часов с помощью приема витамина К. Однако больным с искусственным клапаном сердца назначать такой антидот не следует, если нет опасности для жизни, поскольку в противном случае возможно развитие тромбоза клапана.
Варфарин обладает тератогенной активностью, поэтому его не следует назначать при беременности, особенно в первом триместре.
Таблица 17.16. Лекарственные препараты, влияющие на антикоагулянтный эффект варфарина
Ослабление антикоагулянтного эффекта |
Усиление антикоагулянтного эффекта |
Барбитураты |
Амиодарон |
Рифампин |
Антибиотики ряда цефалоспорина |
Карбамазепин |
Циметидин |
Холестирамин |
Эритромицин |
Нафциллин |
Флуконазол |
Сукральфат |
Изониазид Кетоконазол Метронидазол Фенитоин Пропафенон Триметоприм-сульфаметоксазол |
ЗАКЛЮЧЕНИЕ
В настоящей главе рассмотрены наиболее часто применяемые лекарственные препараты для лечения сердечно-сосудистых заболеваний. Более подробно эти препараты описаны в приведенных ниже научных статьях, тем не менее, мы надеемся, что представленные здесь таблицы, рисунки и краткое изложение вопроса окажутся полезными для вас в настоящее время и пригодятся впоследствии по мере того, как вы будете вникать в патофизиологию сердечно-сосудистых заболеваний, в процессе лечения больных.