Врожденные пороки сердца
Врожденные пороки сердца — это аномалии развития, сопряженные с нарушениями сердечной функции. Они относятся к наиболее распространенным врожденным порокам развития и встречаются с частотой 8 случаев на 1000 новорожденных. Бывают очень серьезные пороки, которые требуют немедленного медицинского вмешательства, другие пороки менее выражены и сопровождаются незначительными нарушениями физиологических функций. Несмотря на то, что врожденные пороки сердца уже имеются при рождении ребенка, часто проходит несколько дней, недель или месяцев, прежде чем они проявят себя. Иногда врожденный порок сердца обнаруживают только в зрелом возрасте.
В последние полвека произошел колоссальный скачок в понимании патофизиологии врожденных пороков сердца, а также в возможностях их диагностики и лечения. Вместе с тем, этиология большинства врожденных пороков сердца все еще остается неясной. Показано, что определенный вклад в развитие пороков сердца вносят мутации отдельных генов, факторы окружающей среды, токсические воздействия во время беременности и вирусные инфекции, однако в большинстве случаев причины остаются неизвестными.
В последние десятилетия показатели выживаемости детей с врожденными пороками сердца значительно улучшились, большей частью благодаря усовершенствованию методов диагностики и хирургической техники. Тем не менее, более 20% детей, у которых на первом месяце жизни обнаруживают тяжелый порок сердца, не проживут более 1 года.
Сердечно-сосудистая система закладывается на третьей неделе эмбрионального развития и представляет собой скопление ангиогенных клеток у рострального конца развивающегося плода. Клетки растут, делятся и образуют примитивную полую трубку, которая в конечном итоге разовьется в четырехкамерное сердце. В ходе развития у эмбриона появляется уникальная система кровообращения, обеспечивающая внутриутробное развитие плода за счет использования плаценты в качестве органа для газообмена, питания и выделения. В момент рождения плацента становится ненужной, поскольку легкие плода раздуваются и начинают функционировать. Наряду с этим характер кровотока в сердечнососудистой системе новорожденного претерпевает ряд существенных изменений, позволяющих ему приспособиться к жизни вне материнской утробы.
Приведенное краткое изложение позволяет оценить всю сложность кардиогенеза, а также представить себе возможные пути возникновения нарушений. Настоящая глава начинается с обзора развития сердечно-сосудистой системы плода, затем в ней дается описание большинства наиболее известных форм врожденных пороков сердца.
НОРМАЛЬНОЕ РАЗВИТИЕ
СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
В середине третьей недели беременности потребности быстрорастущего плода в питании и газообмене обеспечивать только путем диффузии уже невозможно; возникает необходимость в развитии первой системы органов эмбриона — сердечно-сосудистой системы, которая позволит тканям осуществлять обмен веществ за счет их транспорта на значительные расстояния.
Развитие сердечной трубки
Приблизительно на 17-й день эмбриогенеза мезенхимальные клетки, расположенные на вентральной (брюшной) стороне перикардиального целома, начинают размножаться и, в конце концов, образуют два удлиненных скопления клеток, называемых ангиобластными тяжами. В этих тяжах появляются каналы, превращающиеся в парные эндотелиальные сердечные трубки (рис. 16.1). Боковые эмбриональные складки, расположенные напротив этих двух трубок, способствуют их слиянию по вентральной срединной линии для образования к 22-му дню беременности единой эндокардиальной трубки. Трубка разрастается рострально (вверх) с образованием дуги аорты и каудально (вниз) с образованием сосудов венозной системы. Вслед за образованием трубки и ее последующим развитием с образованием миокарда из спланхномезодермы (внутренностной мезодермы); к концу третьей недели примитивное сердце начинает сокращаться, заставляя циркулировать кровь. Перикардиальный целом, окружающий кардиогенную зону, превращается, в конечном итоге, в перикардиальную полость, в которой и расположится будущее сердце.
Формирование сердечной петли
По мере роста и удлинения сердечной трубки в ней образуются последовательные сужения и расширения, которые формируют первые примитивные камеры сердца — артериальный ствол, луковицу сердца, желудочек, предсердие и венозный синус (рис. 16.2). Для продолжения роста и удлинения в пространстве, ограниченном перикардиальной полостью, возникает необходимость изгибания самой сердечной трубки, которая, в конце концов, образует U-образную петлю, направленную вентрально и вправо. В результате такого изгибания трубки в петлю предсердие и венозный синус оказываются расположенными сверху и сзади артериального ствола, луковицы сердца и желудочка (рис. 16.3). В этот момент еще окончательно не сформированы ни перегородки между развивающимися камерами сердца, ни клапаны. Соединение между примитивным предсердием и желудочком называется атриовентрикулярным каналом. В процессе дальнейшего развития атриовентрикулярный канал разделяется на два самостоятельных канала, в одном из них находится трехстворчатый клапан, а в другом — митральный клапан. Венозный синус в конечном итоге входит в состав правого предсердия, образуя коронарный синус и часть стенки правого предсердия.
Разделение сердца на камеры
Появление перегородок в развивающемся предсердии, атриовентрикулярном канале и желудочке начинается в середине четвертой недели
Рис. 16.1. Поперечные срезы эмбриона, иллюстрирующие слияние двух сердечных трубок в единую эндокардиальную сердечную трубку. А. 18-й день. Б. 21-й день. В. 22-й день
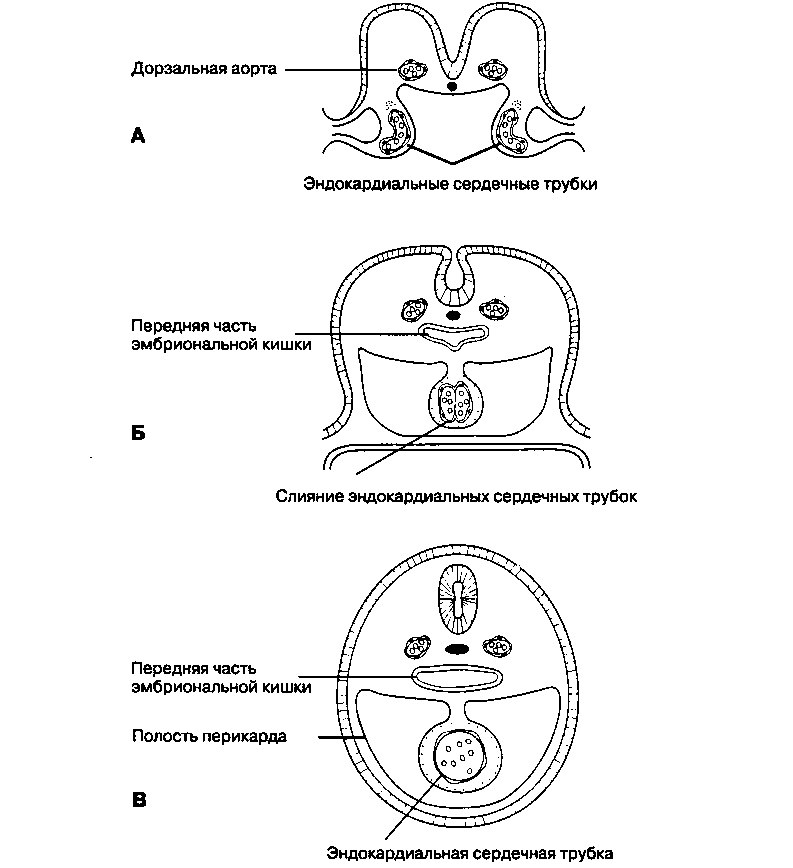
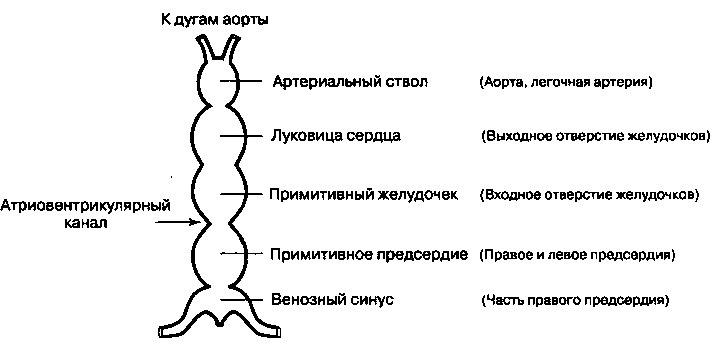
Рис. 16.2. Прямая сердечная трубка примерно на 22-й день эмбриогенеза. В скобках указаны структуры, которые в конечном итоге образуются из каждого сегмента трубки.
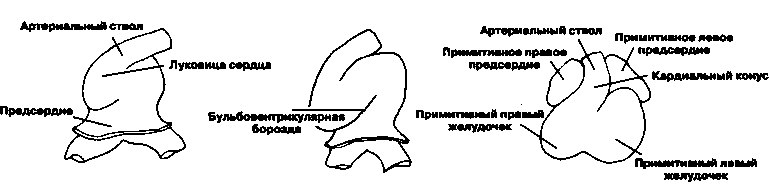
Рис. 16.3. Слева и посередине. К 24-му дню для продолжения роста и удлинения в пространстве, ограниченном перикардиальной полостью, возникает необходимость изгиба сердечной трубки, которая, в конце концов, образует U-образную петлю, направленную вентрально и направо. Справа. При закручивании трубки в петлю предсердия оказываются расположенными сверху и сзади примитивных желудочков
беременности и продолжается до конца пятой недели. Здесь эти события описаны раздельно, однако следует помнить, что все три процесса протекают одновременно.
ПОЯВЛЕНИЕ МЕЖПРЕДСЕРДНЫХ ПЕРЕГОРОДОК
Первичная межпредсердная перегородка, называемая septum primum, появляется в виде выступа ткани на верхней стенке общего предсердия, который разрастается внутрь полости предсердия (рис. 16.4). При разрастании первичной перегородки между ее серповидным краем и эндокардиальными валиками (скоплениями мезенхимальной ткани), окружающими атриовентрикулярный канал, образуется довольно большое отверстие, которое называется первичным отверстием, или ostium primum. Первичное отверстие обеспечивает ток крови между формирующимися предсердиями. В конечном счете, первичная перегородка смыкается с верхним краем эндокардиальных валиков, закрывая первичное отверстие. Однако до того как завершится зарастание первичной перегородки, в ее центре появляются мелкие перфорации, которые, сливаясь, образуют отверстие, называемое вторичным отверстием, или ostium secundum, и позволяющее сохранить кровоток между предсердиями (рис. 16.4.). Вслед за зарастанием первичного отверстия сразу же над первичной перегородкой несколько правее начинает выпячиваться вторая серповидная мембрана, называемая вторичной перегородкой, или septum secundum. Эта перегородка, разрастаясь вниз, перекрывает вторичное отверстие. В конце концов, вторичная перегородка срастается с эндокардиальными валиками, хотя и не полностью, оставляя отверстие, называемое овальным отверстием. Верхний край первичной перегородки постепенно исчезает, тогда как ее нижний край сохраняется и функционирует как «створчатый» клапан овального отверстия. Клапан обеспечивает ток крови между предсердиями только справа налево; при любом повышении давления в левом предсердии первичная перегородка накладывается на вторичную перегородку, препятствуя току крови слева направо (рис. 16.5). Во время беременности кровь движется из правого предсердия в левое через овальное отверстие за счет разности давления между предсердиями (у плода давление в правом предсердии выше, чем в левом). После рождения направление градиента давления меняется, и клапан закрывается (см. ниже).
Рис. 16.4. Формирование межпредсердной перегородки: А — 30 дней, Б — 33 дня, В — 37 дней беременности и Г — новорожденный. При разрастании первичной перегородки в направлении желудочков между ней и атриовентрикулярным каналом образуется первичное отверстие. До того как зарастание первичного отверстия завершится, перфорации в верхней части первичной перегородки формируют так называемое вторичное отверстие. Второе выпячивание ткани, или вторичная перегородка, разрастается вниз вправо от первичной перегородки, частично перекрывая вторичное отверстие. Овальное отверстие представляет собой отверстие во вторичной перегородке, которое как бы «лоскутным клапаном» закрывается нижним краем первичной перегородки. (Модифицировано из работы: Moss AJ, Adams FH. Heart Disease in Infants, Children, and Adolescents. Baltimore: Williams & Wilkins, 1968: 16)
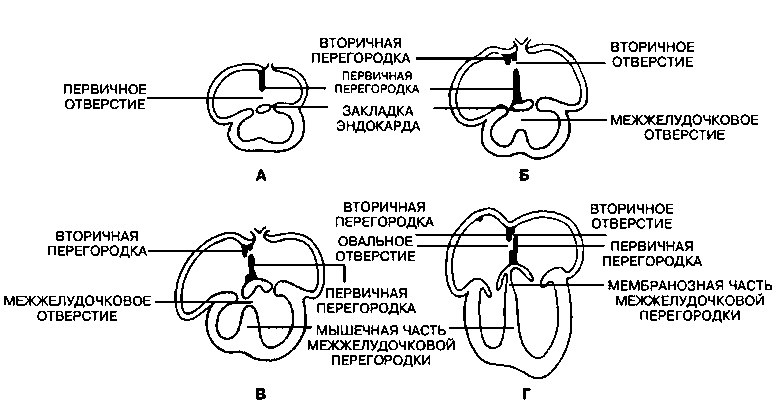
Рис. 16.5. Диаграмма, изображающая работу «створчатого» клапана овального окна. А. До рождения ребенка клапан обеспечивает ток крови только справа налево из правого предсердия (ПП), где давление выше, в левое предсердие (ЛП), давление в котором более низкое. Б. После рождения давление в ЛП становится выше, чем в ПП, вследствие чего первичная перегородка плотно прижимается ко вторичной перегородке. (Модифицировано из работы: Moore KL, Persaud TVN. The Developing Human. Philadelphia: WB Saunders, 1993:318)
РАЗДЕЛЕНИЕ АТРИОВЕНТРИКУЛЯРНОГО КАНАЛА
Разрастание эндокардиальных валиков вносит вклад в формирование межпредсердных перегородок и мембранозной части межжелудочковой перегородки, о чем речь пойдет ниже. Однако основное разрастание эндокардиальных валиков происходит в горизонтальной плоскости, в результате рост правого, левого, верхнего и нижнего эндокардиальных валиков приводит к появлению перегородки атриовентрикулярного канала (рис. 16.6). При разделении образуются правый и левый каналы, которые дадут начало, соответственно, трехстворчатому и митральному отверстиям1.
РАЗДЕЛЕНИЕ ЖЕЛУДОЧКОВ И ОБРАЗОВАНИЕ
ЖЕЛУДОЧКОВЫХ ВЫНОСЯЩИХ ТРАКТОВ
К концу четвертой недели беременности примитивный желудочек начинает расти и расширяться, оставляя посередине мышечный вырост —
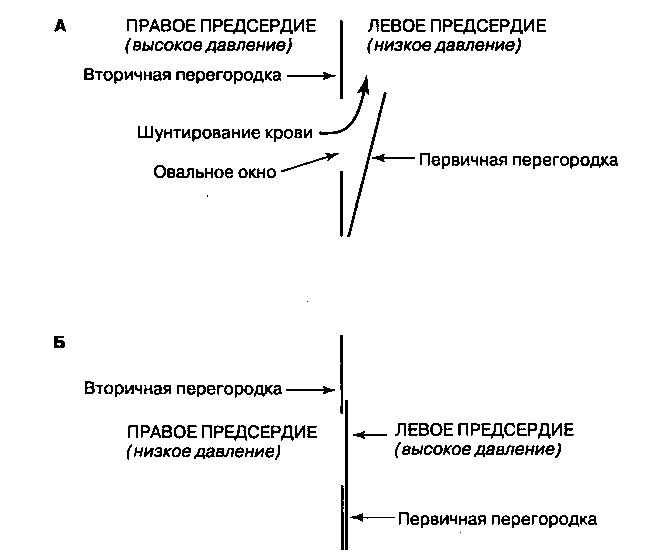
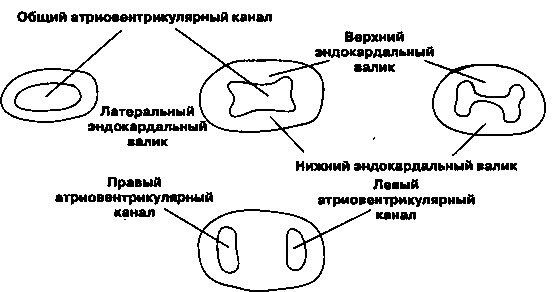
Рис. 16.6. Основные стадии формирования перегородки атриовентрикулярного канала. Перегородка образуется при разрастании эндокардиальных валиков вверх, вниз и в стороны. Эндокардиальные валики представляют собой скопления клеток мезенхимы, окружающие атриовентрикулярный канал и способствующие образованию отверстий митрального и трехстворчатого клапанов, а также формированию верхней межжелудочковой и нижней межпредсердной перегородок
примитивную межжелудочковую перегородку. Рост межжелудочковой перегородки в высоту на ранних стадиях развития обусловлен, в основном, расширением двух новых желудочков, образующихся по обе стороны от перегородки, и лишь позднее размеры перегородки увеличиваются за счет деления и роста новых клеток. Свободный конец мышечной межжелудочковой перегородки не смыкается с эндокардиальными валиками; отверстие, которое остается и обеспечивает сообщение между правым и левым желудочками, называется межжелудочковым отверстием (рис. 16.7). Это отверстие остается открытым до седьмой недели беременности, когда при слиянии бульбарных бороздок (см. ниже) и эндокардиальных валиков формируется мембранозная часть межжелудочковой перегородки.
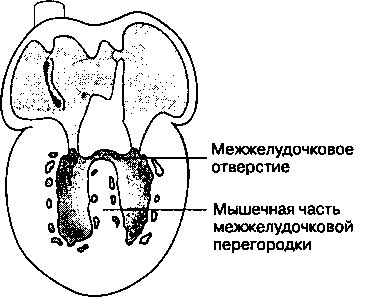
Рис. 16.7. Межжелудочковая перегородка и межжелудочковое отверстие. (Модифицировано из работы: Moore KL, Persaud TVN. The Developing Human. Philadelphia: WB Saunders, 1993:325)
В течение пятой недели в луковице сердца и артериальном стволе происходит размножение клеток мезенхимы, и образуются парные выпячивания, называемые бульбарными бороздками (рис. 16.8). Эти бороздки посередине сливаются и образуют аорто-легочную перегородку. Эта перегородка делит луковицу сердца и артериальный ствол на два отдельных артериальных канала: легочную артерию, которая теперь оказывается продолжением правого желудочка, и аорту, которая является продолжением левого желудочка. В конце развития луковица сердца оказывается •включенной в состав правого желудочка и образует инфундибулярный отдел, который выполняет функции выносящего тракта правого желудочка. Как упоминалось выше, эндокардиальные валики, разрастаясь вперед, сливаются с аорто-легочной перегородкой, а, разрастаясь каудально, сливаются с мышечной межжелудочковой перегородкой, в результате формируется мембранозная межжелудочковая перегородка, которая закрывает межжелудочковое отверстие.
Развитие сердечных клапанов
РАЗВИТИЕ ПОЛУЛУННЫХ КЛАПАНОВ
(КЛАПАНЫ А ОРТЫ И ЛЕГО ЧНОЙ АРТЕРИИ)
Полулунные клапаны начинают формироваться непосредственно перед завершением образования аорто-легочной перегородки. Процесс начинается с того, что из трех выростов субэндокардиальной мезенхимальной ткани вокруг аорты и легочной артерии формируются отверстия. Под действием процесса запрограммированной гибели клеток и потока крови эти выросты, в конце концов, принимают соответствующую полулунную форму и превратились в три хорошо знакомые тонкостенные створки клапанов аорты и легочной артерии.
РАЗВИТИЕ А ТРИОВЕНТРИКУЛЯРНЫХ КЛАПАНОВ
(МИТРАЛЬНОГО И ТРЕХСТВОРЧАТОГО)
После смыкания закладки эндокарда и образования перегородки между правым и левым атриовентрикулярными каналами клетки субэндокардиальной мезенхимы, окружающей каждый канал, начинают пролиферировать; в результате формируются выросты, аналогичные тем, которые образуются в процессе развития полулунного клапана. Вскоре после этого на вентрикулярной поверхности зародышевых листков включается процесс программированной гибели миокардиальных клеток. В результате остаются лишь тонкие мышечные тяжи, соединяющие клапаны со стенкой желудочка (рис. 16.9). Эти мышечные тяжи в конечном итоге дегенерируют и заменяются тяжами из плотной соединительной ткани, или сухожильными нитями.
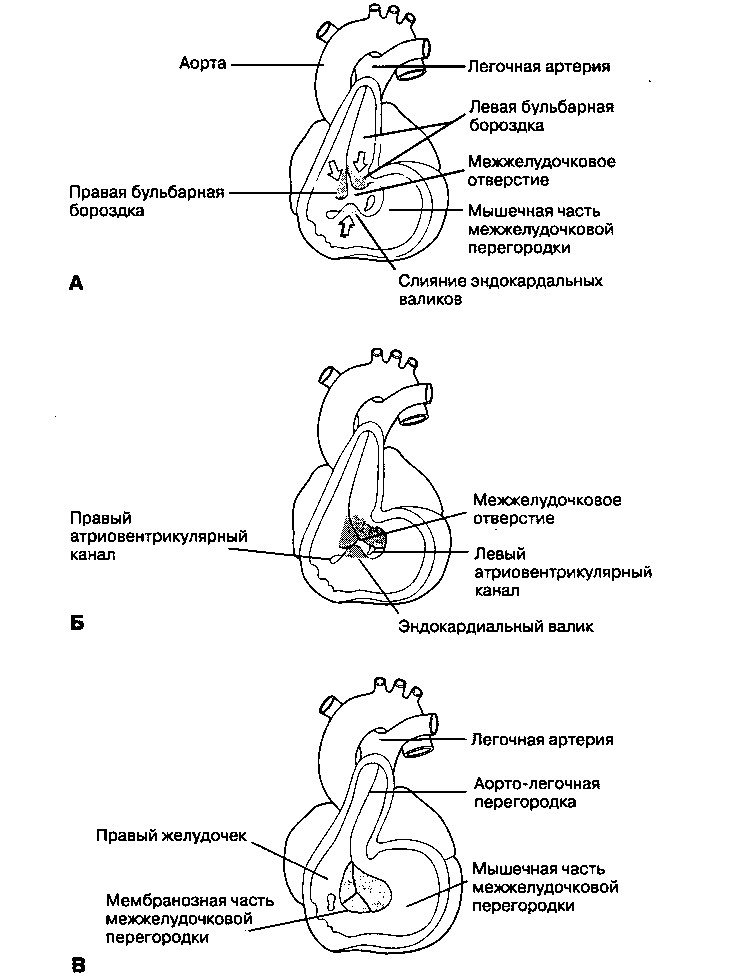
Рис. 16.8. Формирование аорто-легочной перегородки происходит путем слияния бульбарных бороздок, в результате чего луковица сердца и артериальный ствол разделяются на аорту и легочную артерию (А, пять недель; Б, шесть недель; В, семь недель беременности). Луковица сердца превращается в выносящий тракт правого желудочка. При смыкании эндокардиального валика с аорто-легочной перегородкой и мышечной частью межжелудочковой перегородки образуется мембранозная часть межжелудочковой перегородки. (Модифицировано из работы: Moore KL, Persaud TVN. The Developing Human. Philadelphia: WB Saunders, 1993:322)
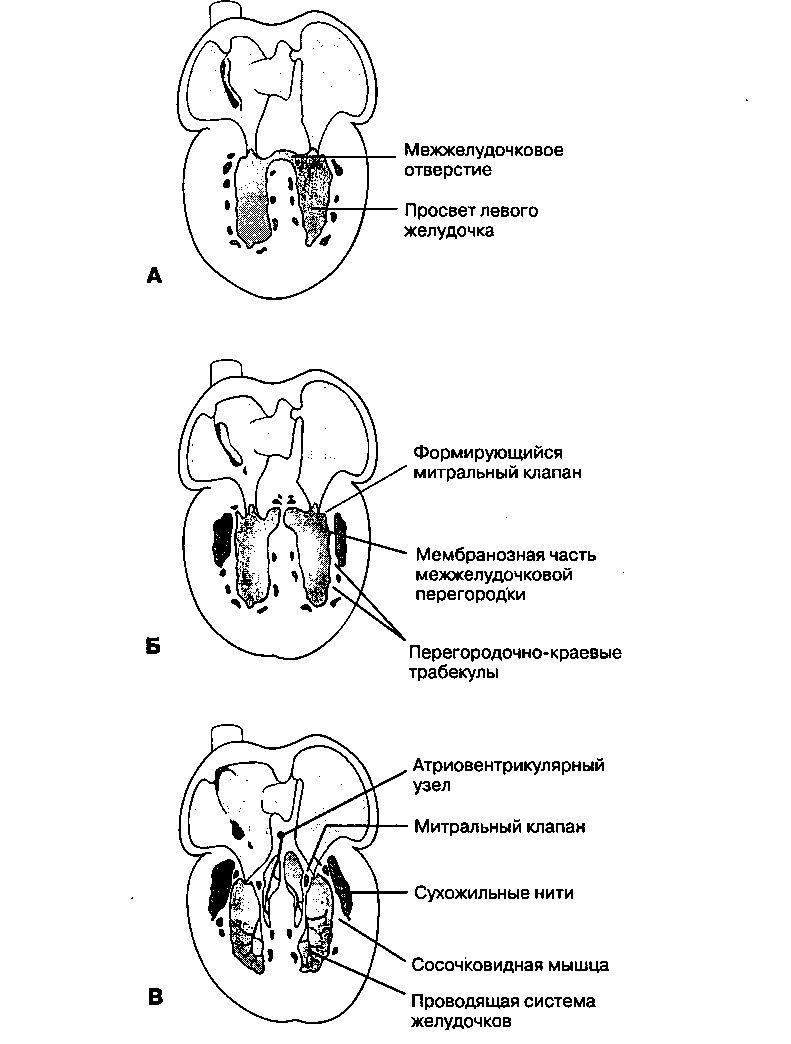
Рис. 16.9. При пролиферации клеток мезенхимы, окружающей атриовентрикулярные каналы, образуются атриовентрикулярные клапаны. При дегенерации миокарда и его замене соединительной тканью образуются сухожильные нити; посредством сосочковидных мышц они прикрепляются к стенке желудочка. (Модифицировано из работы: Moore KL, Persaud TVN. The Developing Human. Philadelphia: WB Saunders, 1993:325)
КРОВООБРАЩЕНИЕ ПЛОДА И ИЗМЕНЕНИЯ КРОВООБРАЩЕНИЯ ПОСЛЕ РОЖДЕНИЯ
Кровообращение плода устроено таким образом, чтобы полностью обеспечивать потребности внутриутробного развития. К моменту рождения система кровообращения автоматически подвергается модификациям, приводящим к появлению у новорожденного ребенка нормального кровообращения.
Кровообращение плода
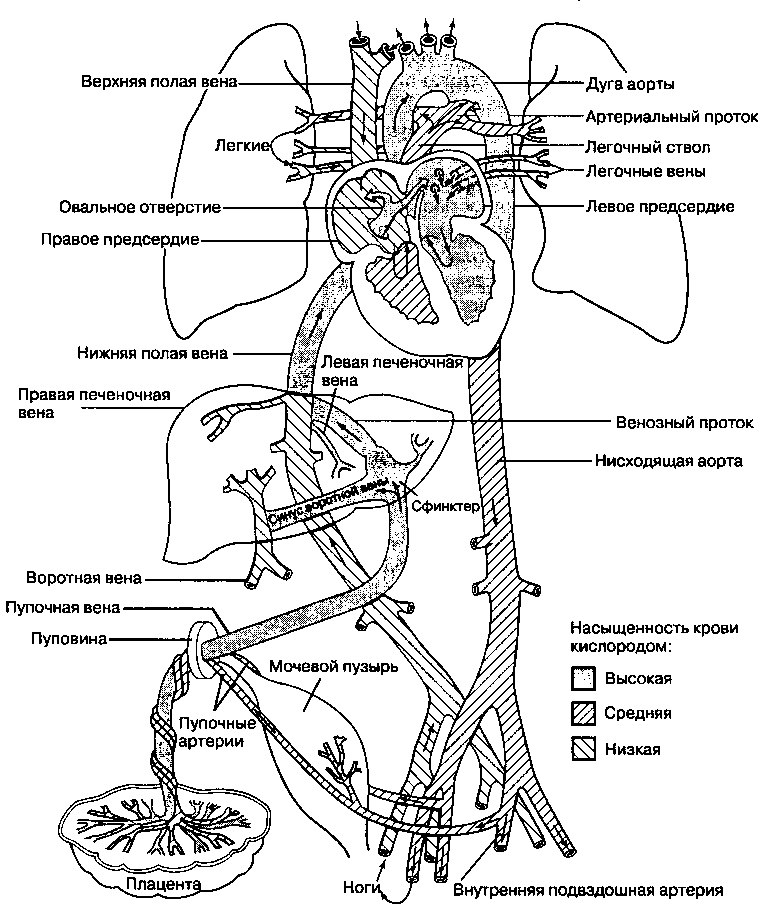
У плода насыщенная кислородом кровь поступает от плаценты по единственной пупочной вене (рис. 16.10). Примерно половина крови из пуповины сбрасывается через венозный проток плода, минуя сосудистую систему печени и попадая непосредственно в нижнюю полую вену. Остальная кровь через воротную вену поступает в печень и оттуда по печеночным венам направляется в нижнюю полую вену. В результате кровь в нижней полой вене представляет собой смесь насыщенной кислородом (оксигенированной) крови из пупочной вены и крови с низким напряжением кислорода, возвратившейся из вен плода. Из-за того, что кровь в нижней полой вене смешанная, напряжение кислорода здесь выше, чем в крови, возвращающейся в правое предсердие плода из верхней полой вены. Это различие весьма важно, поскольку два потока крови в правом предсердии разделяются и в итоге следуют различными путями. В результате такого разделения в мозг и миокард плода поступает кровь с относительно высоким содержанием кислорода, тогда как менее оксигенированная кровь направляется в плаценту (через нисходящую аорту и пупочные артерии) для насыщения кислородом.
Большая часть крови, поступающей в правое предсердие из нижней полой вены, через овальное отверстие попадает в левое предсердие. Внутрисердечному сбросу относительно хорошо оксигенированной крови способствует нижний край вторичной перегородки, называемый евстахиева заслонка, которая расположена над отверстием, ведущим из нижней полой вены в правое предсердие. Поступившая через шунт кровь смешивается с небольшим количеством плохо оксигенированной крови, возвращающейся в левое предсердие через легочные вены плода (напомним, что во время внутриутробного развития легкие не вентилируются; формирующаяся легочная ткань скорее забирает кислород из крови, чем осуществляет его доставку). Из левого предсердия кровь попадает в левый желудочек и затем изгоняется в восходящую аорту. Из аорты хорошо оксигенированная кровь распределяется, в основном, в трех направлениях: 1) примерно 9% крови, выброшенной из левого желудочка, попадает в коронарные артерии и осуществляет перфузию миокарда, 2) 62% крови через сонные и подключичные артерии попадает в верхние отделы туловища и в мозг, и 3) 29% крови поступает в нисходящую аорту и распределяется в остальных органах плода.
Рис. 16.10. Кровообращение плода (описание в тексте). Стрелками показано направление потока крови. В ходе внутриутробного развития три шунта (венозный проток, овальное отверстие и артериальный проток) позволяют большей части крови миновать легкие и печень, но вскоре после рождения эти шунты прекращают функционировать ((Модифицировано из работы: Moore KL, Persaud TVN. The Developing Human. Philadelphia: WB Saunders, 1993:344)
Остатки насыщенной кислородом крови из нижней полой вены, попадая в правое предсердие, смешиваются с плохо оксигенированной кровью, попавшей сюда из верхней полой вены, и поступают в правый желудочек. У плода правый желудочек выполняет основную работу, на две трети обеспечивая сердечный выброс. Изгнанная из правого желудочка кровь поступает в легочную артерию, а оттуда через артериальный проток попадает в нисходящую аорту (80% сердечного выброса), и через легочные артерии — в легкие (12% крови, выбрасываемой правым желудочком). Такое, казалось бы, неравномерное распределение крови, выбрасываемой из правого желудочка, на самом деле весьма эффективно: кровь минует легкие, что крайне важно, поскольку легкие плода заполнены амниотической жидкостью и неспособны осуществлять газообмен. Низкое напряжение кислорода в жидкости, содержащейся в легких, вызывает сокращение легочных сосудов и способствует увеличению сопротивления сосудистой системы легких. При повышенном сопротивлении легочных сосудов облегчается сброс крови через артериальный проток в большой круг кровообращения и, в конце концов, большая часть крови, изгнанная из сердца, попадает в нисходящую аорту. Отсюда кровь распределяется в нижние отделы плода и в пупочные артерии, возвращаясь, таким образом, в плаценту для газообмена.
Изменения кровообращения после рождения
Сразу же после рождения новорожденный быстро приспосабливается к жизни вне материнской утробы. Начавшие функционировать легкие заменяют плаценту как орган газообмена и три шунта (венозный проток, овальное отверстие и артериальный проток), которые были необходимы в период беременности. Подобное перемещение центра газообмена и сопровождающие его изменения в строении сердечно-сосудистой системы обеспечивают новорожденному независимое от матери существование.
Как только пупочный канатик оказывается пережатым или сжимается сам по себе, плацентарное кровообращение прекращает свое функционирование; в результате чего возрастает общее периферическое сосудистое сопротивление. Наряду с этим происходит падение сопротивления легочных сосудов, что обусловлено двумя причинами: 1) механическим раздуванием легких после рождения, когда легочная ткань растягивается, вызывая расширение легочной артерии и утончение ее стенки и 2) дилатацией кровеносных сосудов легких, что, как полагают, обусловлено увеличением напряжения кислорода в крови при начале их вентиляции. Снижение сопротивления легочных сосудов сопровождается резким увеличением потока крови через малый круг кровообращения. Падение сопротивления легочных сосудов наиболее выражено в первые 24 часа после рождения и продолжается в течение последующих 2—6 недель, пока не достигнет уровня взрослого человека.
По мере того, как сопротивление легочных сосудов падает, а поступление крови в легкие через легочную артерию возрастает, венозный возврат из легочных вен в левое предсердие также увеличивается и давление в левом предсердии растет. В то же время, с прекращением потока крови через пуповину и перекрытием венозного протока давление в нижней полой вене и правом предсердии снижается. В результате изменения давления в предсердиях (давление в левом предсердии становится выше, чем в правом), клапан овального отверстия прижимается к вторичной перегородке, перекрывая, таким образом, существовавший кровоток между предсердиями (рис. 16.5).
Как только в легких новорожденного кровь начала насыщаться кислородом, артериальный проток становится лишним и начинает закрываться. Считается, что такое перекрытие вызвано местной реакцией тканей протока на повышение напряжения кислорода после рождения и, возможно, обусловлено изменением уровня брадикинина или простагландинов, высвобождающихся из легких в момент их раскрытия. Иными словами, в период внутриутробного развития в ответ на относительную гипоксию плод продуцирует повышенное количество простагландина Е2 (PGE2), который и вызывает расширение артериального протока. После рождения уровень PGE2 снижается и проток сжимается. Чувствительность протока к вазоактивным веществам зависит от зрелости плода: у недоношенных детей проток часто не закрывается, что приводит к врожденной аномалии, открытому артериальному протоку (см. ниже).
Поскольку анатомическое разделение двух потоков крови, вытекающих из правых и левых отделов сердца, уже завершено, сердечный выброс из левого желудочка возрастает, а из правого — снижается, так что право- и левожелудочковый выбросы становятся одинаковым. Повышение нагрузки давлением и объемом на левый желудочек вызывает его гипертрофию, а снижение нагрузки давлением и объемом на правый желудочек сопровождается регрессом гипертрофии правого желудочка.
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА
До рождения ребенка врожденные пороки сердца обычно не проявляются. У плода, находящегося в утробе матери, сброс крови осуществляется через артериальный проток и овальное отверстие, за счет чего кровь движется в обход большинства дефектов. Только после рождения, когда новорожденный отделяется от материнской кровеносной системы, обеспечивавшей окисление крови плода, а система шунтов закрывается, врожденные дефекты начинают проявляться.
Существует несколько способов клинической классификации врожденных пороков сердца. Например, их можно разделить на нарушения «цианотические» и «без цианоза». К цианотическим относят пороки, сопровождающиеся развитием синевато-пурпурного цвета кожи и слизистых за счет повышенной концентрации в крови восстановленного гемоглобина. Причиной цианоза при врожденных пороках сердца является вторичная гипоксемия, обусловленная тем, что обедненная кислородом кровь сбрасывается справа налево, минуя легкие.
К порокам сердца без цианоза относят те дефекты развития, которые приводят либо к сбросу крови слева направо, либо к врожденным внутрисердечным или сосудистым стенозам, либо к недостаточности клапанов. Выраженный сброс крови слева направо на уровне предсердий, желудочков или крупных сосудов (см. ниже) сопровождается повышением объема крови и давления в легочной артерии; в дальнейшем возможно развитие гипертрофии легочных артериол и повышение сосудистого сопротивления. В результате развивается легочная гипертензия, которая во многом обусловливает клинические проявления и прогноз лежащего в ее основе врожденного порока. Со временем повышенное сопротивление легочных сосудов может привести к изменению исходного направления потока крови на противоположное, т. е. с преимущественным шунтированием крови справа налево, что будет сопровождаться гипоксемией и цианозом.
Легочная гипертензия, вызванная хронической перегрузкой объемом при большом сбросе крови слева направо, известна как синдром Эйзенменгера. При гистологическом исследовании выявляют гипертрофию медии легочных артерий и пролиферацию клеток интимы, что вызывает уменьшение просвета сосуда и снижение площади поперечного сечения сосудов, отходящих от легочного ствола. В конечном итоге развивается тромбоз сосудов, облитерация артериол и образование вокруг них сети коллатералей. Механизмы, лежащие в основе развития этой формы обструктивного заболевания легочных сосудов у больных с хроническим сбросом крови слева направо, неизвестны. Единственным методом лечения синдрома Эйзенменгера с отдаленной эффективностью является пересадка легких или сердечно-легочного комплекса.
Пороки сердца без цианоза
ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
Дефект межпредсердной перегородки (ДМПП) представляет собой незаращение после рождения отверстия в межпредсердной перегородке, за счет чего сообщение между левым и правым предсердиями сохраняется. ДМПП относятся к довольно распространенным дефектам, составляя 5—10% от всех врожденных пороков сердца; у девочек этот дефект встречается в 2 раза чаще, чем у мальчиков. Дефект может затронуть любой участок межпредсердной перегородки, но чаще всего поражается ее средняя часть в области овальной ямки, такой порок называется ДМПП типа ostium secundum (рис. 16.11). Причиной этого нарушения является избыточная резорбция или неадекватное развитие первичной перегородки. Реже ДМПП развивается в области атриовентрикулярного канала, соединяющего предсердие и желудочек в эмбриональном сердце, в месте прикрепления к перегородке атриовентрикулярных клапанов (дефект типа ostium primum), или в верхней части межпредсердной перегородки вблизи устья верхней полой вены (ДМПП типа sinus venosus). Дефекты типа ostium primum часто ассоциируются с аномалиями развития митрального и трехстворчатого клапанов, тогда как ДМПП типа sinus venosus часто сопровождается нарушениями венозного оттока через легочные вены из правого легкого в правое предсердие.
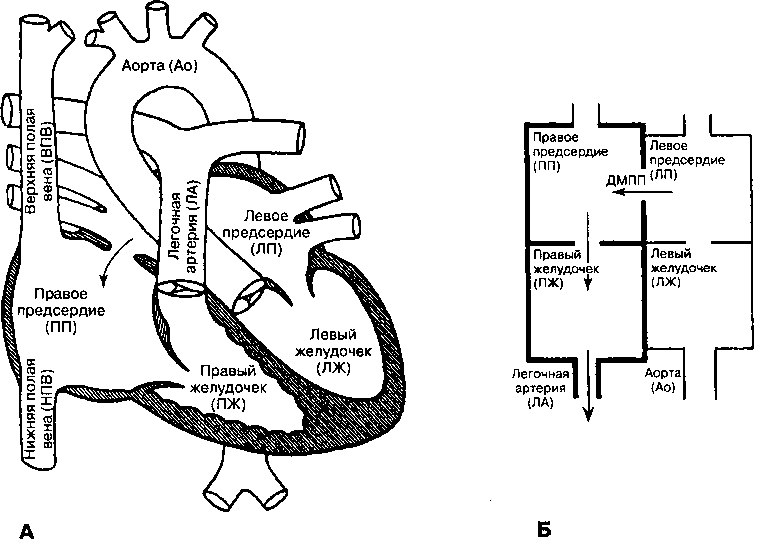
Рис. 16.11. Дефект межпредсердной перегородки (ДМПП) типа ostium secundum. А. Стрелками указан сброс крови из левого предсердия (ЛП) в правое предсердие (ПП). Б. Схематическое изображение потока крови через неосложненный ДМПП, приводящий к расширению ПП, правого желудочка и легочной артерии
Патофизиология
Дефекты межжелудочковой перегородки относятся к врожденным порокам сердца без цианоза, поскольку в неосложненных случаях насыщенная кислородом кровь из левого предсердия через шунт поступает в правое, но не наоборот. Кровоток через пораженную межпредсердную перегородку зависит от размеров незакрытого участка, способности обоих желудочков наполняться во время диастолы (диастолическое расслабление желудочков) и соотношения между сопротивлением легочных сосудов и общим периферическим сосудистым сопротивлением. В норме после рождения стенка правого желудочка (ПЖ) тоньше, а его эластичность выше, чем у левого желудочка (ЛЖ), что способствует сбросу крови слева направо. Это приводит к перегрузке объемом и расширению правых отделов сердца (рис. 16.11Б). Если эластичность правого желудочка со временем снижается (из-за повышенной нагрузки), сброс крови слева направо уменьшается. При легочной гипертензии (синдром Эйзенменгера), направление потока крови через шунт может измениться на обратное (т. е. справа налево), при этом в большой круг кровообращения попадает ненасыщенная кислородом кровь, развивается системная гипоксемия и цианоз.
Симптомы
У большинства больных детей ДМПП протекает бессимптомно. Часто это нарушение определяют по шуму в сердце уже в школьном возрасте. Если дефект крайне мал, симптомы у пациента могут вообще не появиться в течение всей жизни. К наиболее типичным симптомам, отмечаемым у взрослых людей, относится чувство сердцебиения, обусловленное предсердными аритмиями вследствие расширения правого предсердия.
Физикальное обследование
По левому краю нижней части грудины иногда пальпируется выраженный систолический толчок, возникающий при сокращении расширенного ПЖ. Второй тон сердца раздвоен (см. главу 2). За счет увеличения объема крови, нагнетаемой сердцем через легочные клапаны, возникает нарастающе-убывающий систолический шум (шум изгнания). Кроме того, по левому краю нижней части грудины может прослушиваться ме-зодиастолический шум, обусловленный увеличением кровотока через трехстворчатый клапан. При прохождении крови через сам ДМПП шум в сердце не возникает из-за отсутствия сколь-либо значимой разницы давлений между двумя предсердиями.
Методы исследования
На рентгенограмме грудной клетки сердце обычно расширено из-за гипертрофии правого предсердия и правого желудочка, увеличена дуга легочной артерии, а легочный рисунок усилен. На ЭАГ выявляется гипертрофия ПЖ, а иногда и расширение правого предсердия. Для ДМПП любого типа характерна неполная или полная блокада правой ножки пучка, обусловленная расширением ПЖ. У больных с ДМПП типа ostium primum часто отмечают отклонение электрической оси сердца влево. При эхокардиографии выявляют расширение правого предсердия и правого желудочка; ДМПП можно увидеть непосредственно, либо он диагностируется по наличию межпредсердного шунта, который обнаруживается с помощью допплер-эхокардиографии. Для уточнения диагноза иногда проводят чрез-пищеводную эхокардиографию.
Поскольку чувствительность неинвазивных методов исследования весьма высока, необходимость в проведении катетеризации сердца д ля подтверждения диагноза ДМПП возникает редко. Вместе с тем, в определенных случаях эта процедура успешно применяется для количественного определения объема сбрасываемой крови, для точной оценки тяжести легочной гипертензии или для выявления сопутствующей ишемической болезни сердца у пожилых пациентов. У здорового человека при катетеризации сердца насыщение крови кислородом в правом предсердии и в верхней полой вене примерно одинаково. При наличии ДМПП степень насыщения крови кислородом в ПП будет выше из-за сброса окисленной крови из левого предсердия в правое.
У большинства больных с ДМПП симптомы заболевания отсутствуют, и они ведут активный образ жизни. Однако если обнаруживается значительный сброс крови, рекомендуется хирургическое перекрытие дефекта с тем, чтобы предотвратить развитие легочной гипертензии во взрослом состоянии.
ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
О дефекте межжелудочковой перегородки (ДМЖП) говорят при наличии отверстия в межжелудочковой перегородке (рис. 16.12), которое может оказаться либо изолированной аномалией, либо сочетаться с другими врожденными пороками сердца. Распространенность ДМЖП в общей популяции равна 0.1%—0.2%. ДМЖП составляет 30% от всех врожденных пороков сердца. Возможен дефект в любом месте межжелудочковой перегородки, однако наиболее распространенной локализацией является мембранозная часть перегородки.
Патофизиология
Сопряженные с ДМЖП изменения гемодинамики зависят от размера дефекта и от соотношения между общим периферическим сосудистым
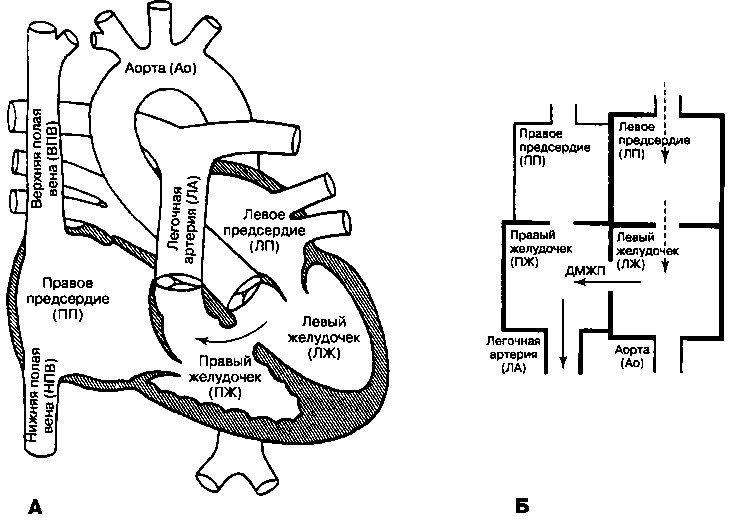
Рис. 16.12. Дефект межжелудочковой перегородки (ДМЖП). А. Стрелками указан сброс крови из левого желудочка (ЛЖ) в выносящий тракт правого желудочка (ПЖ). Б. Схематическое изображение потока крови через неосложненный ДМЖП. Пунктиром показано увеличение возврата крови в левые камеры сердца через шунт, что приводит к расширению в основном левого предсердия (ЛП) и желудочка (ЛЖ)
сопротивлением и сопротивлением легочных сосудов. Например, при небольших ДМЖП сопротивление потоку крови через отверстие оказывается выше, чем сопротивление легочных сосудов или общее периферическое сосудистое сопротивление, так что количество сбрасываемой крови во многом зависит от размера отверстия. В отличие от этого, при более крупных «неограниченных» дефектах отверстий объем сбрасываемой крови зависит от соотношения между общим периферическим сосудистым сопротивлением и сопротивлением легочных сосудов. В перинатальном периоде высокое сопротивление легочных сосудов практически равно общему периферическому сосудистому сопротивлению. Поэтому сброс крови из одного желудочка в другой минимален. Однако после рождения сопротивление легочных сосудов постепенно падает, в результате чего сброс крови слева направо через перегородку возрастает. При большом сбросе крови слева направо увеличивается кровоток через легочную артерию. В результате возврат крови в левое предсердие также увеличивается (поскольку состоит из крови, поступающей из легочных вен в норме, и крови, сброшенной слева направо), и развивается гипертрофия левого предсердия. Вначале повышенный возврат крови в левый желудочек сопровождается увеличением ударного объема ЛЖ (в соответствии с механизмом Франка-Старлинга), но со временем большой сброс крови слева направо может привести к развитию систолической дисфункции и появлению симптомов сердечной недостаточности. Кроме того, большой сброс крови слева направо может привести к развитию ранней легочной гипертензии и обструкции легочных сосудов (синдром Эйзенменгера). По мере возрастания сопротивления легочных сосудов внутрисердечный сброс крови может изменить свое направление (справа налево), что сопровождается развитием системной гипоксемии и цианозом.
Симптомы
Симптомы, связанные с ДМЖП, обусловлены размером дефекта и степенью тяжести легочной гипертензии. Небольшой порок межжелудочковой перегородки может оставаться бессимптомным. В то же время, у детей с большим ДМЖП возможно развитие застойной сердечной недостаточности, вызванной перегрузкой левых отделов сердца. У больных с ДМЖП, осложненным легочной гипертензией и обратным сбросом крови, отмечаются одышка и цианоз. Независимо от размера ДМЖП, возможно развитие бактериального эндокардита, обусловленного турбулентным потоком крови через дефект.
Физикальное обследование
Среди типичных изменений следует назвать грубый голосистолический (в течение всей систолы) шум, выслушиваемый по левому краю грудины. Чем меньше дефект перегородки, тем больше турбулентность потока крови, и тем громче шум. В зоне выслушивания шума обычно определяется систолическое дрожание. Если развивается легочная гипертензия, то голосистолический шум затихает (поскольку кровоток между желудочками становится меньше). У таких больных выслушивается громкий пульмональный компонент II тона сердца (Р2) и развивается цианоз.
Методы исследования
На рентгенограмме грудной клетки пациентов с небольшим дефектом контуры сердца выглядят нормально, но у больных с большим сбросом крови обычно наблюдают усиление легочного рисунка, расширение левого предсердия и левого желудочка, а иногда и расширение правого желудочка (если развивается легочная гипертензия). ЭАГ при небольшом дефекте может быть нормальной. Если имеет место перегрузка объемом в отсутствие легочной гипертензии, выявляется расширение левого предсердия и гипертрофия левого желудочка. При развитии легочной гипертензии выявляется и гипертрофия правого желудочка. С помощью эхокардиографии и допплеровского исследования удается четко локализовать ДМЖП и определить направление и количество сбрасываемой крови. Проведение катетеризации сердца у больных с ДМЖП со сбросом крови слева направо позволяет выявить более высокую степень насыщения крови кислородом в правом желудочке по сравнению с правым предсердием. Это обусловлено сбросом оксигенированной крови из левого желудочка в правый.
Лечение
Почти в 25% случаев небольшие или среднего размера дефекты межжелудочковой перегородки склонны к спонтанному частичному или полному зарастанию в детском возрасте. Хирургическая коррекция порока рекомендуется в первые несколько месяцев жизни детям с застойной сердечной недостаточностью и задержкой роста. Детям с легочной гипертензией хирургическое вмешательство рекомендуется в течение первого года жизни с тем, чтобы предотвратить развитие необратимых изменений легочных сосудов. Дефекты межжелудочковой перегородки среднего размера в отсутствие легочной гипертензии, но при значительной перегрузке объемом корригируют в старшем детском возрасте. Медикаментозное лечение подразумевает антибиотикопрофилактику эндокардита у всех больных с ДМЖП.
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
Артериальный проток — это кровеносный сосуд, который в период внутриутробного развития соединяет легочную артерию с нисходящей аортой. Если артериальный проток после рождения ребенка не перекрывается, возникает дефект, называемый открытым артериальным протоком (ОАП), за счет которого сохраняется постоянное сообщение между магистральными сосудами (рис. 16.13). Этот порок может иметь место как самостоятельный дефект, а может сочетаться с другими более сложными нарушениями. Он составляет 6% всех врожденных пороков сердца, у мальчиков он встречается в 3 раза чаще, чем у девочек. Риск развития этого порока выше у недоношенных детей с весом менее 1500 г.
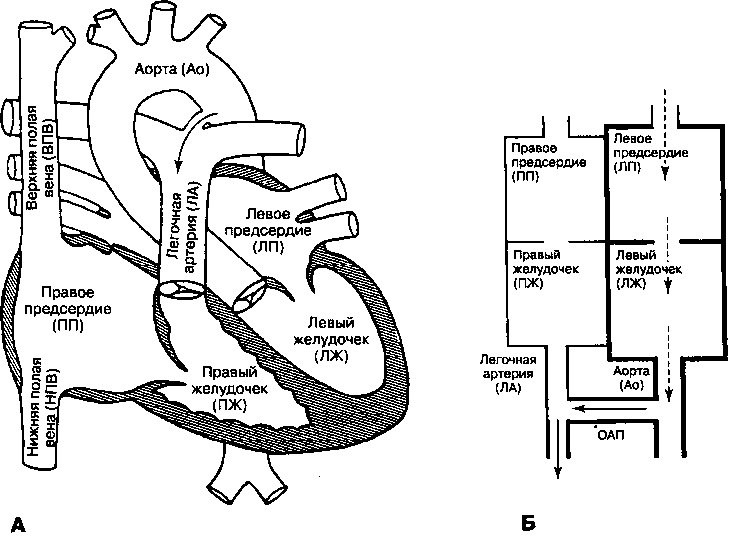
Рис. 16.13. Открытый артериальный проток (ОАП). А. Стрелками указан сброс крови из нисходящей аорты (Ао) в легочную артерию (ЛА) Б. Схематическое изображение потока крови через неосложненный ОАП. Пунктиром показан увеличенный возврат крови в левые отделы сердца через шунт, сопровождающийся расширением левого предсердия (ЛП), левого желудочка (ЛЖ) и аорты
Патофизиология
В норме после рождения артериальный проток сжимается благодаря резкому увеличению напряжения кислорода в крови и снижению в ней уровня простагландинов, обладающих сосудорасширяющим действием. В течение нескольких последующих недель за счет пролиферации интимы и фиброза этот эмбриональный кровеносный сосуд зарастает. Если же проток не закрывается, между восходящей аортой и легочной артерией возникает постоянный шунт, при этом количество сбрасываемой крови зависит от размера незакрывшегося протока и соотношения между общим периферическим сосудистым сопротивлением и сопротивлением легочных сосудов. До рождения ребенка, когда сопротивление легочных сосудов велико, кровь в обход незрелых легких попадает в аорту. Поскольку сопротивление легочных сосудов после рождения падает, направление сброса крови меняется, и кровь теперь поступает из аорты в легочную артерию. Появление такого сброса крови слева направо приводит к перегрузке объемом левого предсердия и левого желудочка (кровь, поступающая через шунт, плюс нормальный венозный возврат из легких), вследствие чего развивается недостаточность левого желудочка. Кроме того, увеличение потока крови через легкие приводит, в конце концов, к развитию легочной гипертензии и синдрома Эйзенменгера, сопровождающихся изменением направления сброса крови таким образом, что кровь из легочной артерии через проток попадает в нисходящую аорту. Поступление ненасыщенной кислородом крови к нижним конечностям вызывает развитие цианоза стоп; цианоз рук отсутствует, поскольку к ним продолжает поступать кровь из проксимальных отделов аорты, достаточно насыщенная кислородом.
Симптомы
У детей с небольшими размером артериального протока симптомов обычно не наблюдается. У детей же с большим сбросом крови слева направо постепенно развиваются симптомы застойной сердечной недостаточности, в том числе, тахипноэ, тахикардия, плохой аппетит и замедленный рост.
Физикальное обследование
Типичным симптомом у больных со сбросом крови слева направо через ОАП является непрерывный шум в сердце, лучше всего выслушиваемый по левому краю верхней части грудины (см. рис. 2.10). Шум слышен в течение всего сердечного цикла, что обусловлено наличием разности давлений — более высокого в аорте и более низкого в легочной артерии — как во время систолы, так и во время диастолы. В то же время, если развивается легочная гипертензия, разность давлений между аортой и легочной артерией уменьшается, что сопровождается снижением потока крови через проток, поэтому шум становится короче (за счет исчезновения диастолического компонента) и мягче.
Методы исследования
Если диаметр артериального протока невелик, изменения на рентгенограмме грудной клетки отсутствуют. Если же диаметр протока велик, контуры сердца расширены (гипертрофия левого предсердия и левого желудочка), а легочный рисунок усилен. У взрослых иногда наблюдается кальцификация открытого протока. Если имеет место большой сброс крови, то на ЭАГ выявляются расширение левого предсердия и гипертрофия левого желудочка. Эхокардиография позволяет увидеть ОАП; кровоток через проток обычно легко наблюдать с помощью допплерографии. Катетеризацию сердца в диагностических целях обычно не проводят. Если же эту процедуру проводят больным со сбросом крови слева направо, можно наблюдать резкий скачок в насыщении крови кислородом в легочной артерии по сравнению с правым желудочком; ангиография позволяет увидеть поступление контрастного вещества через открытый артериальный проток из аорты в легочную артерию.
Лечение
В отсутствие других врожденных пороков сердца или тяжелого заболевания легочных сосудов открытый артериальный проток устраняют хирургическим путем: рассечением или перевязкой аномального соединения. Многообещающими представляются экспериментальные методы катетерного закрытия малых и средних дефектов.
ВРОЖДЕННЫЙ СТЕНОЗ УСТЬЯ АОРТЫ
Врожденный стеноз устья аорты (СУА) представляет собой сужение устья аорты вследствие нарушения развития клапана (рис. 16.14). Аномальный клапан обычно представляет собой одностворчатое или двустворчатое образование, вместо нормального трехстворчатого. На стеноз устья аорты приходится 6% всех врожденных пороков сердца, среди мальчиков он встречается в четыре раза чаще, чем среди девочек.
Патофизиология
Поскольку закрываемое клапаном отверстие сужено, для изгнания крови через клапан в аорту давление в левом желудочке должно возрасти.
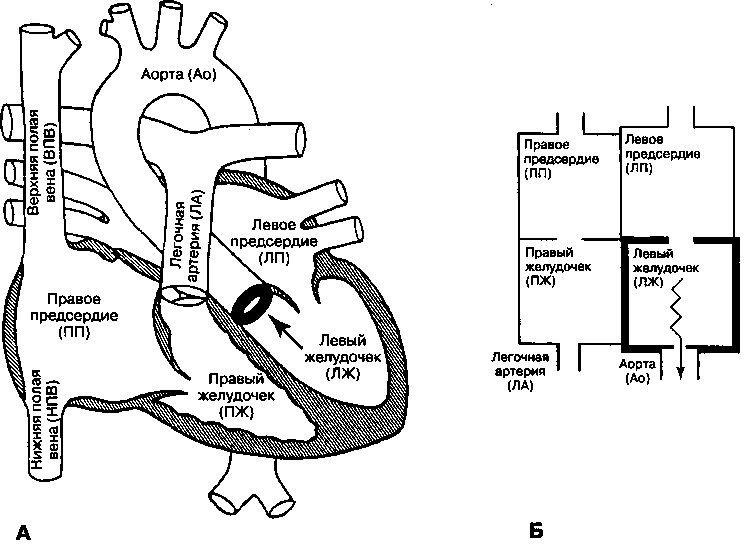
Рис. 16.14. А. Врожденный стеноз клапана аорты (стрелка). Б. Схематическое изображение кровотока через суженный клапан аорты (зигзагообразная стрелка). Гипертрофия левого желудочка (ЛЖ) обусловлена хронической перегрузкой давлением. Типичной является дилатация аорты (Ао) дистальнее стенозированного участка
Следствием этого становится гипертрофия левого желудочка. Кроме того, поток крови, выбрасываемой под высоким давлением через стенозированный клапан, оказывает постоянное воздействие на стенку проксимальных отделов аорты, вызывая ее дилатацию.
Симптомы
Клиническая картина стеноза устья аорты зависит от тяжести поражения. У большинства детей с врожденным стенозом устья аорты заболевание протекает бессимптомно, развитие не нарушено. Симптомы порока обычно включают быструю утомляемость, одышку при физической нагрузке, стенокардию и обмороки, как при аортальном стенозе у взрослых (см. главу 8). В то же время, у детей с выраженным стенозом клапана аорты может развиться застойная сердечная недостаточность с тахикардией и одышкой.
Физикальное обследование
При аускультации сердца у больных с врожденным стенозом устья аорты обнаруживают систолический шум изгнания — наиболее громкий у основания сердца и иррадиирующий в шею. Появлению такого шума часто предшествует систолический тон изгнания, особенно при слабо выраженном стенозе (см. главу 2). В более тяжелых случаях шум сопровождается систолическим дрожанием при пальпации, а длительность шума в период изгнания становится больше. При выраженном аортальном стенозе увеличение периода изгнания приводит к задержке закрытия клапана аорты; в отличие от нормального состояния, при данной патологии аортальный клапан закрывается после легочного клапана. Этот феномен называется обратным расщеплением второго тона (S2) (см. главу 2).
Методы исследования
На рентгенограмме грудной клетки новорожденного с СУА можно выявить расширение левого желудочка и восходящей аорты. На ЭКГ часто обнаруживают признаки гипертрофии левого желудочка. Эхокардиография позволяет оценить строение клапана аорты и степень гипертрофии левого желудочка; допплерография дает возможность точно определить величину разности давлений между левым желудочком и аортой и размеры клапанного отверстия. С помощью катетеризации сердца удается зарегистрировать увеличение систолического давления в левом желудочке и снижение систолического давления в аорте, а также измерить разность давлений по разные стороны аортального клапана.
Лечение
Легкие формы стеноза устья аорты лечения не требуют, однако следует проводить профилактику эндокардита (см. главу 8). При выраженной врожденной патологии клапана ребенку необходима баллонная (через катетер) или хирургическая вальвулопластика. Если такой подход не помогает, проводят хирургическую операцию протезирования клапана аорты.
СТЕНОЗ ЛЕГОЧНОГО СТВОЛА
Изолированный стеноз легочного ствола (рис. 16.15) считается вторым по распространенности врожденным пороком сердца. Стеноз может развиваться на уровне клапана (например, при врожденных спайках створок клапана), внутри правого желудочка (за счет мышечной обструкции выносящего тракта) или в легочной артерии в результате ее гипоплазии. Наиболее частой встречающейся формой является стеноз клапана, составляющий более 90% всех поражений.
Патофизиология
Стеноз легочного ствола приводит к тому, что на пути крови, выбрасываемой из правого желудочка во время систолы, возникает сужение, за счет которого увеличивается давление в правом желудочке и развивается его гипертрофия. При стенозе клапана легочного ствола кровь проталкивается через суженный клапан при повышенном давлении; передача этого давления на стенку легочной артерии вызывает ее расширение. Клиническое течение заболевания зависит от степени обструкции. При нормальном сердечном выбросе легкой формой легочного стеноза считается состояние, когда максимальный систолический трансклапанный градиент давления < 50 мм рт ст, умеренный стеноз соответствует давления в 50—80 мм рт ст, а выраженный — градиенту давления > 80 мм рт ст.
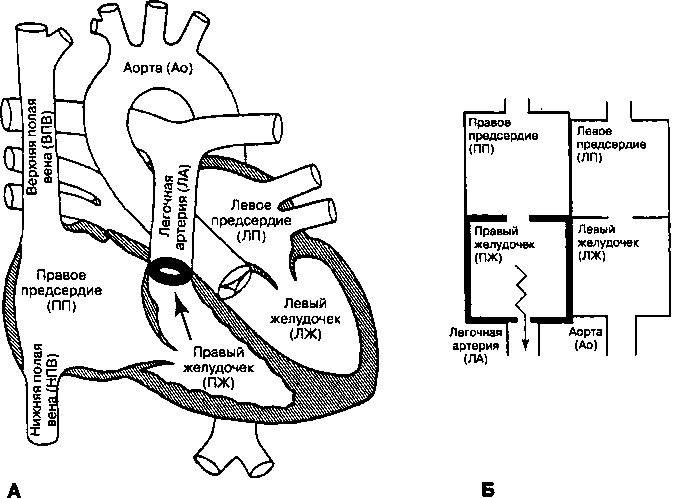
Рис. 16.15. А. Врожденный стеноз легочного ствола (стрелка). Б. Схематическое изображение кровотока через суженный клапан легочного ствола (зигзагообразная стрелка). Гипертрофия правого желудочка (ПЖ) обусловлена хронической перегрузкой давлением
Симптомы
Симптомы заболевания у детей с легкой и умеренной формами стеноза легочного ствола обычно отсутствуют. Впервые порок у таких детей часто диагностируется при выслушивании систолического шума изгнания во время обычного обследования. Выраженный стеноз сопровождается одышкой при нагрузке, снижением толерантности к физической нагрузке и застойной сердечной недостаточностью.
Физикальное обследование
Физикальные характеристики больного при стенозе легочного ствола определяются тяжестью обструкции. Если стеноз выраженный, по левому краю верхней части грудины выслушивается громкий шум крещендо-декрещендо, который начинается вместе с первым тоном сердца и может скрывать аортальный компонент второго тона сердца. Над зоной выслушивания шума часто определяется дрожание. Расщепление второго тона сердца обусловлено задержкой закрытия клапана легочного ствола.
При менее выраженном стенозе за первым тоном сердца следует тон изгнания (высокочастотный звук, ассоциирующийся с открытием клапана), который предшествует нарастающе-убывающему систолическому шуму. Этот шум может прекратиться перед более мягким, чем обычно, легочным компонентом второго тона сердца.
Методы исследования
При стенозе легочного ствола на рентгенограмме грудной клетки видно расширение правого желудочка и дилатация легочной артерии дистальнее стенозированного участка. На ЭКГ выявляются признаки гипертрофии правого желудочка, которая пропорциональна степени стеноза и обычно сопровождается отклонением электрической оси сердца вправо. При выраженном стенозе обычно видно расширение правого предсердия. Для определения морфологии клапана легочного ствола, а также для локализации и измерения разности давлений по разные стороны стенозированного клапана применяют эхокардиографию и допплерографию.
Лечение
Незначительный стеноз легочного ствола обычно не прогрессирует и не требует лечения. Умеренное или выраженное сужение в большинстве случаев корригируют путем расширения стенозированного клапана с помощью транскатетерной баллонной вальвулопластики. При подклапанном или надклапанном стенозе легочного ствола требуется хирургическая операция на открытом сердце. После такого лечения гипертрофия правого желудочка, сопряженная с эти пороком, обычно регрессирует.
КОАРКТАЦИЯ А ОРТЫ
Коарктация аорты — это патологическое сужение ее просвета, которое может возникнуть в любом месте по всей ее длине. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). Распространенность этой аномалии составляет 1 случай на 6000 новорожденных; у мальчиков она встречается в два раза чаще, чем у девочек. В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предпроточную и послепроточную (рис. 16.16). Предпроточная коарктация, при которой сужение аорты локализовано проксимальнее протока, возникает при аномальном развитии сердца в период внутриутробной жизни, обусловливающем снижение кровотока через левые отделы сердца и перешеек аорты; в результате развивается гипоплазия аорты. Послепроточная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани протока в аорту плода; когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая как тампоном просвет сосуда по всей его окружности. В отличие от «предпроточной» коарктации в данном случае гипоплазия аорты не развивается. Для обоих типов коарктации характерно нормальное кровоснабжение головы и верхних конечностей и снижение потока крови в нисходящую аорту и нижние конечности. Вместе с тем, клиническая картина при коарктации аорты каждого из двух типов различна.
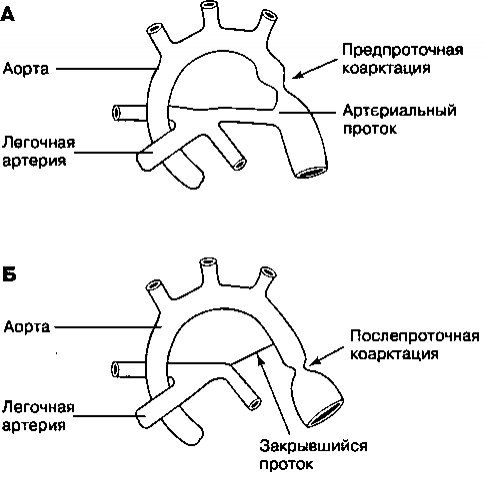
Рис. 16.16. Коарктация аорты. А. Предпроточная коарктация. Б. Послепроточная коарктация
Предпроточная коарктация аорты
Гипоплазия аорты в период внутриутробного развития не проявляется, поскольку кровь через открытый артериальный проток минует суженный участок. Лишь после рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям. Сужение аорты сопровождается увеличением постнагрузки на левый желудочек и снижением кровотока в нисходящей аорте и нижней половине тела.
У больных с предпроточной коарктацией аорты вскоре после рождения обычно развивается застойная сердечная недостаточность (одышка, тахипное и тахикардия) и появляются признаки сниженного сердечного выброса (холодные конечности, пятнистость кожи). Если артериальный проток остается открытым, у таких детей, развивается дифференциальный цианоз. При этом верхняя половина тела снабжается окисленной кровью, которая поступает сюда из левого желудочка и восходящей аорты, тогда как нижняя половина тела становится цианотичной, поскольку сюда доставляется плохо насыщенная кислородом кровь, которая сбрасывается справа налево из легочной артерии через все еще открытый артериальный проток в нисходящую аорту. На верхних конечностях, кровоснабжение которых осуществляется посредством артерий, ответвляющихся от аорты проксимальнее места сужения, часто обнаруживают повышенное артериальное давление; в то же время в нижних конечностях, кровь к которым доставляется артериями, отходящими от аорты дистальнее места сужения, давление снижено.
На рентгенограмме грудной клетки обнаруживают кардиомегалию и застой в легких. С помощью эхокардиографии удается оценить выраженность коарктации аорты и наличие сопутствующих врожденных пороков сердца.
Лечение предпроточной коарктации начинают с применения простагландина Et с целью сохранения проходимости протока и увеличения, тем самым, перфузии нижней половины тела; за этим следует хирургическое лечение.
Послепроточная коарктация аорты
Выраженная послепроточная коарктация аорты сопровождается увеличением постнагрузки на левый желудочек, что может повлечь за собой развитие застойной сердечной недостаточности. При менее выраженной коарктации аорты постепенно развиваются компенсаторные изменения, которые несколько нивелируют сужение аорты. К таким изменениям относятся: 1) развитие гипертрофии левого желудочка в ответ на увеличение постнагрузки и 2) компенсаторное образование из межреберной артерии и внутренней грудной артерии сосудистых коллатералей, за счет которых осуществляется кровоснабжение нижней половины тела. Если коарктация аорты не устранена в детском возрасте, эти коллатерали становятся очень крупными и вызывают узурацию ребер.
Возможно два варианта клинических проявлений послепроточной коарктации аорты. У большинства новорожденных сужение выражено не очень сильно, поэтому эти дети растут и развиваются нормально. В то же время у некоторых новорожденных с выраженной послепроточной коарктацией аорты развивается застойная сердечная недостаточность, которая обусловлена перегрузкой левого желудочка давлением. В первые недели жизни у таких детей появляются тахипное, одышка, тахикардия и гепатомегалия.
При физикальном исследовании часто выявляют артериальную гипертензию в верхней части тела (при измерении артериального давления на правой руке), и существенно сниженное давление дистальнее места коарктации. Иными словами, если коарктация находится дистальнее отхождения левой подключичной артерии, систолическое давление в руках выше, чем в ногах. Если же коарктация находится проксимальнее отхождения левой подключичной артерии, систолическое артериальное давление в правой руке может превышать давление в левой руке. Если разница в уровне систолического артериального давления между правой рукой и ногой равна 15—20 мм рт ст, подозревают коарктацию аорты. Разница в уровне давления свыше 40 мм рт ст наблюдается весьма редко. На груди и/или спине выслушивается мезосистолический шум изгнания (обусловленный турбулентностью потока крови через суженную аорту). Непрерывный шум над всей грудной клеткой обусловлен усиленным кровотоком через расширенные извилистые артериальные коллатерали.
На рентгенограмме грудной клетки компенсаторные сосуды, давящие на нижнюю поверхность ребер, вызывают появление их зазубренности, однако у детей младше 5 лет такую картину наблюдают редко. На рентгенограмме в месте коарктации аорты можно также видеть зазубрины. На ЭКГ у больных с неосложненной коарктацией аорты выявляется гипертрофия левого желудочка, обусловленная перегрузкой давлением. Диагноз послепроточной коарктации аорты подтверждается с помощью эхокардиографии', этот же метод позволяет оценить разность давлений в аорте до и после поврежденного участка. С помощью магнитно-резонансной томографии удается получить детальное изображение аорты с оценкой протяженности и тяжести коарктации. Необходимость в катетеризации и ангиографии для установления диагноза возникает довольно редко.
При выраженной послепроточной коарктации с целью расширения стенозированного сегмента аорты проводят транскатетерную баллонную дилатацию или хирургическую операцию. Поскольку даже умеренно выраженная коарктация аорты может стать причиной артериальной гипертензии, расслоения аорты и эндокардита, необходимую реконструкцию аорты обычно рекомендуется проводить в детском возрасте.
Цианотические пороки сердца
ТЕТРАДА ФАЛЛО
Тетрада Фалло представляет собой комплекс врожденных пороков сердца, причиной которых служит один и тот же дефект: аномальное смещение инфундибулярной части перегородки вперед вверх и вправо; в результате происходит неравномерное разделение луковицы сердца и аортальных выносящих трактов. Следствием такого неравномерного разделения оказываются четыре аномалии развития (рис. 16.17). Это 1) дефект межжелудочковой перегородки, вызванный ее смещением, 2) подклапанный стеноз легочного ствола, обусловленный обструкцией оттока крови инфундибулярной частью перегородки, 3) смещение (декстрапозиция) аорты («верхом сидящая» на межжелудочковой перегородке аорта), в которую кровь теперь попадает из обоих желудочков, и 4) гипертрофия правого желудочка, обусловленная перегрузкой давлением вследствие стеноза легочного ствола. Тетрада Фалло считается наиболее распространенным врожденным пороком сердца с цианозом у детей старше 1 года.
Патофизиология
Повышение сосудистого сопротивления, связанное со стенозом легочного ствола, приводит к тому, что обедненная кислородом венозная
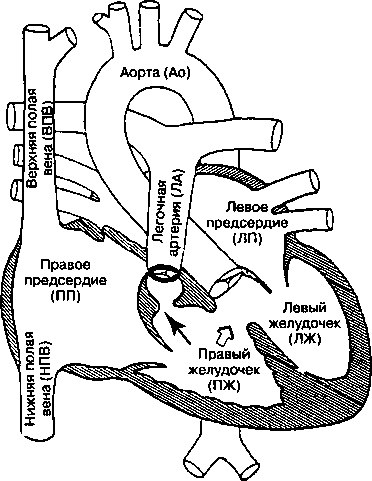
Рис. 16.17. Тетрада Фалло характеризуется наличием четырех взаимосвязанных дефектов: 1) дефект межжелудочковой перегородки (белая стрелка); 2) обструкция выносящего тракта правого желудочка (черная стрелка); 3) смещение аорты, за счет чего кровь в нее поступает из обоих желудочков, и 4) гипертрофия правого желудочка
кровь минует правый желудочек и через ДМЖП попадает в сместившуюся аорту и затем в большой круг кровообращения; в результате развиваются системная гипоксемия и цианоз. Степень сброса крови справа налево через ДМЖП зависит от тяжести стеноза легочной артерии и от соотношения общего периферического сосудистого сопротивления и сопротивления легочных сосудов.
. Симптомы
У детей с тетрадой Фалло часто отмечают одышку при нагрузке или при плаче. Кроме того, после физической нагрузки или кормления могут появляться «приступы», для которых характерны возбудимость, цианоз, гипервентиляция легких, иногда обмороки и судороги, вызванные гипоксемией мозга. С раннего возраста дети научаются облегчать симптомы своего заболевания путем приседания на корточки; при этом общее периферическое сосудистое сопротивление возрастает, а сброс крови справа налево уменьшается, что сопровождается увеличением количества крови, протекающей через легкие.
Физикальное обследование
У детей с умеренным стенозом легочного ствола цианоз обычно выражен незначительно. При тяжелой форме стеноза цианоз выражен довольно сильно уже в первые дни жизни. Хроническая гипоксемия, обусловленная сбросом крови справа налево, обычно становится причиной утолщения концевых фаланг пальцев. Характерная для тетрады Фалло гипертрофия правого желудочка проявляется отчетливым сердечным толчком вдоль левого края грудины. Систолический шум изгнания, который лучше всего выслушивается по левому краю верхней части грудины, обусловлен турбулентным потоком крови через стенозированный выносящий тракт правого желудочка и иногда сопровождается пальпируемым дрожанием. Второй тон сердца нерасщепленный и громкий, состоит из нормального аортального компонента; легочный компонент мягкий и обычно неслышный.
Методы исследования
Рентгенограмма грудной клетки демонстрирует увеличение правого желудочка и уменьшение размеров основного сегмента легочной артерии, за счет чего сердце выглядит в виде «башмака». Сосудистый рисунок легких ослаблен. На ЭАГвидны признаки гипертрофии правого желудочка и отклонение электрической оси сердца вправо. Эхокардиография позволяет обнаружить и количественно оценить степень обструкции выносящего тракта ПЖ, а также выявить дефект смещения межжелудочковой перегородки. С помощью катетеризации сердца в сочетании с ангиографией правого желудочка удается изучить морфологию выносящего тракта ПЖ и оценить размеры основных ветвей легочной артерии.
Лечение
Однозначным подходом к лечению тетрады Фалло является хирургическая коррекция порока, которая заключается в закрытии дефекта межжелудочковой перегородки и расширении подпульмонального инфундибулярного отдела с помощью перикардиальной заплатки. В большинстве случаев у больных, перенесших успешную хирургическую операцию, в зрелом возрасте симптомы заболевания отсутствуют.
ТРАНСПОЗИЦИЯ МАГИСТРАЛЬНЫХ АРТЕРИЙ
Транспозиция магистральных артерий (ТМА) возникает при неправильном — обратном — отхождении магистральных сосудов из желудочков; иными словами, аорта выходит из правого желудочка, а легочная артерия из левого (рис. 16.18). На долю этого нарушения приходится 7% всех врожденных пороков сердца; этот дефект может быть изолированным или сочетаться с другими врожденными аномалиями, например, с ДМЖП или открытым артериальным протоком.
Точные причины транспозиции сосудов остаются неясными. Изначально полагали, что она является результатом неправильного изгиба аортально-пульмональной перегородки во время эмбрионального развития. Недавно было высказано предположение, что этот дефект является следствием аномального роста субпульмонального и субаортального конуса в
Рис. 16.18. Транспозиция магистральных артерий. Аномальное развитие аорты (Ао) и легочной артерии (ЛА), выходящих, соответственно, из правого (ПЖ) и левого желудочков (ЛЖ)
процессе разветвления артериального ствола. В норме при резорбции субаортальной инфундибулярной перегородки формирующийся аортальный клапан располагается сзади и книзу от клапана легочной артерии и фактически является продолжением левого желудочка. При ТМА процесс резорбции инфундибулярной перегородки, по-видимому, извращен, в результате чего клапан легочной артерии располагается над левым желудочком, а клапан аорты — над правым.
Патофизиология
При транспозиции магистральных артерий малый и большой круги кровообращения разделены таким образом, что движение крови в них оказывается не последовательным, а параллельным. В силу такого нарушения обедненная кислородом венозная кровь, притекающая из всех тканей организма, попадает в правый желудочек, а затем через аорту возвращается в большой круг кровообращения, не насыщаясь кислородом в легких. Аналогичным образом окисленная в легких венозная кровь попадает в левый желудочек и через легочную артерию возвращается обратно в легкие, не доставив кислород к органам и тканям. В конечном итоге у новорожденного развивается тяжелая гипоксия и цианоз. Если не провести вмешательство с целью соединения двух кругов кровообращения, транспозиция магистральных артерий приводит к летальному исходу.
ТМА совместима с внутриутробной жизнью, поскольку доставка кислорода к периферическим тканям обеспечивается кровотоком через артериальный проток и овальное отверстие. У плода окисленная кровь из плаценты через пупочную вену поступает в правое предсердие, откуда ее большая часть через овальное отверстие попадает в левое предсердие. Отсюда богатая кислородом кровь попадает в левый желудочек и изгоняется в легочную артерию. Из легочной артерии большая часть крови вместо того, чтобы попасть в легочные сосуды с высоким сопротивлением, по артериальному протоку поступает в аорту, после чего формирующиеся ткани получают кислород.
Но в условиях транспозиции магистральных артерий физиологическое закрытие артериального протока и овального отверстия приводит к тяжелому ацидозу и смерти, поскольку оксигенированная кровь не достигает периферических тканей ни по одному (нормальному или фетальному) из возможных путей доставки оксигенированной крови.
Если же артериальный проток и овальное отверстие остаются открытыми — сами по себе или в результате терапии простагландинами и хирургического вмешательства — сообщение между параллельными потоками крови сохраняется и оказывается достаточным для обеспечения насыщенной кислородом кровью мозга и других тканей.
Симптомы заболевания и физикальное обследование
Новорожденные, страдающие транспозицией магистральных артерий, выглядят синюшными, интенсивность цианоза у них зависит от степени смешения крови из параллельно идущих кругов кровообращения. В первый день жизни развивается генерализованный цианоз, который по мере закрытия артериального протока быстро прогрессирует. При аускультации выслушивается усиленный второй тон сердца, который отражает закрытие аортального клапана, расположенного спереди под грудиной. Явные шумы редки и свидетельствуют о наличии сопряженного порока.
Методы исследования
Отклонения на рентгенограмме грудной клетки обычно отсутствуют, хотя основание сердца может быть сужено за счет расположения аорты и легочной артерии друг за другом. На ЭКГ выявляются признаки гипертрофии правого желудочка, свидетельствующей о том, что именно ПЖ выполняет насосную функцию. Для уточнения диагноза транспозиции проводят эхокардиографию, которая позволяет обнаружить аномальное расположение магистральных сосудов.
Лечение
Транспозиция магистральных артерий представляет собой критическое состояние. Первоначальное лечение состоит в поддержании артериального протока в открытом состоянии с помощью введения простагландинов, а также в создании сообщения между предсердиями (с помощью баллонного катетера). Эти меры позволяют добиться смешивания крови из обоих кругов кровообращения до тех пор, пока не будет проведена радикальная хирургическая операция.
ЗАКЛЮЧЕНИЕ
1. Значение врожденных пороков сердца можно предвидеть из знания эмбрионального пути развития сердечно-сосудистой системы и необходимости перехода к постнатальной системе кровообращения.
2. Врожденные дефекты сердца и сосудов встречаются у 0.8% детей. Пороки сердца группируют в цианотические и без цианоза в зависимости от того, приводит ли нарушение к сбросу крови справа налево.
3. Пороки без цианоза часто сопровождаются перегрузкой объемом (дефект межпредсердной перегородки, дефект межжелудочковой перегородки, открытый артериальный проток) или давлением (стеноз аорты, стеноз легочного ствола, коарктация аорты). Хроническая перегрузка объемом, обусловленная большим сбросом крови слева направо, в конечном итоге приводит к легочной гипертензии и изменению направления сброса крови шунта (синдром Эйзенменгера).
4. К наиболее типичным цианотическим порокам относятся тетрада Фалло и транспозиция магистральных артерий.