Артериальная гипертензия
Более 50 миллионов американцев имеют артериальную гипертензию (АГ) — опасное для здоровья повышение артериального давления (АД). По существующим оценкам, АГ и ее осложнения являются причиной смерти 800000 больных в год, большинства случаев нелетальных инфарктов миокарда, мозговых инсультов, поражений сетчатки глаза и почек. Как правило, вплоть до развития острых сердечно-сосудистых осложнений повышение АД не сопровождается явными клиническими симптомами, поэтому своевременное выявление АГ является одной из наиболее важных задач профилактической медицины.
Кроме того, АГ — это сложная научная проблема: почти у 95% больных причины повышения АД остаются невыясненными, и такое нарушение классифицируется как первичная или эссенциальная артериальная гипертензия (ЭАГ). Полагают, что в основе развития ЭАГ лежат многочисленные патогенетические факторы, для понимания которых необходимо изучить нормальные физиологические механизмы регуляции АД, которые описаны в этой главе.
При АГ, причины которой четко установлены, говорят о вторичной (или симптоматической) артериальной гипертензии (ВАГ). ВАГ встречается значительно реже, чем ЭАГ, однако установление причин ВАГ нередко позволяет полностью излечить больных от повышенного давления. В этой главе подробно обсуждаются патофизиологические механизмы развития эссенциальной и вторичной артериальной гипертензии, клинические последствия повышения АД, а также основные принципы лечения больных АГ.
ЧТО ТАКОЕ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ?
Уровень АД в популяции варьирует в широких пределах. Распределение диастолического АД (ДАД) в популяции соответствует классической гауссовской кривой (рис. 13.1); с возрастом уровень как систолического АД (САД), так и ДАД повышается (рис. 13.2). Риск осложнений АГ возрастает пропорционально повышению уровня АД, поэтому критерии диагностики этого заболевания являются в известной мере условными (современные диагностические критерии АГ представлены в таблице 13.1). В соответствии с этими критериями диагноз АГ устанавливают при ДАД и/или САД, равном или превышающем 90 и 140 мм рт. ст., соответственно. Лица с «высоким нормальным» АД относятся к группе риска развития АГ и должны находиться под динамическим наблюдением врача. Перечисленные в таблице 13.1 критерии АГ основаны на результатах клинических исследований, в которых анализировалась частота сердечно-сосудистых осложнений в зависимости от величины АД. Необходимо отметить, что хотя основным критерием АГ ранее считался уровень диастолического АД, по современным данным, систолическое АД также имеет важное значение для развития осложнений этого заболевания.
Рис. 13.1. Распределение диастолического артериального давления в возрастной группе 30—69 лет (п= 158906). Артериальная гипертензия диагностировалась при уровне диастолического АД > 90 мм рт. ст. (Перепечатано с изменениями из Hypertension Detection and Follow-up Program. A progress report. Circ res 1977;40(Suppl 1): 106)
КАК РЕГУЛИРУЕТСЯ УРОВЕНЬ АД?
Артериальное давление связано с величиной сердечного выброса (СВ) и общим периферическим сосудистым сопротивлением (ОПСС) следующей формулой:
АД = СВ х ОПСС.
В свою очередь, СВ зависит от ударного объема (УО) левого желудочка и частоты сердечных сокращений (ЧСС):
СВ = УО х ЧСС, где величина УО определяется, в основном, сократимостью миокарда и венозным возвратом (т. е. преднагрузкой левого желудочка, глава 9).
Очевидно, что в регуляции АД участвуют как минимум три системы: сердце, выполняющее насосную функцию, кровеносные сосуды, тонус которых определяет величину ОПСС, и почки, регулирующие объем циркулирующей крови. На рисунке 13.3 показано, как активность этих трех систем влияет на величину УО и ОПСС.
Регуляция уровня АД почками заслуживает отдельного рассмотрения, особенно в свете устоявшегося мнения о том, что АГ является «сердечно-сосудистым» заболеванием. Вместе с тем, уменьшая объем циркулирующей крови, почки способны нормализовать уровень АД при любом повышении СВ и любом увеличении сопротивления периферических сосудов. Следовательно, формирование стойкой АГ всегда связано с нарушением функции почек (хотя патогенетические факторы АГ могут находиться вне почечной паренхимы). Например, повышение АД может быть связано с недостаточным кровоснабжением почек вследствие снижения кровотока в почечной артерии или нарушения секреции гормонов, увеличивающих задержку натрия в проксимальных канальцах (см. далее).
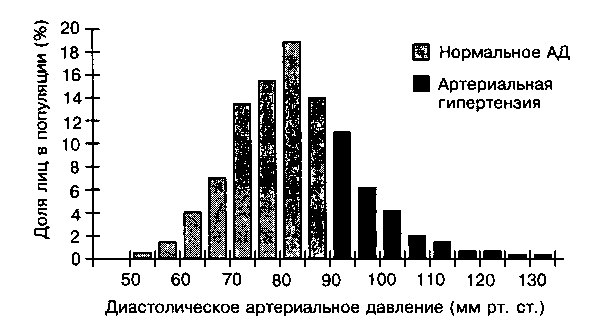
Таблица 13.1. Классификация артериальной гипертензии у взрослых по уровню артериального давления
Категория |
Систолическое АД (мм рт. ст.) |
Диастолическое АД (мм рт. ст.) |
Нормальное |
< 130 |
< 85 |
Высокое нормальное |
130-139 |
85-89 |
Артериальная гипертензияа |
||
1 ст. (Легкая) |
140-159 |
90-99 |
2 ст. (Умеренная) |
160-179 |
100-109 |
3 ст. (Тяжелая) |
180-209 |
110-119 |
4 ст. (Крайне тяжелая) |
й: 210 |
> 120 |
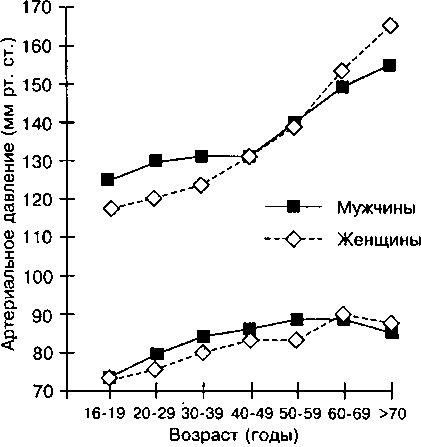
Рис. 13.2. Связь артериального давления с возрастом (п=1029). Показан уровень систолического (верхняя кривая) и диастолического (нижняя кривая) артериального давления. У женщин в возрасте 60 лет среднее систолическое АД выше, чем у мужчин. (Перепечатано с изменениями из Kotchen JM, McKean НЕ, Kotchen ТА. Blood pressure trends with aging. Hypertension 1982;4(Suppl 3):111-129.)
ЭССЕНЦИАЛЬНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
В 95% случаев причины повышения АД выявить не удается, и больным этой категории устанавливают диагноз эссенциальной АГ. Диагностика ЭАГ основана на методе исключения, то есть диагноз ставится после исключения всех возможных причин развития вторичной АГ (см. далее).
Эссенциальная АГ не столько диагноз, сколько описание, свидетельствующее лишь о том, что по неизвестным причинам у данного больного повышен уровень АД. По всей вероятности, в основе АГ у больных разных групп лежат разные патогенетические механизмы. Поскольку истинная природа нарушений при ЭАГ неизвестна, для объяснения патогенеза этого заболевания необходимо понять, какие изменения нормальных физиологических механизмов могут приводить к стойкому повышению АД.
Материалы этой главы отражают современные представления о тяжести, эпидемиологии, генетике, экспериментальных данных и клинической картине ЭАГ. Анализ представленных данных свидетельствует о том, что в основе ЭАГ лежат множественные нарушения регуляции АД, нередко сочетающиеся и взаимодействующие с внешними стрессовыми факторами. Нарушения регуляции АД могут быть как приобретенными, так и генетически детерминированными, проявляясь независимо друг от друга. Как следствие, у больных ЭАГ наблюдается сочетание нескольких нарушений регуляции АД, причем патофизиология повышения АД в каждом случае различна.
Степень тяжести ЭАГ
Примерно у 80% больных диагностируют ЭАГ I степени; умеренное или выраженное повышение АД наблюдается только у 10% больных. Хотя риск сердечно-сосудистых осложнений увеличивается пропорционально повышению АД, именно большое количество больных артериальной гипертензией I—II степени обусловливает высокий уровень заболеваемости и смертности от этого заболевания в популяции.
Эпидемиология
Полагают, что в патогенезе ЭАГ важную роль играют наследственные факторы, однако генетические маркеры этого заболевания пока не выявлены. Частота АГ у родственников больных первой степени родства достоверно выше, чем в общей популяции. Среди однояйцовых близнецов отмечается неполная конкордантность по этому заболеванию, однако она достоверно выше, чем среди двуяйцовых близнецов. Существуют данные о том, что развитие ЭАГ может быть связано с генетически детерминированными нарушениями экскреции натрия почками, транспорта ионов натрия через клеточную мембрану или повышенной реактивностью вегетативной нервной системы. Следует отметить, что у ближайших родственников больных АГ, которые имеют нормальное АД, нередко выявляют такие физиологические нарушения, которые в сочетании с другими провоцирующими факторами могут приводить к развитию АГ (например, нарушения регуляции почечного кровотока).
Важная роль генетических факторов в развитии ЭАГ подтверждена данными эпидемиологических исследований, которые указывают на неравномерное распределение АГ среди лиц разных этнических групп. Например, практически в любом возрасте риск АГ у негров достоверно выше, чем у лиц других рас. Кроме того, конкордантность уровней АД у членов одной семьи свидетельствует о том, что различия в распространенности АГ могут быть следствием разных средовых условий. Наконец, важным фактором риска АГ является возраст, поскольку частота АГ достоверно выше среди пожилых лиц.
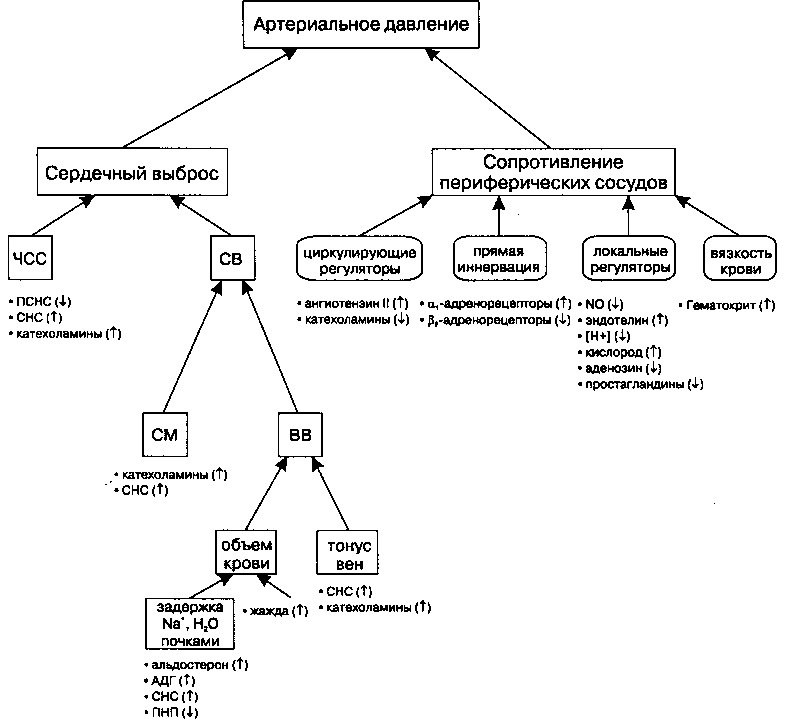
Рис. 13.3. Регуляция системного артериального давления. Стрелки указывают: (Т) — на стимуляцию; (>L) — на ингибирование или снижение значений параметров; ЧСС — частота сердечных сокращений; УО — ударный объем; ПСНС — парасимпатическая нервная система; СНС — симпатическая нервная система; СМ — сократимость миокарда; ВВ — венозный возврат; АДГ — антидиуретический гормон; ПНП — предсердный натрийуретический пептид
Экспериментальные данные
У больных АГ и их ближайших родственников обнаружены многочисленные нарушения регуляции уровня АД. Эти нарушения сами по себе или в комбинации с другими провоцирующими факторами могут сопровождаться стойким повышением АД.
Причиной повышения АД нередко является нарушение нейрогормональной регуляции работы сердца, приводящее к увеличению сердечного выброса вследствие стимуляции выброса катехоламинов. Так, у больных АГ (и их ближайших родственников) на фоне физиологического стресса часто наблюдают более выраженное, чем у здоровых лиц, повышение частоты сердечных сокращений, указывающее на гиперактивность симпатической нервной системы.
Причиной АГ может быть повышение общего периферического сосудистого сопротивления вследствие сужения кровеносных сосудов при 1) нарушении регуляции симпатической нервной системы, 2) нарушении регуляции сосудистого тонуса местными факторами (оксид азота, эндотелии, предсердный натрийуретический фактор) или 3) дефектах ионных каналов гладкомышечных клеток сосудов.
В основе АГ, возникающей на фоне увеличения объема циркулирующей крови, лежит дисфункция почек, сопровождающаяся задержкой воды и ионов натрия в организме. Полагают, что причиной этого может быть 1) нарушение регуляции почечного кровотока, 2) дефекты ионных каналов (например, снижение активности базолатеральной На+/К+-АТФ-азы), вызывающие задержку натрия, или 3) нарушение гормональной регуляции работы почек. Хорошо известно, что в регуляции периферического сосудистого сопротивления важную роль играет ренин-ангиотензин-аль-достероновая система (см. далее). Известно также, что у 30% больных ЭАГ содержание ренина в плазме крови соответствует верхней границе нормы, у 60% — норме и у 10% — повышено. Ввиду того, что повышение АД должно приводить к подавлению секреции ренина, у больных АГ даже «нормальную» концентрацию ренина в плазме крови следует рассматривать как повышенную. Таким образом, нарушения секреции ренина могут играть важную роль в возникновении ЭАГ у некоторых больных.
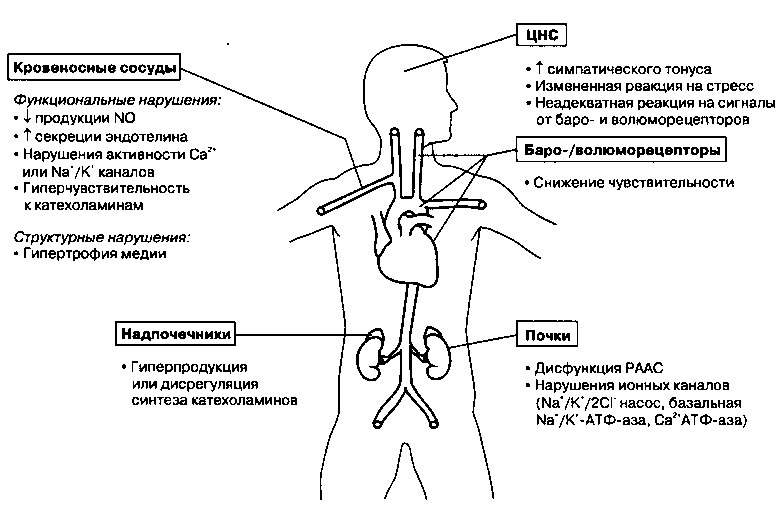
Предполагаемые патогенетические механизмы развития ЭАГ представлены на схеме (рис. 13.4). Обратите внимание на то, что, хотя сердечно-сосудистая система и почки играют решающую роль в под держании и регуляции АД, нарушения, приводящие к развитию АГ, могут быть локализованы и в других системах организма (центральная нервная система, барорецепторы артерий, гормоны коры надпочечников). Нарушение работы любой из этих систем может сопровождаться повышением АД, однако важно помнить, что возникновение стойкой АГ возможно только в том случае, если в патологический процесс вовлечены почки, которые в норме способны снижать уровень АД, выводя из организма необходимое количество жидкости.
Рис. 13.4. Возможные причины развития эссенциальной артериальной гипертензии (ЭАГ). Представленные данные основаны на результатах экспериментальных исследований, однако вклад этих нарушений в развитие ЭАГ у конкретного больного неизвестна. ЦНС — центральная нервная система, РААС — ренин-ангиотензин-альдостероновая система
Недавно были получены данные о том, что в патогенезе ЭАГ важную роль может играть инсулин. У больных АГ (особенно — с избыточной массой тела или сахарным диабетом II типа) наблюдаются признаки инсу-линорезистентности (нарушение инсулин-зависимого транспорта глюкозы в периферических тканях). Инсулинорезистентность сопровождается повышением уровня глюкозы в плазме крови и, как следствие, компенсаторным увеличением секреции инсулина бета-клетками поджелудочной железы. Полагают, что гиперинсулинемия может приводить к повышению АД посредством следующих механизмов: 1) инсулин стимулирует реабсорбцию натрия в проксимальных канальцах, что сопровождается увеличением объема циркулирующей крови, 2) инсулин активирует симпатическую нервную систему и увеличивает содержание катехоламинов в циркулирующей крови, 3) инсулин оказывает митогенное действие, способствуя гипертрофии гладкомышечных клеток сосудов, и 4) инсулин нарушает транспорт ионов через плазматическую мембрану, в результате увеличивается концентрация внутриклеточного кальция и повышается тонус сосудов. Вместе с тем, истинная роль гиперинсулинемии в патогенезе ЭАГ неизвестна, и этот вопрос остается предметом экспериментальных и клинических исследований.
Клиническая картина и течение ЭАГ
Эссенциальная артериальная гипертензия обычно возникает у людей среднего возраста. Распространенность заболевания увеличивается с возрастом, так, у 60% американцев старше 60 лет наблюдается повышение ДАД > 90 мм рт. ст.; кроме того, у части людей диагностируется изолированная систолическая артериальная гипертензия (САД > 140 мм рт. ст.).
Необходимо отметить, что со временем у больных ЭАГ изменяются гемодинамические показатели, связанные с повышением АД (рис. 13.5). Для больных моложе 40 лет типична так называемая «гиперкинетическая» фаза ЭАГ, когда повышение АД происходит в результате увеличения СВ, а величина ОПСС остается в пределах нормы. С возрастом вклад СВ в развитие АГ уменьшается, а ОПСС, напротив, увеличивается, поскольку сердце и кровеносные сосуды постепенно адаптируются к длительному механическому стрессу. Так, гипертрофия левого желудочка у больных с хронической АГ приводит к нарушению диастолического наполнения (что, в свою очередь, снижает ударный объем и сердечный выброс), а гипертрофия медияльного слоя артериол сопровождается уменьшением диаметра просвета сосуда, что увеличивает сопротивление кровотоку. Как следствие, у больных АГ пожилого возраста основным нарушением становится увеличение ОПСС при нормальном или сниженном СВ. Эти изменения (от «высокого СВ и низкого ОПСС» к «нормальному СВ и повышенному ОПСС») происходят независимо от того, увеличивается среднее артериальное давление со временем или остается постоянным.
Эссенциальная артериальная гипертензия — это синдром, развивающийся в результате действия многочисленных патофизиологических механизмов, но характеризующийся определенными гемодинамическими нарушениями и клиническим течением. Причиной стойкого повышения АД являются, по-видимому, множественные приобретенные и/или наследственные нарушения целого ряда регуляторных систем организма. В
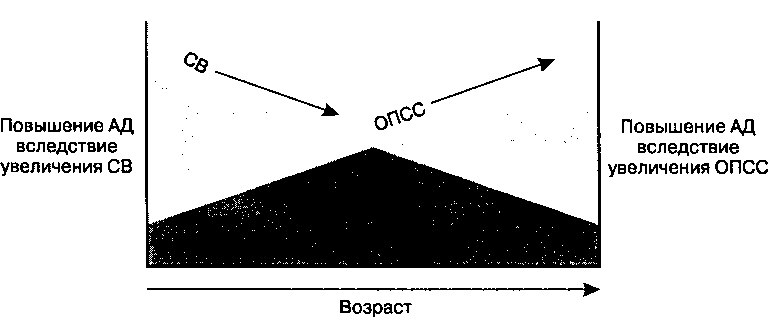
Рис. 13.5. Гемодинамическое прогрессирование эссенциальной артериальной гипертензии (ЭАГ). На схеме показано изменение сердечного выброса (СВ) и общего периферического сосудистого сопротивления (ОПСС) у больных ЭАГ с возрастом
настоящее время мы не можем установить истинную причину развития ЭАГ у конкретного больного, но мы способны довольно точно описать предполагаемые патофизиологические механизмы, лежащие в основе этого заболевания. Эссенциальная артериальная гипертензия, оставаясь заболеванием неясной этиологии, уже не представляет собой нечто «абсолютно неведомое».
ВТОРИЧНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Хотя в повседневной медицинской практике клиницисты чаще всего сталкиваются с ЭАГ, у 5% больных все же удается обнаружить явные структурные или гормональные нарушения, приводящие к повышению АД. Вторичная АГ встречается относительно редко, однако выявление таких случаев имеет большое практическое значение, поскольку нередко удается устранить нарушения, лежащие в основе вторичной АГ, причем подходы к лечению больных этой группы могут существенно отличаться от подходов, используемых при ЭАГ. Более того, в отсутствие адекватного лечения у больных ВАГ наблюдаются такие же изменения сердечно-сосудистой системы, что и при хронической ЭАГ. Как следствие, у больных, не получавших необходимого лечения, уровень АД нередко остается высоким даже после устранения первичного заболевания.
Вероятность вторичной АГ необходимо учитывать при обследовании любых больных с повышенным АД. Существует ряд косвенных признаков, указывающих на возможную вторичную АГ у данного больного (таблица 13.2):
1. Возраст. Вероятность вторичной АГ возрастает, если гипертония наблюдается у больного в молодом (< 20 лет) или пожилом (> 60 лет) возрасте (т. е. в том возрасте, когда ЭАГ возникает редко).
2. Тяжесть. Для вторичной АГ характерно выраженное повышение АД (3 ст.), тогда как у большинства больных ЭАГ увеличение уровня АД соответствует 1—2 степени тяжести (легкая-умеренная АГ).
3. Начало заболевания. Вторичная АГ нередко возникает внезапно у лиц, ранее имевших нормальный уровень АД. Эссенциальная АГ, напротив, развивается постепенно в течение ряда лет.
4. Сопутствующие симптомы. Заболевание, вызвавшее вторичную АГ, может проявляться специфическими симптомами, выявляемыми на основании анамнестических данных, при физикальном обследовании и пр. Например, у больных со стенозом почечной артерии при обследовании органов брюшной полости нередко выслушивается характерный сосудистый шум, обусловленный турбулентным током крови в участке стеноза.
5. Семейный анамнез. Ближайшие родственники больных ЭАГ нередко имеют повышенное АД, тогда как вторичная АГ чаще всего возникает спорадически.
Осмотр больных с недавно диагностированной АГ начинают с тщательного сбора анамнеза и всестороннего физикального обследования, включающего поиск симптомов вторичной АГ. К числу обязательных лабораторных и инструментальных исследований относят: 1) общий анализ мочи, определение концентрации креатинина и азота мочевины в крови (эти показатели изменяются при поражении паренхимы почек), 2) определение уровня калия в сыворотке крови (снижен при реноваскулярной АГ или первичном альдостеронизме), 3) рентгенографию грудной клетки (коарктация аорты). Если нарушений не выявлено, больному устанавливают диагноз ЭАГ и назначают соответствующее лечение. Если АГ оказывается рефрактерной к традиционной медикаментозной терапии, проводят более детальное обследование с целью выявления специфических форм вторичной АГ.
Таблица 13.2, Причины развития артериальной гипертензии
Тип |
Доля больных |
Клинические особенности |
«Эссенциальная» |
95% |
|
Хроническое заболевание почек |
2-4% |
• Т [креатинин], изменения в общем анализе мочи |
Реноваскулярная АГ |
1% |
|
Феохромоцитома |
0,2% |
|
Коарктация аорты |
0,1% |
|
Первичный альдостеронизм |
0,1% |
• Ф [К+] в плазме крови |
Синдром Кушинга |
0,1% |
• Характерный внешний вид («кушин-гоид», то есть абдоминальное ожирение, гирсутизм и пр.) |
Экзогенные причины АГ
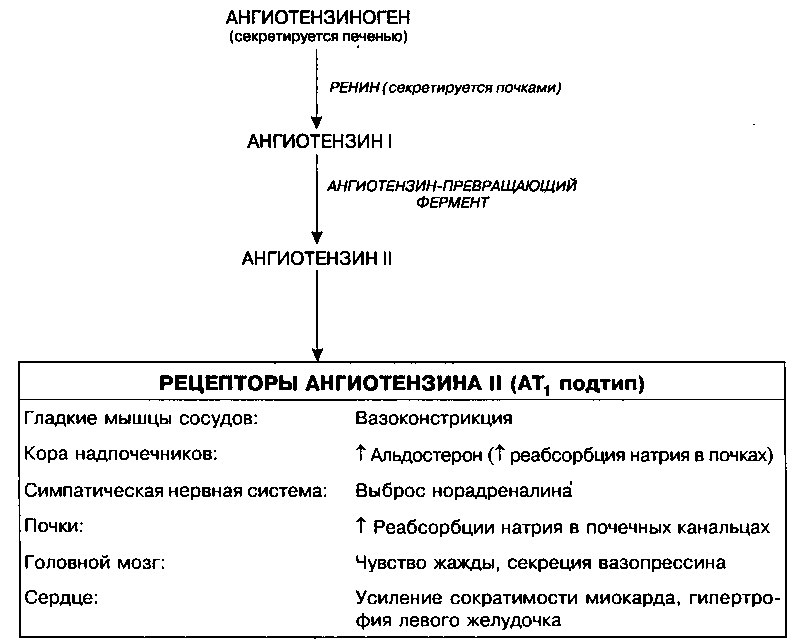
Хорошо известно, что прием некоторых лекарственных средств может сопровождаться повышением АД. Например, у женщин вторичная АГ иногда возникает на фоне приема пероральных контрацептивов. Полагают, что механизм этого побочного эффекта контрацептивов связан с активацией ренин-ангиотензин-альдостероновой системы: эстрогены стимулируют синтез ангиотензина в печени, что приводит к повышению продукции ангиотензина II (рис. 13.6). Ангиотензин II увеличивает АД, в основном, за счет прямого сосудосуживающего действия и стимулирования синтеза альдостерона в коре надпочечников. Альдостерон усиливает задержку натрия в почечных канальцах, увеличивая тем самым объем циркулирующей крови.
Рис. 13.6. Ренин-ангиотензин-альдостероновая система. Секретируемый печенью ангиотензиноген расщепляется в кровотоке под действием секретируемого почками ренина до ангиотензина I. Ангиотензин I в реакции, катализируемой ангиотензинпревращающим ферментом, быстро трансформируется в ангиотензин II, обладающий мощным сосудосуживающим действием. Кроме того, ангиотензин II регулирует секрецию альдостерона корой надпочечников. Альдостерон усиливает реабсорбцию Na+ в почечных канальцах, что ведет к увеличению объема циркулирующей крови. Другие эффекты, связанные с активацией рецепторов ангиотензина II, также способствуют развитию и поддержанию АГ
Уровень АД может повышаться на фоне терапии глюкокортикоидами, циклоспорином А (иммунодепрессант, назначаемый больным после трансплантации органов), эритропоэтином (стимулятор эритропоэза; повышение АД в этом случае обусловлено увеличением вязкости крови и нарушением локальной вазодилатации в ответ на гипоксию), симпатомиметиками и фенилпропаноламином (входящими в состав безрецептурных средств от насморка).
Кроме того, высокий уровень АД наблюдается у лиц, употребляющих кокаин, и злоупотребляющих алкоголем.
Поражение почек
Почки играют важную роль в регуляции АД, поэтому нарушение их функции может сопровождаться развитием АГ. Поражение почек — одна из наиболее частых причин вторичной АГ; так, у 2—4% больных повышение АД обусловлено заболеванием паренхимы почек и у 1% — стенозом почечной артерии.
ЗАБОЛЕВАНИЯ ПАРЕНХИМЫ ПОЧЕК
Паренхиматозное поражение почек может развиться в результате различных патологических процессов. Механизм повышения АД при заболеваниях паренхимы почек почти всегда связан с увеличением объема циркулирующей крови. Нарушение функции нефронов приводит к снижению экскреции натрия и воды из организма, увеличению объема циркулирующей крови и сердечного выброса и, следовательно, повышению артериального давления.
У больных с легкой или умеренной дисфункцией почек системное АД может стабилизироваться на уровне, при котором перфузионное давление в почках будет достаточно высоким для того, чтобы установилось равновесие между выведением и потреблением натрия. Однако при терминальной почечной недостаточности скорость гломерулярной фильтрации значительно снижена, и почки не в состоянии выводить из организма необходимое колйчество жидкости, в результате чего у больных может развиваться злокачественная артериальная гипертензия.
Поражение паренхимы почек нередко сопровождается гиперсекрецией ренина, что может приводить к развитию АГ даже при относительно нормальной скорости гломерулярной фильтрации.
РЕНОВАСКУЛЯРНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Стеноз одной или обеих почечных артерий приводит к АГ. Причиной реноваскулярной АГ может быть тромбоэмболия, васкулиты или внешнее сдавление почечных артерий, однако чаще всего эта форма АГ обусловлена атеросклеротическим поражением или фиброзно-мышечной дисплазией почечных артерий. Атеросклероз, обычно поражающий проксимальную часть или устье почечной артерии, является причиной 2/3 случаев реноваскулярной АГ. Чаще всего эта форма АГ развивается у мужчин пожилого возраста. Напротив, фиброзно-мышечная дисплазия характеризуется дискретными участками фиброза или мышечной дисплазии, которые локализованы в медияльном слое дистальных отделов почечной артерии. Реноваскулярная АГ вследствие фиброзно-мышечной дисплазии встречается в 1/3 случаев и типична для молодых женщин европеоидной расы.
Повышение АД при реноваскулярной АГ обусловлено недостаточным кровоснабжением почек, снижением перфузионного давления и, как следствие, избыточной секрецией ренина, в результате чего в крови увеличивается концентрация ангиотензина II, оказывающего сосудосуживающее действие, и альдостерона, задерживающего натрий в организме (рис. 13.6).
К числу диагностических признаков реноваскулярной АГ относят сосудистый шум в эпигастрии, боковых и подвздошных отделах живота (у 40—60% больных), а также гипокалиемию (вследствие избыточной экскреции калия вследствие высокого уровня альдостерона). Реноваскулярная АГ эффективно лечится, в частности, чрескожной баллонной дилатацией или хирургической реконструкцией стенозированной почечной артерии. Кроме того, на начальных этапах лечения больных со стенозом одной почечной артерии с успехом применяют ингибиторы ангиотензин-превращающего фермента (АПФ). Ингибиторы АПФ препятствуют эффектам, обусловленным высокой концентрацией ренина, предотвращая образование ангиотензина II (глава 17).
Механические причины АГ
КОАРКТАЦИЯ А ОРТЫ
Коарктация аорты — это редко встречающееся врожденное сужение аорты ниже места отхождения левой подключичной артерии (глава 16). Сужение аорты создает частичное препятствие кровотоку, в результате чего давление в дуге аорты, сосудах головы и верхних конечностей становится выше, чем в нисходящей аорте, отходящих от нее сосудах, а также сосудах нижних конечностей. В некоторых случаях коарктация захватывает устье левой подключичной артерии, при этом артериальное давление на левой руке может быть ниже, чем на правой.
Развитие АГ у больных с коарктацией аорты обусловлено действием двух механизмов. Во-первых, ослабление почечного кровотока сопровождается активацией ренин-ангиотензиновой системы и повышением в плазме крови концентрации ангиотензина II, оказывающего сосудосуживающее действие. Во-вторых, увеличение давления выше места коарктации приводит к гиперплазии медии аорты, повышению жесткости сосудистой стенки, прогрессированию атеросклеротического поражения и, как следствие, к угнетению реакции барорецепторов на увеличение объема циркулирующей крови.
Клинические признаки коарктации аорты включают симптомы недостаточного кровоснабжения нижних конечностей или левой руки (перемежающаяся хромота, слабость в ногах, ослабление или отсутствие пульса на бедренной артерии). Вследствие стеноза участка аорты появляется ме-зосистолический шум, лучше всего прослушивающийся со стороны спины между лопатками. На рентгенограмме грудной клетки выявляют деформацию дуги аорты и узурацию ребер (из-за повышенного коллатерального кровотока по межреберным артериям в обход суженного участка аорты). Метод выбора при лечении таких больных — ангиопластика или хирургическая коррекция стеноза. У некоторых больных высокий уровень АД сохраняется даже после восстановления аортального кровотока (возможно вследствие десенситизации барорецепторов).
Эндокринные нарушения
Гормоны играют важную роль в регуляции АД, поэтому эндокринные заболевания нередко сопровождаются АГ. Диагностика эндокринных нарушений, которые могут приводить к развитию АГ, основана на:
1. тщательном анализе всех анамнестических данных и симптомов заболевания.
2. определении уровня гормонов в плазме крови.
3. оценке секреции гормонов в ответ на действие специфических стимуляторов или ингибиторов.
4. результатах методов визуализации, позволяющих выявить опухоль, продуцирующую гормоны.
ФЕОХРОМОЦИТОМА
Феохромоцитома — это продуцирующая катехоламины опухоль нейроэндокринных клеток (обычно — мозгового слоя надпочечников), обусловливающая около 0,2% всех случаев АГ. Выброс адреналина и норадреналина клетками опухоли сопровождается временным или постоянным спазмом сосудов, тахикардией и другими симптомами гиперактивности симпатической нервной системы. Для больных этой категории характерно приступообразное повышение АД, сопровождающееся выраженной головной болью, обильным потоотделением, сердцебиением и тахикардией. В большинстве случаев феохромоцитома сопровождается стойкой АГ, однако у некоторых больных в период между приступами уровень АД может соответствовать значениям нормы. 10% феохромоцитом являются злокачественными.
Важную роль в диагностике феохромоцитомы играет анализ уровня катехоламинов в плазме крови, а также свободных катехоламинов и их метаболитов (ванилилминдальной кислоты, метанефринов) в суточной моче. При некоторых феохромоцитомах катехоламины выбрасываются в кровь эпизодически, поэтому анализ уровня гормонов следует проводить сразу после криза.
Медикаментозная терапия феохромоцитомы включает назначение альфа-адреноблокаторов (например, феноксибензамина) в комбинации с бета-адреноблокаторами. Вместе с тем, у больных с установленной локализацией опухоли (с помощью КТ, МРТ или ангиографии) методом выбора является хирургическая операция. При неоперабельной опухоли назначают альфа- и бета-адреноблокаторы, а также препараты, ингибирующие синтез катехоламинов (альфа-метилтирозин).
ГИПЕРСЕКРЕЦИЯ ГОРМОНОВ КОРЫ НАДПОЧЕЧНИКОВ
В коре надпочечников синтезируется целый ряд гормонов, в том числе — минералокортикоиды и глюкокортикоиды, избыточная продукция которых может сопровождаться АГ.
Минералокортиковды (основной гормон — альдостерон) стимулируют реабсорбцию натрия в дистальных канальцах нефрона, приводя к увеличению объема циркулирующей крови. Усиление реабсорбции натрия сочетается с избыточной экскрецией калия с мочой, что может сопровождаться гипокалиемией, которая является важным лабораторно-диагностическим признаком гиперсекреции минералокортикоидов. Примерно у 0,1% больных АГ выявляют первичный альдостеронизм, в большинстве случаев обусловленный аденомой надпочечников и несколько реже — двусторонней гиперплазией надпочечников. Заболевание может протекать бессимптомно, в этом случае диагноз устанавливают на основании лабораторных анализов (гипокалиемия, гиперсекреция альдостерона и снижение концентрации ренина в плазме крови). Больным этой категории показано хирургическое удаление аденомы или терапия антагонистами рецепторов альдостерона (например, спиронолактоном). Вторичный альдостеронизм наблюдается при гиперпродукции ангиотензина II вследствие редко встречающейся ренин-секретирующей опухоли.
Высокий уровень ангиотензина II часто отмечается у женщин, принимающих пероральные контрацептивы (препараты этого класса стимулируют продукцию ангиотензиногена в печени), а также у больных с хроническими заболеваниями печени (вследствие снижения метаболизма ангиотензина II).
Гиперсекреция глюкокортикоидов (например, кортизола) нередко сопровождается повышением АД в результате увеличения объема циркулирующей крови и усиления синтеза ренина. Так, повышение уровня АД отмечается у 80% больных с синдромом Кушинга. Больные этой категории имеют характерный внешний вид: лунообразное лицо, центральное ожирение, мышечную слабость, гирсутизм. Синдром Кушинга наблюдается при АКТГ-секретирующей аденоме гипофиза, периферических АКТГ-секретирующих опухолях (сопровождающихся гиперплазией надпочечников), а также при кортизол-секретирующей аденоме надпочечников.
НАРУШЕНИЯ СЕКРЕЦИИ ГОРМОНОВ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Выраженная артериальная гипертензия диагностируется примерно у 30% больных с гипертиреозом и у 25% — с гипотиреозом. Тироидные гормоны влияют на работу сердечно-сосудистой системы: 1) активируя №+/К+-АТФазу в миокарде и кровеносных сосудах, 2) увеличивая объем циркулирующей крови и 3) усиливая активность ферментативных процессов и увеличивая потребление кислорода, в результате чего в тканях накапливаются продукты метаболизма, влияющие на тонус сосудов. Повышение АД у больных гипертиреозом обусловлено гиперактивностью сердечно-сосудистой системы и увеличением объема циркулирующей крови.
Развитие АГ при гипотиреозе связывают с действием местных факторов: при снижении активности ферментативных процессов уменьшается локальная концентрация продуктов метаболизма, что сопровождается относительной вазоконстрикцией.
ПОСЛЕДСТВИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Независимо от причин возникновения, АГ приводит к схожим последствиям. Само по себе повышение АД обычно не сопровождается развитием явных клинических симптомов, однако может быть причиной поражения многих жизненно важных органов — в первую очередь, кровеносных сосудов, сердца, почек и сетчатки.
Клинические симптомы и признаки
В прошлом «классическими» симптомами АГ считали головную боль, носовые кровотечения и головокружение. Вместе с тем, клинические исследования поставили под сомнение специфичность этих симптомов, так как их распространенность при АГ существенно не отличалась от распространенности в общей популяции. Другие симптомы (приливы, потливость, нечеткость зрения) действительно отмечаются у больных АГ несколько чаще. В большинстве случаев АГ протекает бессимптомно, и диагноз устанавливают на основании простого измерения уровня АД во время обычного физикального обследования.
Некоторые проявления АГ, описанные в следующем разделе, являются прямым следствием повышенного АД (например, гипертрофия левого желудочка сердца или ретинопатия). Кроме того, у больных АГ и атеросклерозом может выслушиваться сосудистый шум над сонными и бедренными артериями.
Поражение органов-мишеней при АГ
Поражение органов-мишеней при АГ отражает степень повышения АД и может быть следствием 1) увеличения нагрузки на сердце, 2) повреждения артерий в результате высокого АД (ослабление сосудистой стенки) и ускоренного развития атеросклероза (рис. 13.7). Артериальная гипертензия сопровождается изменением структурных и функциональных свойств сосудов вследствие гипертрофии гладкомышечных клеток, дисфункции эндотелия и ослаблением механических свойств эластических волокон. Прогрессирование атеросклероза на фоне стойкого повышения АД связывают с дисфункцией эндотелия, нарушением работы естественных защитных механизмов (так, продукции NO) и гипертрофией гладкомышечных клеток. Пораженные атеросклерозом участки артерий нередко сами подвергаются тромбозу или могут быть источником тромбов, вызывающих окклюзию дистальных сосудов и инфаркт органов (например, окклюзия мозговой артерии приводит к инсульту). Кроме того, при атеросклеротическом поражении крупных артерий нарушаются их эластические свойства, что сопровождается резким увеличением систолического АД, приводящим к еще более выраженной дисфункции эндотелия или таким угрожающим жизни состояниям, как разрыв сосудистой аневризмы.
В первую очередь при АГ поражаются такие органы-мишени, как сердце, сосуды головного мозга, аорта, периферические сосуды, почки и сетчатка глаза (таблица 13.3). В отсутствие адекватного лечения около 50% больных АГ умирает от ишемической болезни сердца (ИБС) и застойной сердечной недостаточности, 30% — от инсульта и его осложнений и 10—15% — от почечной недостаточности.
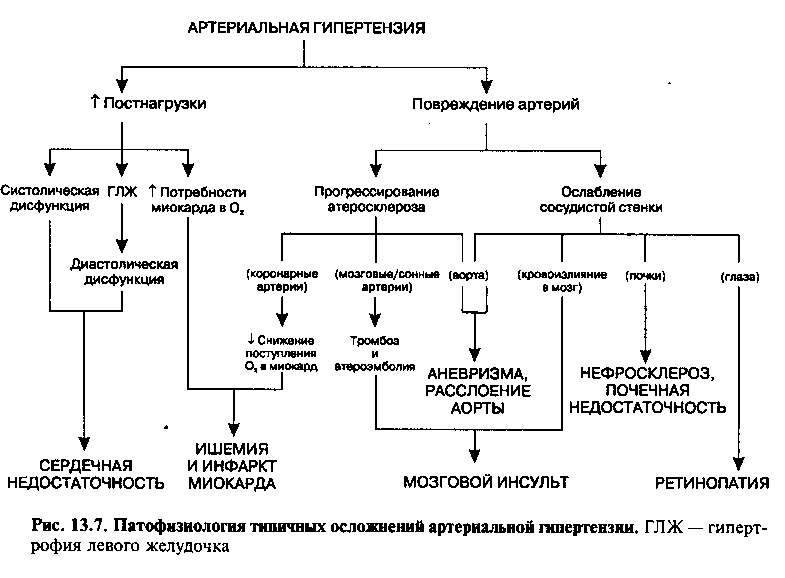
Таблица 13.3. Органы-мишени при артериальной гипертензии
Орган |
Клинические проявления |
Сердце |
|
Головной мозг |
• Инсульт |
Аорта, периферические сосуды |
|
Почки |
|
Сетчатка глаза |
|
СЕРДЦЕ
Артериальная гипертензия приводит к увеличению постнагрузки на левый желудочек (ЛЖ) и быстрому прогрессированию атеросклероза коронарных сосудов.
Гипертрофия левого желудочка сердца
и диастолическая дисфункция
В результате повышения АД (увеличения постнагрузки) возрастает напряжение стенки ЛЖ, что сопровождается компенсаторной гипертрофией миокарда. Как правило, у больных АГ развивается компенсаторная концентрическая гипертрофия миокарда (без изменения размеров полости). Повышение АД вследствие увеличения объема циркулирующей крови (например, при первичном альдостеронизме) может быть причиной эксцентрической гипертрофии миокарда, при которой утолщение стенки сопровождается расширением полости ЛЖ (глава 9). Гипертрофия миокарда сопровождается увеличением жесткости стенок ЛЖ и развитием диастолической дисфункции. Основным проявлением диастолической дисфункции является повышение давления наполнения ЛЖ, что может приводить к застою в легких (глава 9).
При физикальном обследовании у больных с гипертрофией ЛЖ (ГЛЖ) выявляют усиленный верхушечный толчок, что указывает на увеличение массы миокарда ЛЖ, и нередко — IV тон (глава 2), возникающий при заполнении ЛЖ, стенки которого утратили эластичность.
Гипертрофия ЛЖ — один из наиболее значимых прогностических факторов риска смерти от сердечно-сосудистых заболеваний среди больных АГ. Выраженность ГЛЖ прямо коррелирует с риском развития застойной сердечной недостаточности, стенокардии, аритмий, инфаркта миокарда и внезапной смерти.
Систолическая дисфункция
Хотя первоначально ГЛЖ представляет собой защитную, компенсаторную реакцию, по мере прогрессирования АГ увеличение массы миокарда уже не позволяет преодолеть возросшую постнагрузку на ЛЖ. Снижение сократимости ЛЖ сопровождается появлением симптомов систолической дисфункции (уменьшение сердечного выброса, застой в легких). Кроме того, систолическая дисфункция может развиваться вследствие быстрого прогрессирования ИБС, приводящей к ишемии миокарда или ИМ.
Ишемическая болезнь сердца
Стойкая АГ — одна из основных причин развития ишемии и ИМ. Возникновение этих осложнений связывают с прогрессированием атеросклероза коронарных сосудов (снижение поступления кислорода в миокард) и усилением систолической нагрузки на миокард (повышение потребности в кислороде). Риск ИМ у больных АГ выше, чем у лиц с нормальным АД, более того, при АГ чаще наблюдаются такие осложнения ИМ как разрыв стенки ЛЖ, образование аневризмы ЛЖ, застойная сердечная недостаточность. Так, 60% больных, умирающих в результате трансмурального ИМ, страдали АГ.
СОСУДЫ ГОЛОВНОГО МОЗГА
Артериальная гипертензия — основной корригируемый фактор риска инсульта. Несмотря на важность диастолического АД, риск инсульта в большей степени коррелирует с величиной систолического АД. Так, риск инсульта в два раза выше у больных с изолированной систолической АГ.
Артериальная гипертензия может быть причиной геморрагического или, несколько чаще, тромботического (атеросклеротического) инсульта. Геморрагический инсульт развивается в результате разрыва микроаневризмы сосуда головного мозга (внутримозгового кровоизлияния), обусловленной стойкой артериальной гипертензией. Тромботический инсульт возникает при разрушении атеросклеротических бляшек в сонных или крупных мозговых артериях, а также при образовании на поверхности бляшек тромбов, которые приводят к закупорке мелких дистальных сосудов головного мозга. Кроме того, причиной окклюзии мозговых артерий может быть разрыв локальных атеросклеротических бляшек.
Окклюзия мелких мозговых артерий приводит к развитию небольших глубоко расположенных инфарктов, которые подвергаются фагоцитозу с образованием кист (лакун) (< 3 мм диаметром). Лакунарные инфаркты, как правило, развиваются только у больных со стойкой АГ и обычно, локализованы в бассейнах средней и задней мозговых артерий.
Сужение артерий, типичное для больных АГ, сопровождается снижением коллатерального кровотока в ишемизированных участках. Кроме того, при сужении артерий для поддержания адекватного тканевого кровотока требуется более высокое перфузионное давление. Как следствие, при резком снижении АД у больных АГ особенно высок риск развития инфаркта мозга в зонах кровоснабжаемых дистальными участками артерий (в зонах «водораздела» мозговых артерий).
Эффективная антигипертензивная терапия способствует достоверному снижению риска мозгового инсульта — так, за последние 20 лет смертность от цереброваскулярных осложнений среди больных АГ снизилась на 50%.
АОРТА И ПЕРИФЕРИЧЕСКИЕ СОСУДЫ
Артериальная гипертензия сопровождается прогрессированием атеросклеротического поражения и сужением практически всех артерий организма. Помимо коронарных артерий, наиболее подвержены атеросклеротическим изменениям аорта и крупные артерии нижних конечностей, шеи и головного мозга.
Стойкая АГ может приводить к образованию аневризмы аорты (чаще всего — брюшного отдела, глава 15). Аневризма брюшной аорты — это расширение просвета сосуда (обычно ниже отхождения почечных артерий) в результате механического действия высокого давления крови. Стенки аорты в этом участке, как правило, уже повреждены в результате атеросклероза и патологических изменений медии. Аневризма аорты диаметром более 6 см является показанием к хирургическому лечению — у больных этой категории высок риск разрыва аневризмы в течение последующих 2 лет.
Другим опасным для жизни поражением кровеносных сосудов при АГ является расслаивающая аневризма аорты (глава 15). На фоне высокого АД усиливаются дегенеративные процессы в медияльном слое аорты. Длительное воздействие на такой пораженный участок высокого АД может приводить к разрыву интимы сосуда, в результате чего кровь проникает в медию, расслаивая стенку сосуда и распространяясь вдоль аорты по образовавшемуся внутристеночному каналу. Очевидно, что расслаивающая аневризма может приводить к обструкции крупных сосудов, отходящих от аорты (например, коронарных или сонных артерий). Смертность при расслаивающей аневризме аорты превышает 90%, и это состояние является абсолютным показанием к немедленному хирургическому вмешательству (особенно, если поражены проксимальные отделы аорты). В дальнейшем у больных этой категории необходимо тщательно контролировать уровень АД.
ПОЧКИ
Нефропатия, возникающая на фоне АГ (нефросклероз), является наиболее частой причиной развития почечной недостаточности. При гистологическом исследовании выявляют утолщение стенок почечных сосудов, инфильтрированных гиалиновыми массами (гиалиноз артериол, рис. 13.8). Повышение АД сопровождается гипертрофией гладкомышечных клеток и некрозом стенок капилляров (фибриноидный некроз). Эти нарушения приводят к ухудшению кровоснабжения и последующей ишемической
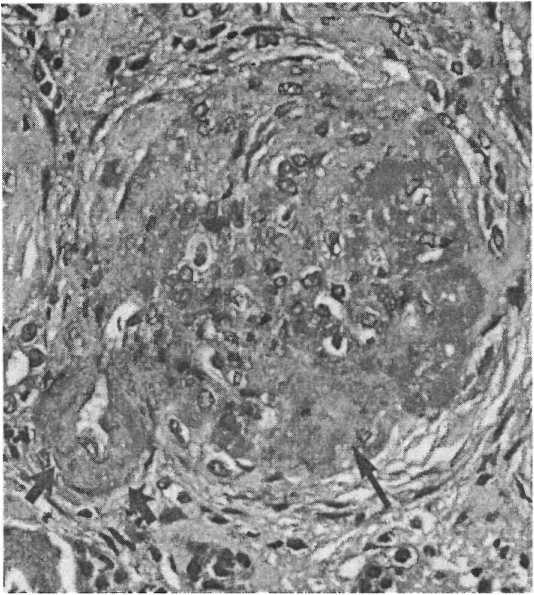
Рис. 13.8. Гистологические изменения почечной ткани при артериальной гипертензии. Утолщение стенок артериол в результате их гиалиноза (маленькая стрелка). Клубочки частично склерозированы вследствие недостаточного кровоснабжения (большая стрелка). (С любезного разрешения Dr. Helmut G. Rennke, Brigham and Women’s Hospital, Boston, Massachusetts.)
атрофии почечных канальцев и (в меньшей степени) клубочков. Нормально функционирующие нефроны способны компенсировать утрату части клубочков, поэтому умеренная АГ редко сопровождается развитием почечной недостаточности (при отсутствии других заболеваний почек). Однако при тяжелой АГ поражение почек может обусловить необходимость в гемодиализе.
Одним из последствий почечной недостаточности вследствие АГ является стойкое повышение уровня АД. Так, при прогрессирующей почечной недостаточности нарушаются механизмы регуляции объема циркулирующей крови, что ведет к дальнейшему росту АД.
СЕТЧАТКА
Сетчатка глаза — это единственный орган, осмотр которого позволяет оценить состояние системных артерий. Повышение АД сопровождается поражением сетчатки или гипертонической ретинопатией. Выраженная ретинопатия может сопровождаться частичной утратой зрения, однако чаще всего изменения сетчатки являются бессимптомными клиническими показателями тяжести и продолжительности АГ.
Острое начало АГ и выраженное повышение АД (например, при отсутствии лечения или злокачественной АГ) нередко приводит к разрыву мелких сосудов, вызывая кровоизлияния, экссудацию липидов плазмы или локальные инфаркты сетчатки (рис. 13.9В). При ишемии зрительного нерва больные отмечают общее ухудшение зрения. Кровоизлияние и последующая ишемия сетчатки сопровождаются снижением остроты и дефектами полей зрения. Отек и нечеткие края диска зрительного нерва обычно указывают на повышение внутричерепного давления в результате злокачественной гипертонии и нарушения механизмов ауторегуляции мозгового кровотока.
Изменения сетчатки при стойком повышении АД представлены на рис. 13.9Б: отек диска зрительного нерва отсутствует, но артериолы сужены, их стенки утолщены в результате гипертрофии медияльного слоя, нередко отмечается артериовенозный перекрест. При более выраженной АГ наблюдаются признаки склероза артерий (усиление светопреломления — симптом «медной» или «серебряной» проволоки). Эти изменения, как правило, не сопровождаются значительными нарушениями функции сетчатки, однако они указывают на стойкую и плохо контролируемую АГ.
ГИПЕРТОНИЧЕСКИЙ КРИЗ
Гипертонический криз — это резкое повышение АД, требующее немедленного медицинского вмешательства. В прошлом основной причиной гипертонических кризов была неэффективная антигипертензивная терапия, а в настоящее время они чаще всего являются следствием внезапных гемодинамических нарушений (например, при остром заболевании почек), возникающих у больных хронической АГ. Быстрые патологические изменения кровеносных сосудов и почек (фибриноидный некроз) сопровождаются резким повышением АД, а ухудшение перфузии почек и повышение уровня ренина и ангиотензина в плазме приводит к еще большему увеличению объема циркулирующей крови и сужению системных артерий.
При выраженной АГ повышается внутричерепное давление, приводя к развитию гипертонической энцефалопатии, при которой у больных отмечается головная боль, нарушения зрения, судороги, спутанность сознания, сонливость, а в тяжелых случаях — коматозное состояние. Острое поражение сосудов сетчатки указывает на злокачественную АГ, при офтальмоскопии у больных этой категории отмечают такие признаки резкого повышения АД как кровоизлияния, экссудаты, отек диска зрительного нерва. Увеличение нагрузки на ЛЖ во время гипертонического криза может провоцировать приступ стенокардии (вследствие увеличения потребности миокарда в кислороде) или отек легких.
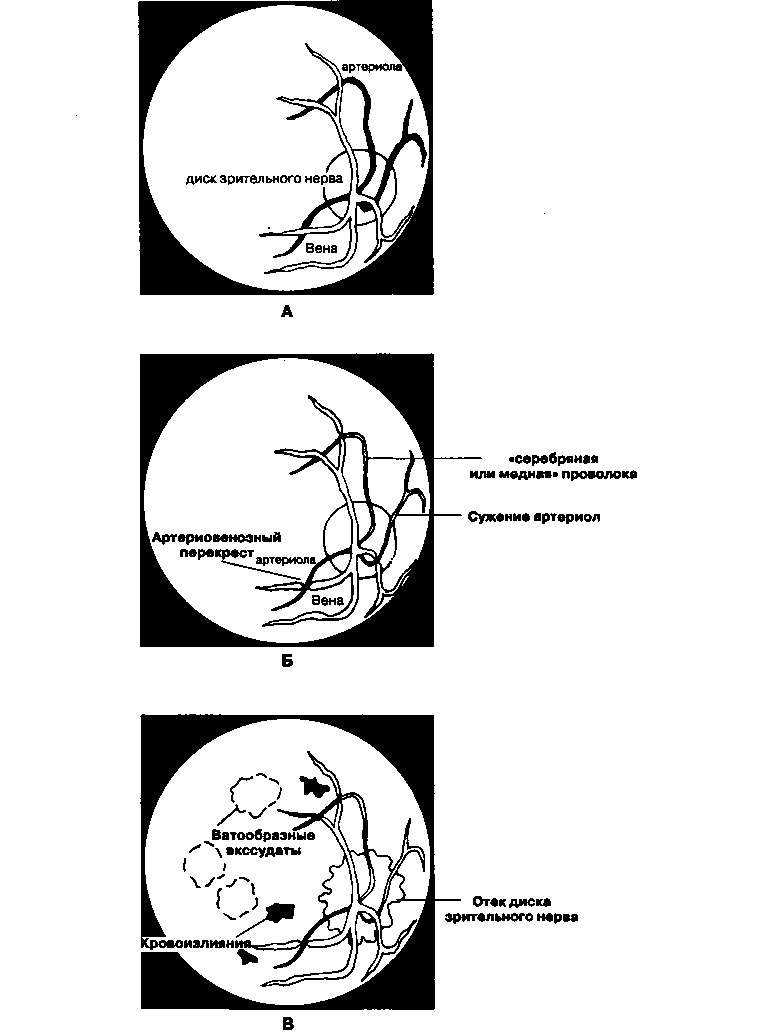
Рис. 13.9. Поражение сетчатки при остром и хроническом повышении артериального давления. А. Нормальная сетчатка. Б. Хроническая АГ: сужение артериол, артериовенозный перекрест, признаки склероза артерий (симптом «серебряной или медной» проволоки). В. Злокачественная АГ: кровоизлияния, экссудация липидов плазмы, ватообразные экссудаты (зоны инфаркта), отек диска зрительного нерва
Гипертонический криз требует неотложного медицинского вмешательства, направленного на снижение АД и предотвращение сосудистых осложнений. Купирование криза обычно приводит к исчезновению острых патологических изменений (отека диска зрительного нерва, экссудации и пр.), однако поражение почек не регрессирует.
АНТИГИПЕРТЕНЗИВНАЯ ТЕРАПИЯ
При выборе антигипертензивной терапии необходимо учитывать два обстоятельства. Во-первых, однократное повышение АД не позволяет установить диагноз АГ, поскольку уровень АД варьирует в широких пределах в течение дня. Более того, измерение АД в условиях клиники или в кабинете врача в поликлинике может дать неправильные результаты вследствие эффекта «белого халата»1, то есть повышенной тревожности больного. Для установления диагноза АГ необходимо измерить АД несколько раз, например, во время двух или трех последовательных врачебных осмотров, а также попросить больного регулярно определять уровень АД в домашних условиях.
Во-вторых, хотя АГ 1 ст. широко распространена в популяции, больные этой категории относятся к группе низкого риска. Так, дополнительный риск мозгового инсульта при АГ 1 ст. составляет не более 1:850 в год. Следовательно, прежде чем назначать медикаментозную терапию, целесообразно понаблюдать за больным в течение 2—3 месяцев и выяснить, как долго сохраняется повышенный уровень АД, можно ли нормализовать АД, изменив образ жизни больного. Эти рекомендации в первую очередь применимы к больным, не имеющим других факторов риска (курение, высокий уровень холестерина ЛНП и пр.).
Безусловно, у большинства больных наиболее действенным методом профилактики осложнений АГ является медикаментозная терапия, что, однако, не умаляет эффективности других подходов (диетотерапия, изменение образа жизни и т. д.).
Немедикаментозное лечение
СНИЖЕНИЕ МАССЫ ТЕЛА
Все существующие научные и клинические данные указывают на существование значимой корреляции между избыточной массой тела (особенно у лиц с абдоминальным ожирением) и высоким уровнем АД. Хорошо известно, что при массе тела, превышающей идеальную более чем на 10% похудение почти всегда приводит к уменьшению АД.
Связь ожирения и АГ изучена не до конца. Полагают, что частичная нормализация АД при уменьшении массы тела обусловлена снижением концентрации катехоламинов в плазме крови и, следовательно уменьшением ОПСС. Важную роль в развитии АГ у лиц с избыточной массой тела может играть гормон инсулин. Ожирение часто сочетается с инсулиноре-зистентностью и вторичной гиперинсулинемией. В свою очередь, гипе-ринсулинемия может быть причиной гормональных, электролитных и трофических нарушений, провоцирующих повышение АД (как описано ранее в этой главе).
ФИЗИЧЕСКАЯ АКТИВНОСТЬ
Риск развития АГ у лиц, ведущих малоподвижный образ жизни, на 20—50% выше, чем у физически активных людей. Регулярные физические занятия (ходьба, бег, велосипедные прогулки), помимо снижения массы тела, также способствуют нормализации АД. У занимающихся физическими тренировками больных АГ снижается ЧСС в покое и уменьшается уровень катехоламинов в плазме крови, что указывает на ослабление симпатического тонуса.
ДИЕТА
Употребление менее калорийной пищи, а также характера питания способствуют не только уменьшению массы тела, но и нормализации АД.
Натрий
Необходимость ограничения потребления поваренной соли лицам с повышенным АД остается предметом дискуссий. Вместе с тем, данные эпидемиологических и клинических исследований указывают на целесообразность ограничения потребления соли больными АГ. У лиц с нормальным АД избыток натрия выводится почками, тогда как у 50% больных АГ нарушен натрийурез, причем величина АД варьирует в зависимости от уровня потребления поваренной соли. Наиболее явно эта зависимость проявляется у негров и больных пожилого возраста. Известно, что эффективность антигипертензивной терапии повышается на фоне диеты с низким содержанием поваренной соли. В современных руководствах рекомендовано ограничить потребление поваренной соли до < 6 г NaCl/cyr-ки (<2,3 г Na/сутки), что составляет около 1/3 от среднего количества соли, употребляемого американцами в пищу.
Калий
Содержание калия в организме снижается при недостатке в пище фруктов и овощей, а также при приеме диуретиков, выводящих калий. Теоретически гипокалиемия может приводить к повышению АД, и в этих случаях больным рекомендована диета, восполняющая недостаток ионов К+ в организме. Вместе с тем не существует убедительных доказательств того, что пищевые добавки с высоким содержанием калия способствуют снижению АД у больных АГ с нормокалиемией.
Алкоголь
Злоупотребление алкоголем коррелирует с высоким АД и неэффективностью антигипертензивной терапии. Результаты экспериментальных исследований свидетельствуют о том, что уровень АД (особенно — систолического) может повышаться сразу после употребления алкоголя. Физиологические механизмы этого явления изучены недостаточно, однако известно, что отказ от чрезмерного употребления алкоголя способствует снижению АД.
Другие факторы
Высокий уровень АД коррелирует с низким потреблением кальция, недостатком магния и употреблением в пищу большого количества насыщенных жирных кислот, но лежащие в основе механизмы и их роль в лечении больных АГ остаются предметом научных исследований. Прием кофеина сопровождается временным повышением АД (на 5—15 мм рт. ст. после 2 чашек кофе), однако постоянное употребление кофе, по-видимому, не приводит к развитию хронической АГ.
КУРЕНИЕ
Курение также приводит к временному повышению АД, что связывают с действием никотина на вегетативные ганглии. Хотя курение является независимым фактором риска сердечно-сосудистых заболеваний, распространенность АГ среди курильщиков ниже, чем среди некурящих. Более того, отказ от курения нередко сочетается с небольшим увеличением АД. Полагают, что эффекты курения и отказа от него обусловлены изменением массы тела, так как курильщики обычно худее некурящих, а отказ от курения сопровождается некоторым увеличением веса. Вместе с тем, в силу атерогенного действия курения, распространенность реноваскулярной гипертензии среди лиц этой категории более высока, чем среди некурящих. Курение сопряжено со многими другими неблагоприятными последствиями, и всем больным необходимо рекомендовать отказаться от него.
РЕЛАКСАЦИОННАЯ ТЕРАПИЯ
Причиной повышения АД нередко являются стрессовые факторы. Более того, у больных ЭАГ и их ближайших родственников часто отмечают повышение тонуса симпатической нервной системы и усиление вегетативных реакций на психологический стресс. Неудивительно, что при лечении больных АГ рекомендовано применять методы релаксационной терапии (медитация, метод обратной биологической связи). Эффективность этих методов в значительной мере зависит от желания больного и его готовности следовать назначениям врача.
Существует большое количество немедикаментозных методов лечения больных АГ. Эти методы лишены таких недостатков медикаментозной терапии, как высокая стоимость препаратов и их побочные эффекты.
Эффективность нелекарственных методов лечения не должна вызывать удивление, учитывая, что в развитии АГ важную роль играют неблагоприятные внешние факторы. Лечение, в основе которого лежит изменение образа жизни, в первую очередь показано больным с легкой и умеренной АГ, не представляющей непосредственной угрозы для жизни и здоровья.
Медикаментозная терапия
Антигипертензивные препараты применяют для снижения АД, когда методы немедикаментозной терапии оказываются неэффективны. В настоящее время доступно более 100 разных антигипертензивных препаратов, но в клинической практике наиболее широкое распространение получили лекарственные средства четырех классов: диуретики, симпато-литики, вазодилататоры и препараты, влияющие на активность ренин-ан-гиотензиновой системы (таблица 13.4). Механизмы антигипертензивного действия препаратов этих классов показаны на рис. 13.10, а их фармакологические свойства подробно описаны в главе 17.
Диуретики в течение многих лет с успехом применяли в лечении больных АГ. Препараты этого класса снижают объем циркулирующей крови, СВ, среднее АД; они наиболее эффективны у больных легкой и умеренной АГ без нарушения функции почек. Диуретики высокоэффективны при лечении больных пожилого возраста и негров (больные этих групп наиболее чувствительны к уровню натрия). По данным долгосрочных клинических исследований, терапия диуретиками способствует снижению частоты осложнений и смертности среди больных АГ, при этом стоимость диуретиков ниже, чем других антигипертензивных препаратов. Тиазидные (гидро-хлортиазид) и калийсберегающие (спиронолактон) диуретики усиливают выведение Na+ и СГ почками. Петлевые диуретики (фуросемид) оказывают слишком выраженное и кратковременное действие, что ограничивает их применение в качестве антигипертензивных средств.
Таблица 13.4. Классы антигипертензивных препаратов
Класс |
Группа (глава 17) |
Диуретики |
Тиазидные Антагонисты альдостерона |
Симпатолитики |
а2-адреностимуляторы центрального действия Периферические а!-адреноблокаторы p-адреноблокаторы а-р-адреноблокаторы |
Вазодилататоры |
Антагонисты кальция Прямые вазодилататоры (гидралазин, миноксидил) |
Антагонисты ренин-ан-гиотензиновой системы |
Ингибиторы АПФ Антагонисты рецепторов ангиотензина II |
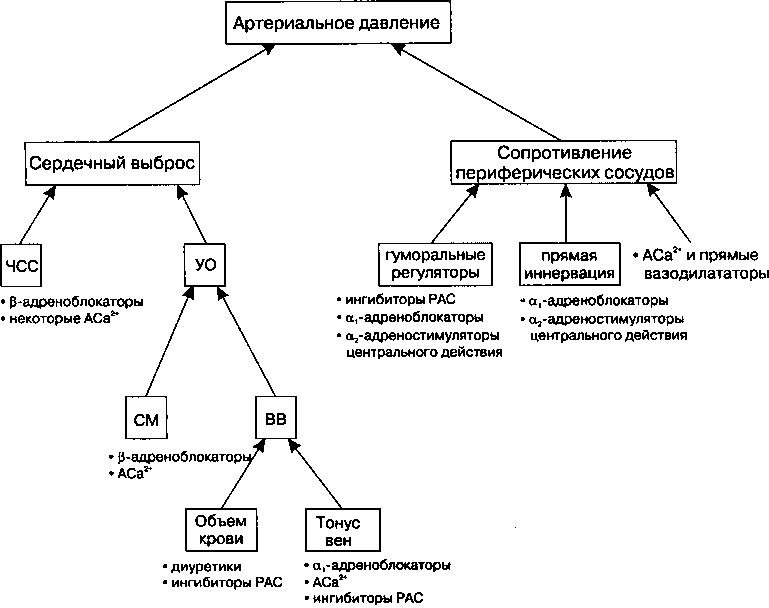
Рис. 13.10. Физиологические эффекты антигипертензивных препаратов. Некоторые антигипертензивные препараты обладают несколькими механизмами действия. ЧСС — частота сердечных сокращений; УО — ударный объем; СМ — сократимость миокарда; ВВ — венозный возврат; АСа2+, антагонисты Са2+; Ингибиторы РАС' — ингибиторы ренин-ангиотен-зиновой системы (например, ингибиторы АПФ и антагонисты рецепторов ангиотензина П)
К типичным побочным эффектам диуретиков относят повышение уровня глюкозы, холестерина и триглицеридов в плазме крови. Более того, у больных на фоне приема диуретиков нередко развивается гипокалиемия, гиперурикемия и нарушается половая функция. Назначение препаратов этого класса в минимальной дозе позволяет добиться желательного антигипертензивного эффекта и снизить риск побочных реакций.
Симпатолитики препятствуют сужению периферических сосудов, снижают ЧСС и уменьшают сократимость миокарда (глава 17). Альфа2-адре-ностимуляторы центрального действия (метилдопа, клонидин) ослабляют симпатический тонус сердца, сосудов и почек. Эти препараты оказывают выраженное побочное действие и в современной клинической практике применяются редко. Антагонисты адренергических рецепторов, используемые в качестве антигипертензивных средств, делятся на два класса: ари 0-адреноблокаторы. at-адреноблокаторы (празозин) вызывают расслабление гладких мышц и тем самым снижают ОПСС. 0-адреноблокаторы (пропранолол) уменьшают ЧСС и сократимость миокарда, что приводит к снижению СВ. Кроме того, препараты этого класса ингибируют секрецию ренина (и, следовательно — ангиотензина II), в результате чего уменьшается ОПСС. Типичными побочными эффектами р-адреноблокаторов являются слабость, импотенция и гипергликемия. Препараты этого класса неблагоприятно влияют на метаболизм липидов: на фоне приема большинства p-адреноблокаторов повышается уровень триглицеридов и снижается концентрация холестерина ЛВР. Необходимо отметить, что р-адренобло-каторы с внутренней симпатомиметической активностью или способные также блокировать а-адренорецепторы, не оказывают неблагоприятного влияния на уровень холестерина ЛВП.
Кроме того, в повседневной клинической практике широко применяются периферические вазодилататоры — антагонисты кальция, гидралазин и миноксидил. Антагонисты кальция блокируют вход Са++ в кардиомиоциты и гладкомышечные клетки, снижая их способность к сокращению (глава 17). Больным АГ часто назначают антагонисты кальция пролонгированного действия (препараты, принимаемые один раз в сутки). Препараты короткого действия для терапии АГ в настоящее время не используют, поскольку они менее удобны (прием 2—3 раза/сутки) и могут увеличивать риск сердечно-сосудистых осложнений (имеются данные об увеличении частоты инфаркта миокарда на фоне приема антагонистов кальция короткого действия). Гидралазин и миноксидил оказывают прямое расслабляющее действие на гладкие мышцы прекапиллярных артериол. После внедрения в практику препаратов новых классов, обладающих менее выраженными побочными эффектами, гидралазин и миноксидил стали все реже использовать при лечении больных АГ.
Ингибиторы ангиотензинпревращающего фермента (АПФ) и антагонисты рецепторов ангиотензина II — это препараты, влияющие на активность ренин-ангиотензиновой системы. Ингибиторы АПФ препятствуют превращению ангиотензина I в ангиотензин II (мощный вазоконстриктор, рис. 13.6) и снижают секрецию альдостерона. На фоне приема ингибиторов АПФ снижается ОПСС и реабсорбция натрия в почечных канальцах. Кроме того, антигипертензивный эффект ингибиторов АПФ связывают с повышением в плазме крови концентрации вазодилататора брадикинина (глава 17). Как правило, больные хорошо переносят препараты этого класса, и в последние годы ингибиторы АПФ все чаще применяются в повседневной практике. Показано, что терапия ингибиторами АПФ способствует снижению смертности среди больных инфарктом миокарда и хронической систолической сердечной недостаточностью (глава 9). Более того, эти препараты могут улучшать функцию почек у больных с диабетической нефропатией. Наиболее частые побочные эффекты терапии ингибиторами АПФ — преходящий сухой кашель (по-видимому, вследствие повышения концентрации брадикинина), гипокалиемия и азотемия (глава 17).
Антагонисты рецепторов ангиотензина II — это новый класс антигипертензивных препаратов, которые блокируют связывание ангиотензина II со специфическими рецепторами (например, ATj) в кровеносны^ сосудах и других органах (рис. 13.6). Антигипертензивный эффект этих препаратов связан с ингибированием действия ангиотензина II, что сопровождается расширением сосудов и снижением секреции альдостерона. По результатам клинических исследований, антигипертензивная эффективность ингибиторов АПФ и антагонистов рецепторов ангиотензина II примерно одинакова. К преимуществам антагонистов рецепторов ангиотензина II следует отнести отсутствие такого побочного эффекта как сухой кашель.
Большое количество доступных антигипертензивных препаратов нередко затрудняет выбор наиболее эффективного лекарственного средства для начала лечения данного больного. Согласно рекомендациям the Joint National Committee on Detection, Evaluation and Treatment of High Blood Pressure, к препаратам первого ряда относятся диуретики, р-адреноблока-торы, ингибиторы АПФ, антагонисты кальция, 04-адреноблокаторы и препараты, блокирующие как а-, так и p-адренорецепторы. Вместе с тем, отмечается, что лечение больных АГ следует начинать с назначения диуретиков или p-адреноблокаторов. Результаты клинических исследований указывают на то, что терапия этими препаратами сопровождается снижением заболеваемости и смертности, а их стоимость значительно ниже стоимости других антигипертензивных средств. Эти рекомендации остаются предметом дискуссий, поскольку существуют антигипертензивные препараты других классов, не менее эффективные и лучше переносимые, чем диуретики и p-адреноблокаторы. В большинстве случаев медикаментозная терапия АГ проводится в течение многих лет, поэтому при выборе антигипертензивного препарата крайне важно учитывать его побочное действие и влияние проводимого лечения на качество жизни больных.
Существуют и другие принципы выбора антигипертензивного препарата. Во-первых, предлагаемая схема лечения должна соответствовать состоянию больного. Например, больному молодого возраста с симптомами тревоги и АГ в «гиперкинетической» фазе целесообразно назначить р-ад-реноблокаторы. В более старшем возрасте, когда уровень АД будет зависеть, в основном, от сопротивления периферических сосудов, тот же больной может получать терапию вазодилататорами (например, антагонистами кальция пролонгированного действия).
Другим важным принципом антигипертензивной терапии является назначение нескольких препаратов в комбинации, поскольку действие одного лекарственного средства может быть ослаблено в результате активации естественных компенсаторных реакций организма. Например, снижение кровоснабжения почек на фоне приема гидралазина (прямой вазодилататор) может сопровождаться компенсаторной активацией ренин-ангиотензиновой системы, задержкой воды в организме и, следовательно, уменьшением антигипертензивного эффекта. Назначение препаратов с разными механизмами действия позволяет решить эту проблему. Например, для предотвращения нежелательного увеличения объема циркулирующей крови прямые вазодилататоры нередко назначают в комбинации с диуретиками в низких дозах.
Артериальная гипертензия — это одна из наиболее важных проблем современной медицины. Артериальная гипертензия характеризуется высокой распространенностью, часто приводит к тяжелым осложнениям и нередко имеет неясную этиологию. Обследование и лечение больных АГ невозможно без понимания причин нарушения нормальной физиологии сердечно-сосудистой системы. Однако, поскольку этиология АГ у большинства больных неизвестна, это заболевание остается предметом творческих размышлений и интенсивных научных исследований.
ЗАКЛЮЧЕНИЕ
1. Артериальная гипертензия — стойкое повышение диастолического (> 90 мм рт.ст.) и/или систолического (> 140 мм рт.ст.) артериального давления.
2. В 95% случаев этиология АГ неизвестна («эссенциальная АГ»), Типичные причины вторичной АГ: 1) поражение паренхимы почек, 2) реноваскулярная гипертензия, 3) феохромоцитома, 4) коарктация аорты, 5) первичный альдостеронизм.
3. У большинства больных АГ протекает бессимптомно, вплоть до развития осложнений. Осложнения АГ: 1) мозговой инсульт, 2) инфаркт миокарда, 3) сердечная недостаточность, 4) аневризма и расслаивающая аневризма аорты, 5) поражение почек, 6) ретинопатия.
4. Лечение больных АГ включает изменение образа жизни, характера питания и, при необходимости, медикаментозную терапию. К препаратам первого ряда в настоящее время относят диуретики, 0-адреноблокато-ры, ингибиторы АПФ, антагонисты кальция пролонгированного действия и aj-адреноблокаторы.