Патофизиологические механизмы аритмий сердца
В основе нормального функционирования сердца лежит координированное образование и проведение по миокарду электрических импульсов. Нарушения ритма сердца — аритмии или дизритмии, относятся к числу наиболее распространенных заболеваний сердечно-сосудистой системы. Проявления аритмий сердца варьируют от неопасного сердцебиения до симптомов низкого сердечного выброса и смерти. Очевидно, что хорошее понимание патофизиологии этих нарушений, умение диагностировать и лечить аритмии имеет большое значение в повседневной медицинской практике.
В этой главе описываются патофизиологические механизмы развития и основные принципы лечения аритмий. Следующая глава посвящена отдельным нарушениям сердечного ритма и методам их диагностики.
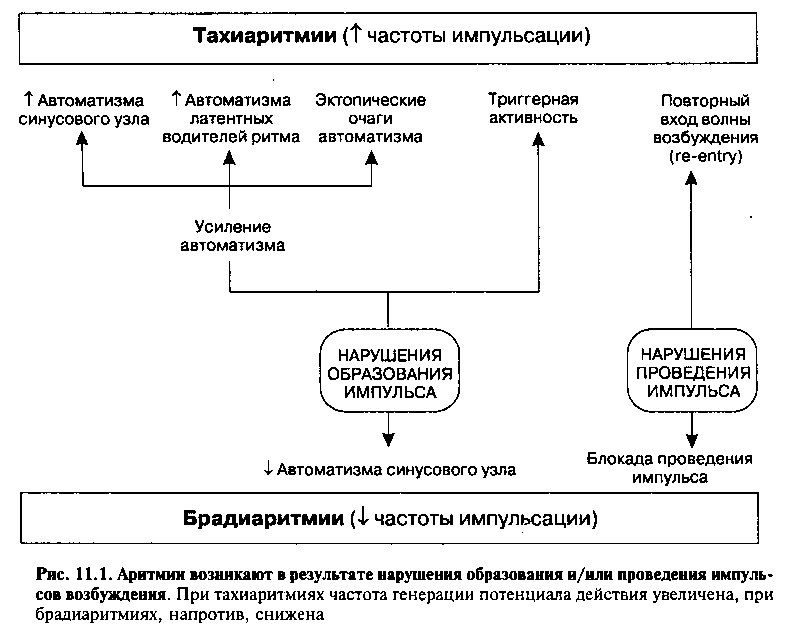
Аритмии возникают в результате нарушения образования и/или проведения импульса. Вначале мы более подробно остановимся на причинах нарушений образования и проведения импульса, а затем рассмотрим условия возникновения аритмий. Основные положения настоящей главы схематически представлены на рисунке 1.
ФОРМИРОВАНИЕ ИМПУЛЬСА В НОРМЕ
В главе 1 отмечалось, что образование электрического импульса связано с автоматизмом специализированных клеток миокарда. Автоматизм — это способность клеток к ритмической деполяризации до величины, соответствующей пороговому потенциалу, достаточному для возникновения спонтанного потенциала действия. В нормальных условиях кардиомиоциты предсердий и желудочков не обладают автоматизмом, и за образование импульса возбуждения ответственны специализированные клетки проводящей системы сердца, называемые пейсмекеры (водители ритма). Проводящая система сердца включает клетки синусового и атриовентрикулярного узлов, а также — проводящих путей желудочков. Проводящие пути желудочков образованы пучком Гиса, его ножками и волокнами Пуркинье. При некоторых патологических состояниях кардиомиоциты, не относящиеся к проводящей системе сердца, могут приобретать способность к автоматизму.
Ионные основы автоматизма
Способные к автоматизму клетки не имеют постоянного потенциала покоя. Во время 4 фазы деполяризации потенциал действия таких клеток медленно уменьшается (рис. 11.2), что соответствует спонтанной диастолической деполяризации клеточной мембраны. Фаза 4 деполяризации обусловлена током ионов через плазматическую мембрану, который называется пейсмекерным током (If). Этот ток возникает в результате переноса ионов натрия через специальные мембранные каналы, открывающиеся во время реполяризации клеток (т. е. когда разность потенциалов между внутренней и внешней поверхностью мембраны превышает 50 мВ). Необходимо отметить, что эти натриевые каналы отличаются от быстрых натриевых каналов, ответственных за фазу быстрой деполяризации мембраны (фаза 0) обычных кардиомиоцитов. Медленный ток ионов Na+ под действием электрохимической движущей силы (которая зависит от градиента концентрации ионов Na+ и суммарного отрицательного заряда внутри клетки) приводит к деполяризации мембраны до порогового потенциала.
Фаза 4 деполяризации клеток-пейсмекеров синусового узла, кроме тока ионов Na+, обусловлена 1) медленным током ионов Са++ в клетки через потенциал-зависимые каналы, открывающиеся в конце фазы 4 и 2) уменьшающимся током ионов К+ из клеток. Выход ионов К+ усиливается во время фазы 3 потенциала действия, приводя к реполяризации мембраны, и уменьшается во время фазы 4. Вход ионов Na+ и Са++ и выход ионов К+ сопровождаются постепенной деполяризацией мембраны клеток синусового узла до величины, соответствующей пороговому потенциалу.
Потенциал действия возникает, когда трансмембранный потенциал клеток-пейсмекеров достигает пороговой величины. В отличие от фазы 0 деполяризации мембраны обычных кардиомиоцитов, потенциал действия клеток-пейсмекеров генерируется значительно медленнее (сравните рис. 11.2 и 11.3). Причина этого заключается в том, что отрицательный трансмембранный потенциал клеток-пейсмекеров всегда меньше, чем трансмембранный потенциал кардиомиоцитов предсердий и желудочков (который может достигать — 90мВ). Как следствие, быстрые натриевые каналы клеток-пейсмекеров практически всегда закрыты, и образование потенциала действия в этих клетках обусловлено, в основном, медленным током ионов Са++ через потенциалзависимые каналы.
Реполяризация мембраны клеток-пейсмекеров происходит в результате закрытия кальциевых каналов и выхода ионов К+ из клеток через потенциалзависимые калиевые каналы.
Номотопный и латентные водители ритма
Проводящие пути сердца образованы гетерогенной популяцией клеток, обладающих разной собственной частотой генерации импульсов. Частота образования импульсов зависит от скорости деполяризации клеточной мембраны до пороговой величины и определяется 1) продолжительностью фазы 4 спонтанной деполяризации, 2) максимальным отрицательным диастолическим потенциалом и 3) величиной порогового потенциала. При большой величине отрицательного диастолического потенциала или менее отрицательном пороговом потенциале частота генерации импульсов снижается, т. к. в этом случае требуется больше времени для деполяризации мембраны до пороговой величины (рис. 11.3). Напротив, чем больше ток If, тем короче фаза 4 и тем быстрее происходит деполяризация клетки. Величина тока ^определяется количеством и кинетическими

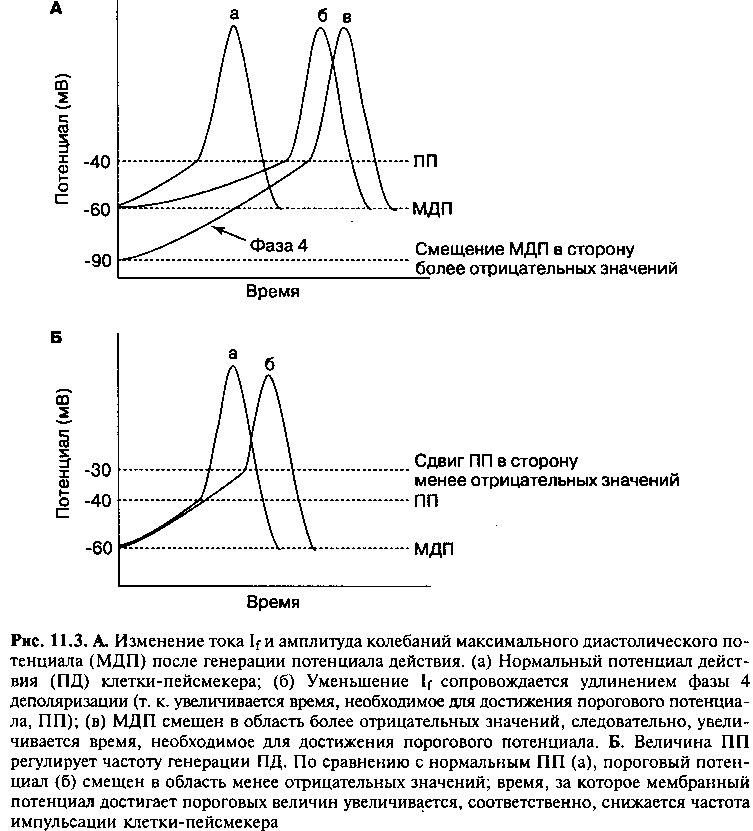
характеристиками ионных каналов, через которые протекает этот ток. Следовательно, клетки, имеющие большое количество активных «пейсмекерных» каналов, способны генерировать импульсы с большей частотой.
Все нормальные кардиомиоциты контактируют друг с другом посредством электрических синапсов (щелевых контактов), через которые потенциал действия может быстро распространяться по миокарду. Импульс, приходящий в кардиомиоцит, мембрана которого еще не деполяризирована, генерирует новый потенциал действия, независимо от того, какой трансмембранный потенциал имела клетка в этот момент. Таким образом, частота сердечных сокращений (ЧСС) определяется активностью клеток-пейсмекеров, в которых деполяризация плазматической мембраны происходит наиболее быстро. В норме водителем ритма сердечных сокращений является синусовый узел, клетки которого генерируют импульсы с частотой 60—100 мин-1. Синусовый узел, обладающий наибольшей частотой импульсации, подавляет спонтанную активность других очагов автоматизма сердца.
Синусовый узел является номотопным водителем ритма, устанавливающим частоту сокращения сердца в норме. Другие клетки, входящие в состав проводящей системы сердца, при определенных условиях также могут выступать в качестве водителей ритма и называются латентными (или эктопическими) водителями ритма. В отличие от синусового узла, клетки атриовентрикулярного узла и ножек пучка Гиса генерируют импульсы с частотой 50—60 мин-1, а клетки волокон Пуркинье — 30—40 мин-1. При поражении синусового узла или нарушениях проводимости, препятствующих прохождению волны деполяризации, эти латентные очаги автоматизма становятся основными водителями ритма, задавая частоту сокращений сердца в соответствии с собственной частотой генерации импульсов.
Подавление автоматизма латентных водителей ритма (overdrive suppresion)
Клетки, обладающие наибольшей собственной частотой импульсации, не только препятствуют спонтанной активности других клеток-пейсмекеров, но и подавляют все эктопические очаги автоматизма в пределах проводящей системы сердца. Ионный градиент по разную сторону сарколеммы поддерживается за счет постоянной работы 1Ча+/К+-АТФазы, которая удаляет 3 иона Na+ из клетки в обмен на перенос 2 ионов К+ в клетку (рис. 11.4). Работа 1Ча+/К+-АТФазы приводит в итоге к переносу одного положительного заряда из цитоплазмы в окружающую среду, а это сопровождается появлением мембранного потенциала и тока гиперполяризации (который поддерживает более отрицательный заряд внутри клетки). Этот ток препятствует спонтанной деполяризации мембраны клеток-пейсмекеров, однако ток If в таких клетках превышает ток гиперполяризации, поэтому через некоторое время мембрана вновь деполяризуется, и клетки продолжают с собственной частотой генерировать импульсы (рис. 11.4).
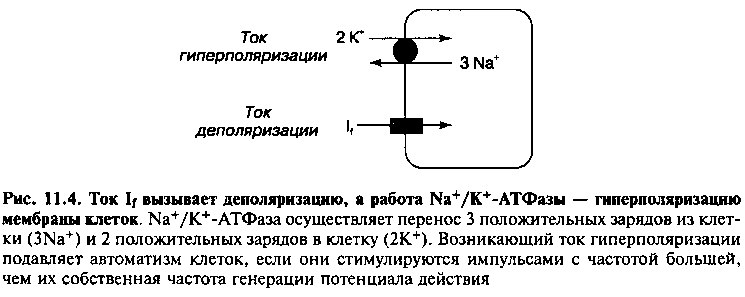
Когда под действием внешних импульсов клетки-пейсмекеры вынуждены генерировать импульсы с большей, чем собственная частотой, равновесие между токами гиперполяризации и деполяризации нарушается. Чем больше частота деполяризации мембраны, тем больше ионов Na+ входит в клетку за единицу времени. Как следствие, повышается активность Ма+/К+-АТФазы, которая восстанавливает нормальный трансмембранный градиент концентрации ионов Na+. Повышение активности натрий-калиевого насоса сопровождается усилением тока гиперполяризации до величины, сопоставимой с током деполяризации (If). Равновесие в таких клетках смещается в сторону гиперполяризации мембраны (т. е. увеличения максимального отрицательного трансмембранного потенциала), соответственно, увеличивается продолжительность фазы 4 спонтанной деполяризации (рис. 11.ЗА), и клетки самопроизвольно начинают генерировать потенциалы действия с меньшей частотой. Таким образом, внешние учащенные импульсы подавляют автоматизм эктопических очагов, клетки которых вы-нуждены генерировать импульсы с частотой, больше их собственной. Следовательно, клетки, обладающие наибольшей собственной частотой импульсации (пейсмекеры первого порядка), не только устанавливают ритм образования импульсов в других клетках проводящей системы (пейсмеке-рах второго порядка), но и подавляют автоматизм этих клеток.
Электротонические взаимодействия
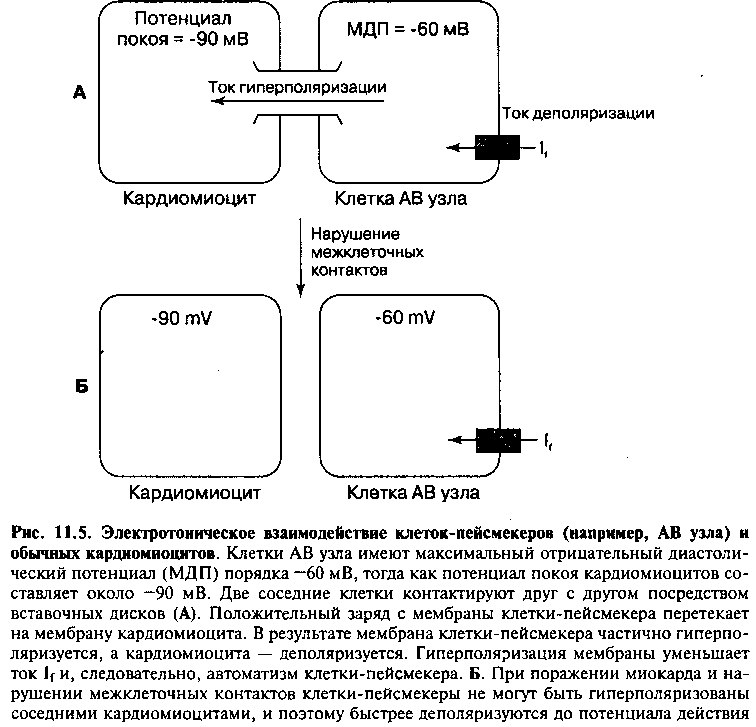
По данным экспериментальных исследований, кроме управляющих импульсов пейсмекеров первого порядка, важную роль в подавлении эктопических очагов автоматизма играют анатомические контакты между клетками-пейсмекерами и обычными кардиомиоцитами. Мембрана обычных кардиомиоцитов, не являющихся частью проводящей системы, репо-ляризуется до потенциала покоя равного —90мВ, тогда как максимальный отрицательный диастолический потенциал клеток-пейсмекеров составляет примерно —60 мВ. Клетки двух типов могут контактировать друг с другом посредством вставочных дисков, обеспечивающих электрическое сопряжение клеточных мембран. В результате электрического сопряжения ток гиперполяризации перетекает с мембраны клеток-пейсмекеров на мембрану кардиомиоцитов, стремясь уравнять трансмембранные потенциалы двух клеток (рис. 11.5). Более того, ток гиперполяризации, направленный в сторону противоположную току If, уменьшает автоматизм клетки. Этот механизм имеет особенно большое значение при подавлении автоматизма атриовентрикулярного (АВ) узла (за счет контактов между кардиомиоцитами предсердий и клетками АВ узла), а также при ингибировании спонтанной активности в дистальных отделах волокон Пуркинье (которые анатомически связаны с кардиомиоцитами желудочков). Разобщение этого ингибирующего механизма (например, вследствие ишемического поражения миокарда) ведет к усилению автоматизма клеток-пейсмекеров второго порядка и возникновению эктопического ритма сердечных сокращений.
НАРУШЕНИЯ ОБРАЗОВАНИЯ ИМПУЛЬСА
Одной из причин аритмии служит нарушение образования импульса в синусовом узле или других очагах автоматизма сердца (специализированных проводящих путях, эктопических очагах автоматизма). К аритмиям чаще всего приводят два нарушения образования импульса: 1) нарушения автоматизма (синусового узла, эктопических очагов в пределах проводящей системы, появление патологических центров автоматизма в предсердиях или желудочках сердца) и 2) триггерная активность.
Нарушение автоматизма синусового узла
Частота генерации импульсов в синусовом узле и латентных очагах автоматизма проводящей системы сердца регулируется, в основном, нейроэндокринными факторами.
УСИЛЕНИЕ АВТОМАТИЗМА СИНУСОВОГО УЗЛА
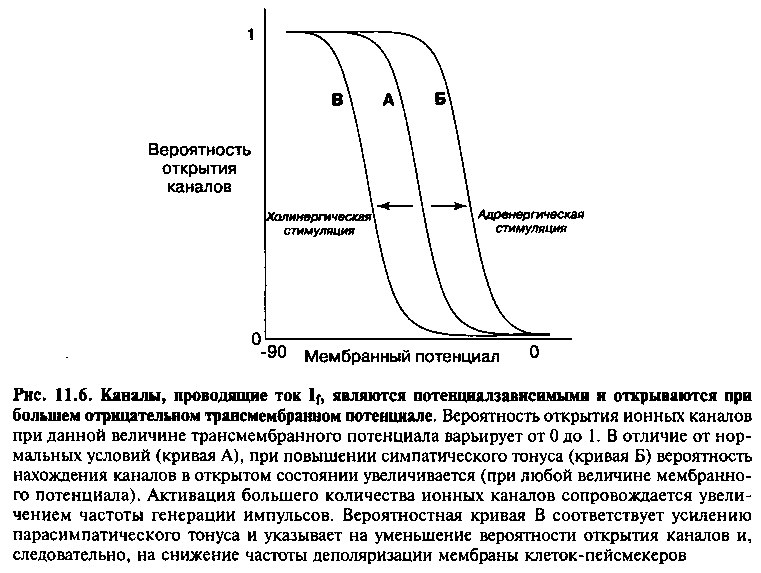
Главная роль в регуляции автоматизма синусового узла принадлежит вегетативной нервной системе. При усилении симпатического тонуса или увеличении концентрации катехоламинов, взаимодействующих с [^-адренорецепторами, возрастает вероятность того, что ионные каналы клеток-пейсмекеров будут находиться в активном (открытом) состоянии (рис. 11.6). Следовательно, пока отрицательный трансмембранный потенциал клеток превышает пороговый, количество открытых «пейсме-керных» ионных каналов после симпатической стимуляции должно быть больше, чем до стимуляции. Открытие большего количества ионных каналов приводит к усилению тока If и уменьшению продолжительности фазы 4 деполяризации. В этом случае мембранный потенциал клеток быстрее достигает пороговой величины, и синусовый узел начинает генерировать импульсы с большей частотой, что приводит к увеличению ЧСС.
Кроме того, активация симпатической нервной системы увеличивает вероятность открытия потенциалзависимых Са++ каналов, при этом пороговый потенциал смещается в область более отрицательных значений (напомним, что именно перенос ионов кальция создает электрический ток во время фазы 0 деполяризации мембраны клеток-пейсмекеров). Таким образом, адренергическая стимуляция приводит к усилению автоматизма синусового узла, смещая пороговый потенциал в область более
Примером действия этого механизма служат физиологические реакции во время физической нагрузки или эмоционального стресса, когда активация симпатической нервной системы сопровождается увеличением ЧСС.
СНИЖЕНИЕ АВТОМА ТИЗМА СИНУСОВОГО УЗЛА
Снижение автоматизма синусового узла чаще всего обусловлено активацией парасимпатической нервной системы (функционально парасимпатическая нервная система — антагонист симпатической системы). Если симпатическая нервная система регулирует ЧСС во время стресса, то парасимпатическая система определяет частоту сокращений в состоянии покоя.
При холинергической (парасимпатической) стимуляции, передающейся синусовому узлу по волокнам блуждающего нерва, уменьшается вероятность нахождения «пейсмекерных» ионных каналов в активном состоянии (рис. 11.6). Как следствие, снижается сила тока If, увеличивается продолжительность фазы 4 деполяризации, и уменьшается собственная частота импульсации клеток синусового узла. Кроме того, в этом случае потенциал-зависимые Са++ каналы с большей вероятностью будут находиться в закрытом состоянии, и, следовательно, пороговый потенциал сместится в область менее отрицательных значений (т. е. разность между потенциалом покоя и пороговым потенциалом увеличится). С другой стороны, при холинергической стимуляции увеличивается вероятность открытия определенных типов К+ каналов, которые переносят положительные ионы калия из клеток в окружающую среду, что сопровождается гиперполяризацией мембраны и увеличением максимального отрицательного диастолического потенциала. Уменьшение силы тока If, увеличение максимального отрицательного диастолического потенциала и смещение порогового потенциала в область менее отрицательных значений приводят к снижению собственной частоты импульсации клеток синусового узла (подавлению автоматизма) и, следовательно, к уменьшению ЧСС.
Очевидно, что лекарственные средства, влияющие на активность вегетативной нервной системы, могут регулировать частоту импульсов, генерируемых синусовым узлом. Например, на фоне приема бета-адреноблокаторов снижается симпатический тонус, замедляется фаза 4 деполяризации и снижается ЧСС. Напротив, препараты, обладающие антихолинергиче-скими свойствами (атропин) и снижающие тонус блуждающего нерва, ускоряют фазу 4 деполяризации и увеличивают ЧСС.
Замещающие ритмы
При урежении частоты импульсации синусового узла основным водителем ритма обычно становится один из нижележащих очагов автоматизма в проводящей системе сердца. Сокращение сердца, вызванное импульсом из такого латентного очага, называют замещающим (или выскальзывающим), а последовательность сокращений при стойком нарушении образования импульсов в синусовом узле — замещающим (или выскальзывающим) ритмом. Замещающие ритмы выполняют защитную функцию, поддерживая относительно высокую ЧСС при выраженном замедлении импульса-ции из синусового узла.
Ранее отмечалось, что подавление автоматизма синусового узла может быть следствием активации парасимпатической нервной системы. Вместе с тем, разные участки сердца имеют разную чувствительность к медиатору парасимпатической нервной системы ацетилхолину. Наиболее чувствительны к парасимпатической иннервации синусовый и АВ узлы, чувствительность проводящей системы предсердий несколько меньше. Проводящая система желудочков наименее чувствительна к действию ацетилхолина. Умеренная парасимпатическая стимуляция замедляет синусовый узел, и водитель ритма мигрирует в другие очаги автоматизма в предсердиях. Выраженное повышение парасимпатического тонуса не только уменьшает автоматизм синусового узла и эктопических очагов в предсердиях, но может блокировать проведение импульсов к АВ узлу, что приводит к появлению желудочкового замещающего ритма.
Повышение автоматизма латентных водителей ритма
Латентные водители ритма могут определять ЧСС, если их собственная скорость деполяризации будет больше частоты импульсации синусового узла. Термин эктопический импульс (или экстрасистола) обозначает преждевременное появление электрического импульса (т. е. раньше, чем должно быть при нормальном ритме сердечных сокращений). В отличие от этого, замещающий импульс и замещающее сокращение сердца наблюдается позже, чем должно быть при нормальном ритме, компенсируя паузу в сокращениях сердца, вызванную замедлением синусового узла. Последовательность эктопических импульсов называется эктопическим ритмом.
Причины возникновения эктопического ритма различны. Например, на фоне высокой концентрации катехоламинов может усиливаться автоматизм латентных водителей ритма, и если результирующая частота их деполяризации оказывается больше частоты импульсации синусового узла, то появляется эктопический ритм. Кроме того, эктопические ритмы часто наблюдаются во время эпизодов гипоксии или ишемии миокарда, при электролитных нарушениях, а также как следствие побочного действия некоторых препаратов (например, сердечных гликозидов, глава 17).
Патологические очаги автоматизма
При поражении миокарда некоторые кардиомиоциты, не принадлежащие к проводящей системе сердца, могут приобретать патологическую способность к автоматизму и спонтанной деполяризации мембраны. Процессы генерации импульсов измененными кардиомиоцитами и латентными водителями ритма проводящей системы во многом схожи, однако необходимо помнить, что изначально клетки этих эктопических очагов не обладали автоматизмом. Если скорость деполяризации кардиомиоцитов превышает частоту генерации импульсов клетками синусового узла, то эти очаги автоматизма могут временно устанавливать собственную частоту сокращений сердца, становясь источником эктопических ритмов.
Обычные кардиомиоциты имеют мало (или не имеют вовсе) «пейсме-керных» ионных каналов, поэтому в норме в них отсутствует мембранный ток If. Почему при поражении кардиомиоцитов плазматическая мембрана приобретает способность к спонтанной деполяризации — пока неясно. Полагают, что в этом случае нарушается целостность мембраны, и такие клетки утрачивают способность поддерживать нормальный трансмембранный градиент концентрации ионов. Как следствие, мембрана постоянно находится в частично деполяризованном состоянии, что сопровождается некоторым уменьшением отрицательного потенциала покоя. Уменьшение отрицательного потенциала покоя до —60 мВ сопровождается медленной деполяризацией (фаза 4), в том числе и в клетках, не обладающих автоматизмом. Спонтанная деполяризация мембраны кардиомиоцитов по-види-мому, обусловлена открытием медленных кальциевых каналов и закрытием тех К+ каналов, которые участвуют в реполяризации клеток.
Триггерная активность
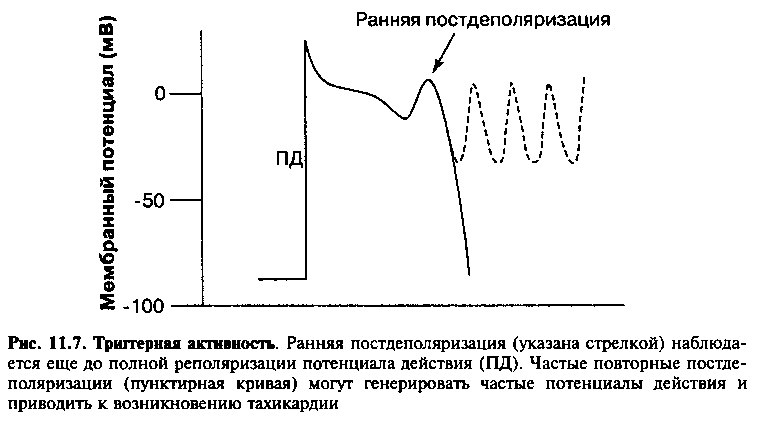
В некоторых случаях нормальный потенциал действия может вызывать дополнительные деполяризации, что сопровождается увеличением частоты сердечных сокращений или желудочковой тахикардией. Это явление, называемое постдеполяризацией, наблюдается тогда, когда первый потенциал действия приводит к быстрым колебаниям трансмембранного потенциала кардиомиоцитов. Различают два типа постдеполяризации (рис. 11.7 и 11.8). Ранняя постдеполяризация возникает в фазу реполяризации потенциала действия. Поздняя постдеполяризация наблюдается вскоре после завершения реполяризации мембраны клеток. В обоих случаях, если постдеполяризация достигает величины порогового потенциала, то клетки генерируют дополнительные потенциалы действия. Эктопический ритм, обусловленный постдеполяризацией, отличается от ритма, источником которого является очаг повышенного автоматизма (последний не зависит от первоначального импульса возбуждения).
Ранние постдеполяризации — это быстрые колебания мембранного потенциала в сторону положительных значений во время фазы реполяризации (рис. 11.7). Постдеполяризации могут наблюдаться как в фазу плато потенциала действия (фаза 2), так и во время быстрой реполяризации (фаза 3). Ранние постдеполяризации желудочков чаще всего наблюдаются при состояниях, сопровождающихся удлинением потенциала действия (и, следовательно — увеличением интервала QT на электрокардиограмме), например, на фоне терапии некоторыми препаратами (см. главу 17).
Какой именно ионный ток вызывает ранние постдеполяризации, определяется тем, при какой величине мембранного потенциала возник импульс
возбуждения. Так, ранние постдеполяризации в фазу плато потенциала действия (фаза 2) связаны с медленным входом в клетку ионов кальция, поскольку большинство Na+ каналов в этот момент закрыты. Напротив, ранние постдеполяризации во время фазы 3 (когда отрицательный мембранный потенциал постепенно увеличивается) обусловлены электрическим током, создаваемым при открытии части быстрых Na+ каналов.
Потенциал действия, возникающий во время постдеполяризаций, является самоподдерживающимся, вызывая серии последовательных деполяризаций мембраны. Полагают, что продолжительные серии ранних постдеполяризаций лежат в основе пируэтной тахикардии (torsades de pointed), которая подробно описана в следующей главе.
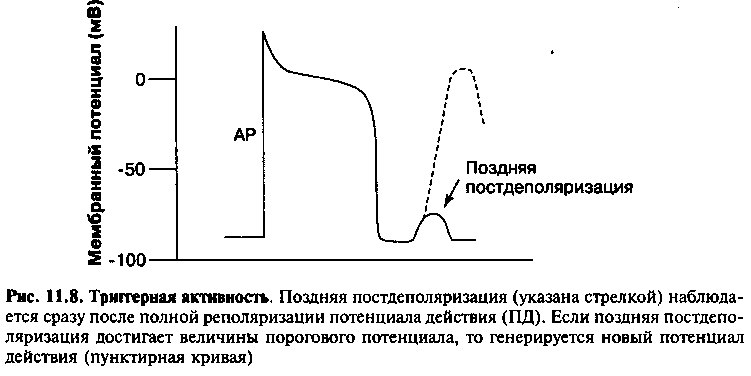
Поздние постдеполяризации возникают вскоре после завершения фазы реполяризации (рис. 11.8). Чаще всего их причиной служит повышение концентрации внутриклеточного кальция, например при дигиталисной интоксикации (глава 17) или при высоком уровне катехоламинов в плазме крови. Накопление внутриклеточного кальция посредством пока плохо изученных механизмов активирует некоторые Na+ каналы, и ток, создаваемый переносом ионов натрия в клетку, вызывает поздние постдеполяризации.
Как и в случае ранних постдеполяризаций, поздние постдеполяризации могут приводить к образованию потенциала действия (если мембранный потенциал достигнет пороговой величины). Эти потенциалы действия также являются самоподдерживающимися, вызывая продолжительные серии деполяризации мембраны клеток, клиническим проявлением которых являются тахиаритмии. Считают, что поздняя постдеполяризация лежит в основе аритмий, возникающих при дигиталисной интоксикации (глава 17).
НАРУШЕНИЯ ПРОВЕДЕНИЯ ИМПУЛЬСА
Другая причина возникновения аритмий — нарушения проведения импульса. Механизмы, лежащие в основе этих нарушений, включают 1) блокаду проведения импульса и 2) повторный вход волны возбуждения (re-entry). Блокада проведения импульса обычно сопровождается уреже-нием ритма сердца (брадиаритмиями), а повторный вход волны возбуждения — увеличением частоты сокращений (тахиаритмиями).
Блокада проведения импульса
Распространение импульса блокируется, если он достигает участка миокарда, неспособного к электрическому возбуждению. Блокада проведения импульса может носить временный или постоянный характер, быть односторонней (импульсы не проводятся только в одном направлении) или двусторонней (импульсы не проводятся в обоих направлениях). Блокада проведения наблюдается при самых разных заболеваниях, включая ишемию или фиброз миокарда, травмы сердца и пр. Кроме того, временная блокада проведения импульса может быть вызвана приемом лекарственных средств некоторых классов. Чаще всего проведение импульса нарушается, если он достигает кардиомиоцитов, находящихся в рефрактерной фазе (сразу после фазы деполяризации), или участка миокарда, неспособного проводить электрический сигнал (в результате фиброза, образования рубцовой ткани).
Блокада проведения импульса в пределах проводящей системы сердца препятствует распространению нормальной волны возбуждения из синусового узла в нижележащие очаги автоматизма. Как следствие, импульсы из синусового узла не способны подавить активность эктопических водителей ритма, поэтому блокада в пределах проводящей системы сердца обычно сопровождается возникновением замещающих сокращений или ритмов.
В медицинской практике чаще всего встречается блокада проведения импульса между предсердием и желудочками (АВ блокада). Основные типы АВ блокады подробно описаны в следующей главе.
Повторный вход волны возбуждения
Повторный вход волны возбуждения (re-entry) лежит в основе большинства тахиаритмий. Ритм сердечных сокращений, возникающий при этом нарушении проводимости, обусловлен циркуляцией электрического тока в участке миокарда, приводящей к периодической деполяризации мембраны кардиомиоцитов.
В норме импульсы из синусового узла строго упорядоченно распространяются по миокарду, после чего затухают. Каждый участок проводящей системы и каждый регион миокарда деполяризуются под действием одного импульса возбуждения только один раз (в силу рефрактерности клеток, препятствующей повторной активации ткани сразу после прохождения импульса). Механизм повторного входа волны возбуждения показан на рисунке 11.9. Представленная схема отражает распространение электрического импульса по проводящей системе сердца в месте ее разделения на два функциональных пути. На рисунке 11.9А показано распространение волны возбуждения в норме. Импульс достигает точки «х» и далее следует по двум параллельным путям (а и р) в нижележащие отделы проводящей системы. Скорость проведения и рефрактерность путей а и р одинаковы, поэтому две волны возбуждения одновременно приходят в дистальный участок проводящей системы, где гасят друг друга.
На рисунке 11.9Б показано, что происходит, если проведение импульса по одному из путей блокировано. В этом примере прохождение импульса из верхних в нижние отделы проводящей системы возможно только по пути а. Распространяясь в дистальном отделе, импульс может достигнуть конечной точки пути р («у»). Если проводимость дистальных отделов пути р тоже нарушена, то импульс продолжает распространяться в нижележащие участки. Однако иногда импульс способен проводиться по пути Р ретроградно (вверх), и это явление — одно из обязательных условий реализации механизма re-entry.
Нарушение, при котором волна возбуждения распространяется по проводящим путям только ретроградно, называют односторонней блокадой. Односторонняя блокада проведения импульса наблюдается при дисфункции клеток, в тканях, где соседние клетки имеют разный период рефрактерности, или в проводящих волокнах с функционально разными электрофизиологическими свойствами.
Импульс, распространяющийся ретроградно по пути 0, может вновь достигнуть точки «х» (рис. 11.9В). Если в этот момент путь а находится в фазе реполяризации после только что прошедшего импульса и не способен вновь активироваться, то повторная волна возбуждения просто затухает в точке «х».
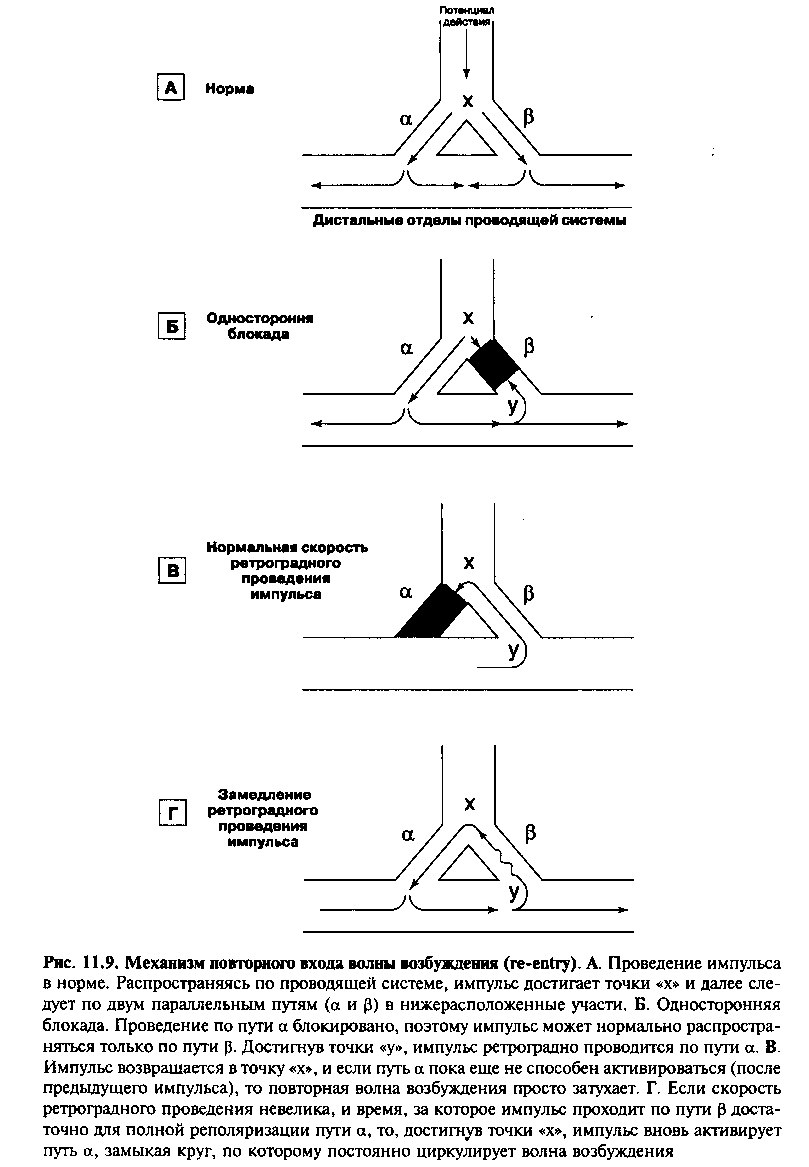
Ситуация кардинально меняется, если скорость ретроградного проведения импульса по пути р меньше, чем в норме (рис. 11.9Г). В этом случае время, за которое повторная волна возбуждения проводится по пути р, нередко достаточно для полной реполяризации пути а. Достигнув точки «х», импульс вновь активирует путь а, замыкая круг, по которому постоянно циркулирует волна возбуждения. Этот круг может существовать неопределенно долгое время, при этом каждое прохождение импульса активирует дистальные отделы проводящей системы, после чего и волна возбуждения распространяется по всему миокарду, вызывая тахиаритмии.
Теоретически, замедление ретроградного проведения импульса не является обязательным условием существования механизма re-entry. Повторный вход волны возбуждения возможен только в том случае, если распространяющийся импульс будет достигать клеток, мембрана которых может деполяризоваться. Следовательно, время прохождения импульса по цепи re-entry должно быть больше рефрактерного периода возбуждаемой ткани (например, пути а). Если время прохождения цепи re-entry будет меньше этого периода, то, достигнув рефрактерной ткани, импульс затухнет. Скорость проведения импульсов в норме составляет около 50 см/с, продолжительность рефрактерного периода — ~200 мс. Очевидно, что для реализации механизма re-entry длина цепи должна быть не менее 10 см. Однако на практике циркуляция импульсов возбуждения наблюдается в значительно меньших участках миокарда, поэтому замедление ретроградного проведения импульса в большинстве случаев все же необходимо для развития механизма re-entry и стойкого нарушения ритма сердечных сокращений.
Таким образом, для развития механизма повторного входа волны возбуждения необходимо два условия: 1) односторонняя блокада проведения и 2) замедление проведения импульса по цепи re-entry. Соблюдение этих условий возможно в том случае, если соседние клетки будут различаться по скорости проведения импульсов и продолжительности рефрактерного периода. Например, цепь re-entry может возникнуть в АВ узле при наличии дополнительного пути проведения (см. далее) или в результате поражения миокарда. Так, ишемия миокарда нередко сопровождается повторным входом волны возбуждения вследствие того, что пораженный участок содержит чередующиеся зоны способных и неспособных к возбуждению клеток.
ДОПОЛНИТЕЛЬНЫЕ ПРОВОДЯЩИЕ ПУТИ
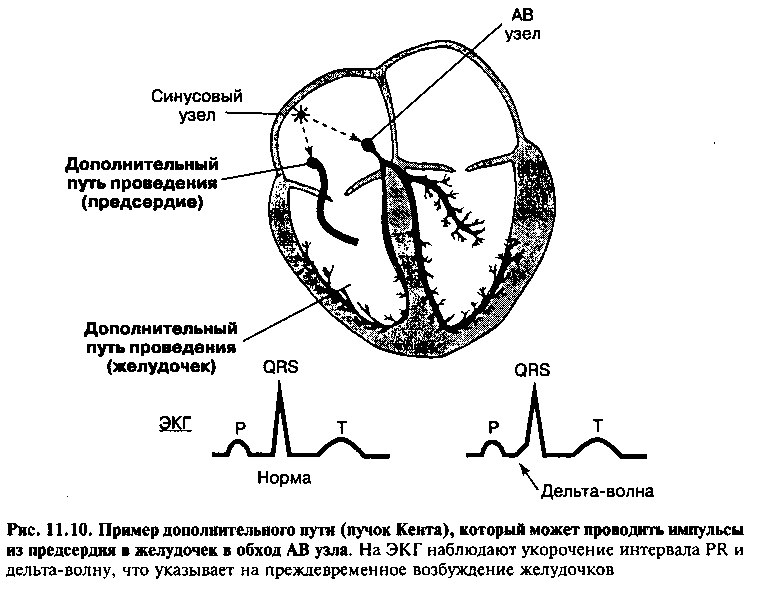
В норме импульс, образовавшийся в синусовом узле, проводится по предсердию и достигает АВ узла, откуда после небольшой задержки распространяется по проводящей системе желудочков. Однако у некоторых людей между предсердием и желудочками существует дополнительный путь проведения, обходящий АВ узел. Чаще всего таким дополнительным путем проведения является пучок Кента, образованный нормальными волокнами миокарда, которые по электрическим свойствам не отличаются от миокарда предсердий. .Благодаря аномальному расположению, этот пучок связывает миокард предсердия с миокардом желудочка (рис. 11.10). Дополнительный путь быстро проводит импульс, и нормальной задержки волны возбуждения в АВ узле не происходит. Как следствие, желудочки возбуждаются раньше, чем в норме, что сопровождается укорочением интервала PR на ЭКГ (обычно — менее 0,12 с или < 3 маленьких квадрата на стандартной ЭКГ-бумаге). Более того, у таких лиц деполяризация желудочков обусловлена импульсами, поступившими как из АВ узла, так и по дополнительному пути проведения. В результате на ЭКГ наблюдают широкие комплексы QRS с более ранним чем в норме подъемом в начальной части комплекса («дельта-волна», рис. 11.10).
Дополнительный путь проведения является анатомической основой длинной цепи re-entry. Составляющими этой цепи являются, с одной стороны, дополнительный проводящий путь, с другой — АВ узел. Скорость проведения и продолжительность рефрактерного периода дополнительного и нормальных путей обычно различаются, поэтому импульсы соответствующей частоты могут приводить к возникновению тахиаритмий по механизму re-entry.
Нарушения образования и проведения импульса лежат в основе всех аритмий, которые принято разделять на две большие группы: патологическое урежение (брадиаритмии) или увеличение (тахиаритмии) частоты сердечных сокращений. В таблице 11.1 перечислены основные механизмы развития и типичные клинические примеры аритмий (см. главу 12).

ПРИНЦИПЫ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
Цель антиаритмической терапии — коррекция механизмов, приводящих к нарушениям образования или проведения импульса возбуждения. В этом разделе обсуждаются основные принципы антиаритмической терапии, а в следующей главе — особенности лечения больных с разными нарушениями сердечного ритма.
Брадиаритмии
Лечение больных с брадиаритмиями включает медикаментозную терапию и установку искусственного водителя ритма.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Медикаментозная терапия направлена на регуляцию симпатического и парасимпатического тонуса сердца:
1. Антихолинергические средства: повышение тонуса блуждающего нерва сопровождается уменьшением ЧСС и замедлением проведения импульсов в АВ узле. Этот эффект опосредован связыванием ацетилхолина с мускариновыми рецепторами. Антихолинергические препараты (например, М-холиноблокатор атропин) снижают тонус блуждающего нерва, увеличивая ЧСС и скорость проведения импульсов в АВ узле.
2. Агонисты р1-адренергических рецепторов имитируют эффекты эндогенных катехоламинов, которые повышают ЧСС и скорость проведения импульсов в АВ узле. К препаратам этого класса относится, например, изопротеренол.
Атропин и изопротеренол назначают внутривенно. Эти препараты применяют для неотложного лечения больных с некоторыми формами брадикардии, однако при хронических брадиаритмиях атропин и изопротеренол не используют.
ИСКУССТВЕННЫЕ ВОДИТЕЛИ РИТМА
Искусственный водитель ритма (электростимулятор) — это устройство, генерирующее электрические импульсы с заданной частотой и предназначенное для увеличения ЧСС у больных с брадиаритмиями. Элекгростиму-лятор может быть установлен временно или постоянно. Временные электростимуляторы используют для лечения преходящей брадиаритмии, а также для стабилизации состояния больных, нуждающихся в постоянном искусственном водителе ритма. Например, при брадиаритмиях, возникающих в результате токсического эффекта лекарственных средств, электростимулятор устанавливают на время, достаточное для полного исчезновения побочных эффектов препаратов.
Существуют временные электростимуляторы двух типов. Первый используют для трансторакальной элекгрокардиостимуляции: непрямую стимуляцию сердца проводят с помощью внешних электродов, установленных на поверхности грудной клетки больного. Очевидно, что эта процедура сопряжена с большим дискомфортом, поскольку в этом случае стимулируется сокращение всех грудных мышц. С другой стороны, такой электростимулятор можно быстро установить (например, при необходимости экстренного вмешательства). Временные электростимуляторы другого типа предназначены для трансвенозной элекгрокардиостимуляции: снабженный электродом катетер вводят через одну из периферических вен в полость сердца и подключают к внешнему источнику тока. Такой электростимулятор можно использовать в течение нескольких дней, однако уже через 48—72 ч значительно возрастает риск катетерной инфекции и тромбоза вен.
В отличие от временных электростимуляторов, постоянные водители ритма представляют собой гораздо более сложные электронные устройства, способные регистрировать электрическую активность предсердий и/или желудочков. Обычно электроды проводят (трансвенозно) в правые отделы сердца, а источник тока, размером не превышающий монету, имплантируют подкожно. Срок службы такого источника составляет 5—15 лет. Современные постоянные водители ритма являются программируемыми устройствами, работой которых можно управлять с помощью внешних радиосигналов, воспринимаемых имплантированным генератором.
Тахиаритмии
Тактика лечения больных с тахиаритмиями зависит от механизмов, лежащих в основе нарушения ритма сердца, и, как правило, включает терапию антиаритмическими средствами, медикаментозную или электрическую кардиоверсию/дефибрилляцию. Вместе с тем, современные электронные устройства и катетерные методы могут кардинальным образом изменить подходы к лечению больных со стойкими тахиаритмиями.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Медикаментозная терапия направлена на устранение патологических механизмов, вызывающих тахиаритмии: нарушения автоматизма, формирование цепи re-entry или устранение триггерной активности. В клинической практике с успехом применяется большое количество антиаритмических препаратов, фармакологические свойства которых подробно описаны в главе 17. Очевидно, что для правильного выбора антиаритмического средства необходимо понять причину возникновения аритмии. Учитывая основные механизмы развития аритмий, изложенные в настоящей главе, можно выделить следующие стратегические подходы к антиаритмиче-ской терапии:
Устранение нарушений ритма сердечных сокращений, возникающих в результате усиления автоматизма клеток. В этих случаях целесообразно применять препараты, способные:
1. Увеличивать продолжительность фазы 4 спонтанной деполяризации клеток-пейсмекеров.
2. Снижать диастолический потенциал (делая его более отрицательным)
3. Повышать пороговый потенциал мембраны клеток (делая его менее отрицательным)
Изменение диастолического и/или порогового потенциалов и замедление скорости спонтанной диастолической деполяризации сопровождаются уменьшением частоты импульсации из эктопических центров автоматизма.
Для разрыва цепи re-entry применяют препараты:
1. Снижающие скорость проведения импульса. Распространение импульсов по медленному пути еще больше замедляется, в результате волна возбуждения гасится, не успев замкнуть цепь re-entry.
2. Увеличивающие рефрактерность путей, составляющих цепь re-entry. Достигнув рефрактерного, неспособного активироваться участка цепи, волна возбуждения гаснет.
Для устранения триггерной активности целесообразно применять препараты, способные:
1. Укорачивать потенциал действия (что препятствует ранним постдеполяризациям)
2. Уменьшать накопление ионов кальция в клетках (что препятствует поздним постдеполяризациям)
Антиаритмическая эффективность применяемых на практике лекарственных средств обусловлена их способностью регулировать активность ионных каналов, взаимодействовать со специфическими рецепторами на поверхности клеточных мембран или изменять работу трансмембранных переносчиков. Мы рекомендуем обратиться к главе 17, в которой описаны механизмы действия и приведены названия основных антиаритмиче-ских препаратов.
ВАГУСНЫЕ ПРИЕМЫ
Массаж каротидного синуса — один из эффективных терапевтических методов, нередко применяемый для устранения некоторых форм наджелудочковых тахикардий. Каротидный синус находится в области бифуркации общей сонной и начала внутренней сонной артерии. Стимуляция каротидного синуса (круговыми движениями в течение 3-5 с) сопровождается повышением парасимпатического и снижением симпатического тонуса центральной нервной системы. В результате уменьшается частота импульсации синусового узла, и замедляется проведение импульсов в АВ узле, что позволяет разорвать цепь re-entry, если она включает АВ узел. Другие вагусные приемы включают пробу Вальсальвы (выдох при закрытой голосовой щели) или погружение лица в ледяную воду («рефлекс ныряльщика»).
ИСКУССТВЕННЫЕ ВОДИТЕЛИ РИТМА
Некоторым больным для предотвращения наджелудочковых тахикардий, возникающих по механизму re-entry, показана установка временного водителя ритма, стимулирующего предсердия с высокой частотой. Такая стимуляция позволяет захватить и деполяризовать часть цепи re-entry, увеличивая период рефракгерности данного участка. В результате повторная волна возбуждения достигает участка, неспособного к активации, поскольку он только что был стимулирован искусственным водителем ритма. Распространение импульса возбуждения по этому участку невозможно, что приводит к разрыву цепи re-entry.
ЭЛЕКТРИЧЕСКАЯ КАРДИОВЕРСИЯ
Кардиоверсия и дефибрилляция — схожие методы лечения больных с некоторыми формами тахиаритмий. При проведении кардиоверсии или дефибрилляции через грудную клетку проходит электрический разряд достаточной мощности, вызывающий одновременную деполяризацию большой массы миокарда, что позволяет восстановить синусовый ритм сердечных сокращений (т. к. синусовый узел обладает наибольшей частотой спонтанной импульсации). Эти методы высокоэффективны при тахиаритмиях, возникающих по механизму re-entry, однако они не всегда позволяют устранять нарушения ритма сердечных сокращений вследствие усиления автоматизма эктопических центров (если их собственная частота импульсации выше, чем синусового узла).
Электрическую кардиоверсию проводят больному под легким наркозом. Два электрода накладывают на грудную клетку больного по обе стороны сердца (обычно — над основанием и верхушкой сердца). Быстрый электрический разряд синхронизируют с комплексом QRS (т. е. с деполяризацией желудочков). Синхронизация предотвращает проведение разряда в период, когда желудочки находятся в рефрактерном периоде (что может вызвать фибрилляцию желудочков).
Дефибрилляция показана в экстренных случаях, например, при фибрилляции желудочков (см. след, главу). В отличие от кардиоверсии, электрический разряд при дефибрилляции не синхронизируют с комплексом QRS (при фибрилляции желудочков комплексы QRS на ЭКГ не определяются). В настоящее время при лечении больных с пароксизмами устойчивой желудочковой тахикардии все чаще применяются небольшие вшитые дефибрилляторы (имплантируемые кардиовертеры/дефибрилляторы). Эти устройства способны выявлять фибрилляцию желудочков или желудочковую тахикардию и испускать электрический разряд, прерывающий патологический ритм сердечных сокращений. Современные устройства могут выполнять функции искусственного водителя ритма, иногда купируя желудочковую тахикардию без нанесения болезненного электрического разряда.
МЕТОДЫ АБЛАЦИИ
Больным с устойчивыми наджелудочковыми и желудочковыми аритмиями показано электрофизиологическое исследование, которое позволяет идентифицировать дополнительные пути проведения, участки цепи re-entry или эктопические очаги автоматизма, ответственные за нарушение ритма сердечных сокращений. Впоследствии эти участки миокарда подвергают радиочастотной деструкции (аблации) с помощью трансвенозного катетера-электрода. Это метод кардинальным образом изменил подходы к лечению больных с наджелудочковыми тахиаритмиями, давая возможность отказаться от постоянного приема антиаритмических препаратов.
РЕЗЮМЕ
1. Аритмии возникают в результате нарушений образования и/или проведения импульса возбуждения.
2. Брадиаритмии встречаются при замедлении образования импульсов (например, в синусовом узле) или замедлении проведения импульсов (например, при АВ блокаде).
3. Причиной тахиаритмий нередко является 1) повышение автоматизма (синусового узла, латентных водителей ритма или эктопических очагов в миокарде); 2) триггерная активность и 3) повторный вход волны возбуждения (механизм re-entry).
4. При лечении больных с брадиаритмиями показаны препараты, ускоряющие образование импульсов в синусовом узле и их проведение в АВ узле (атропин, изопротеренол). В некоторых случаях целесообразна установка искусственного водителя ритма (кардиостимулятора).
5. Выбор препарата при лечении больных с тахиаритмиями зависит от механизма нарушений сердечного ритма. Так, при устойчивой тахиаритмии или в экстренных ситуациях проводят электрическую кардио-версию/дефибрилляцию. В настоящее время при лечении больных с некоторыми формами тахиаритмий все чаще применяют деструкцию (аблацию) патологических участков миокарда с помощью катетеров-электродов.