Сердечная недостаточность
В норме сердце при относительно низком давлении во время диастолы принимает в себя кровь и при более высоком давлении в систолу проталкивает кровь вперед. Сердечная недостаточность определяется как неспособность сердца перекачивать объем крови, необходимый для обеспечения метаболических потребностей организма («систолическая дисфункция») или возможность обеспечивать эти потребности только благодаря ненормально высокому давлению заполнения полостей сердца («диастолическая дисфункция»), или за счет обоих этих механизмов. Хотя эти условия встречаются в ряде ситуаций, не связанных с патологией сердца, например, при неадекватной тканевой перфузии (при массивном кровотечении) или при повышении метаболических потребностей (гипертиреоз), в этой главе рассматриваются только кардиальные причины сердечной недостаточности.
Сердечная недостаточность может быть основным проявлением практически всех болезней сердца, включая коронарный атеросклероз, инфаркт миокарда, клапанные пороки, артериальную гипертензию, врожденные пороки и кардиомиопатии. В США ежегодно выявляют до 400000 новых случаев сердечной недостаточности, и эти цифры растут, отчасти из-за старения населения, отчасти от того, что современное лечение позволяет продлевать жизнь после таких острых заболеваний сердца как инфаркт миокарда. Поскольку сердечная недостаточность наиболее часто развивается в условиях нарушенной функции левого желудочка, мы начинаем этот раздел с рассмотрения нормальной физиологии сокращения и расслабления миокарда.
ФИЗИОЛОГИЯ
В экспериментах на изолированных фрагментах сердечной мышцы было выявлено несколько важных физиологических принципов, которые применимы и к целому сердцу.
При растяжении мышечного сегмента в экспериментальных условиях зависимость между его длиной и пассивно развиваемой им силой натяжения описывается кривой, отражающей его внутренние эластические свойства (рис. 9.1 А, нижняя кривая). Если же мышцу сначала растягивают, а затем стимулируют, вызывая ее сокращение (изометрическое, так как концы мышцы зафиксированы), общее напряжение (активное + пассивное напряжение), развиваемое миофибриллами, пропорционально длине мышцы в момент стимуляции (рис. 9.1 А, верхняя кривая). Иначе говоря, растягивание мышцы перед ее стимуляцией оптимизирует взаимодействие между нитями актина и миозина, увеличивая количество поперечных мостиков и силу сокращения. Кроме того, растяжение кардиомиоцитов повышает также чувствительность миофибрилл к кальцию, что еще более увеличивает силу сокращения.
Соотношение между исходной длиной мышцы и развиваемой ею силой сокращения имеет огромное значения для интактного сердца: в физиологических пределах чем больше объем желудочка во время диастолы, чем больше растягиваются волокна перед стимуляцией, тем больше сила
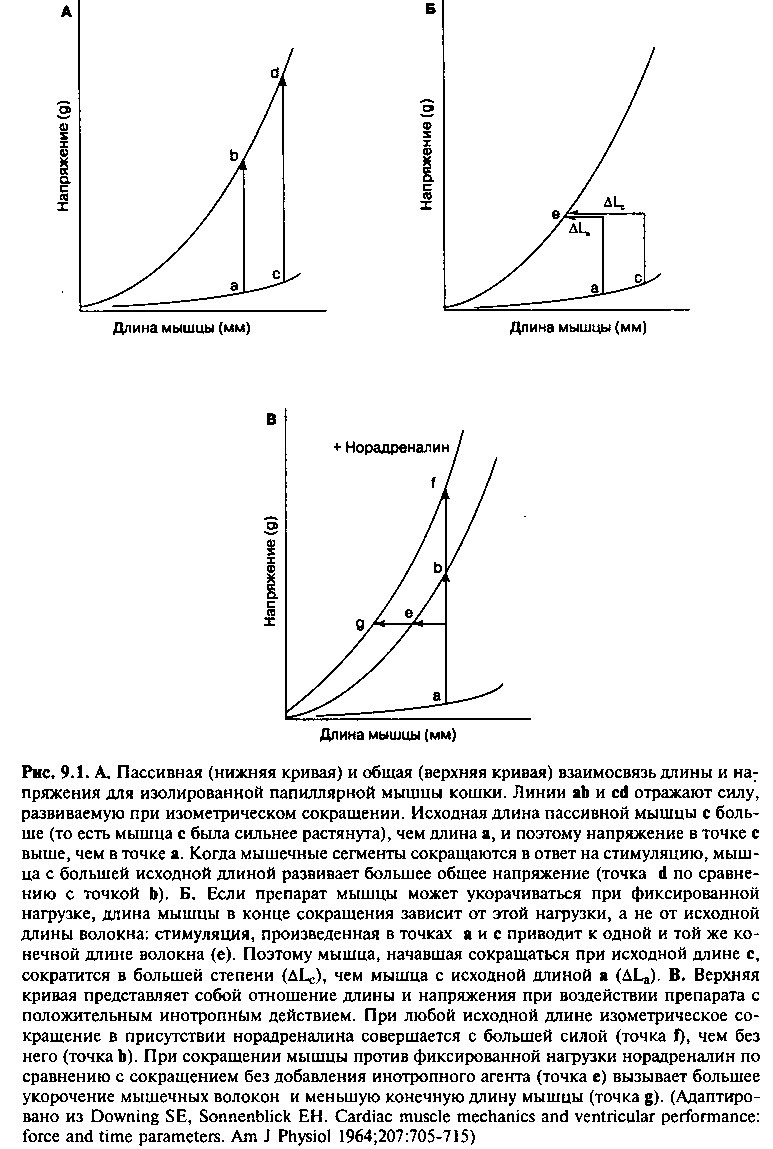
следующего сокращения. В этом суть механизма Франка—Старлинга, который основан на наблюдении, что желудочковый выброс увеличивается в ответ на увеличение преднагрузки (растяжения миокардиальных волокон перед сокращением).
Второе основанное на экспериментах с изолированными мышечными сегментами наблюдение касается ситуации, когда мышечные волокна не фиксируются на определенной длине, а могут во время стимуляции укорачиваться, выполняя фиксированную нагрузку (так называемую постнагрузку). В этой ситуации (изотоническое сокращение) длина мышцы в конце сокращения напрямую связана с величиной нагрузки, но не зависит от длины мышцы до стимуляции (рис. 9.1В). Таким образом, 1) развиваемое мышечным волокном напряжение равно фиксированной нагрузке; 2) чем больше противодействующая сокращению сила, тем меньше укорачивается волокно; 3) если волокно перед стимуляцией растянуто до большей длины, а постнагрузка остается прежней, мышца укорачивается в большей степени и достигает в конце сокращения своей исходной длины; 4) максимальное напряжение, развиваемое волокном при изотоническом сокращении (то есть когда волокно не способно укорачиваться) равняется силе, продуцируемой при изометрическом сокращении при той же преднагрузке. Концепция постнагрузки применима и к нормальному сердцу: развиваемое желудочком давление и размер его камеры в конце каждого сокращения зависит от постнагрузки, против которой осуществляется сокращение (в основном это ) артериальное давление), но не от предшествующего сокращению растяжения миокардиальных волокон.
Третьим ключевым наблюдением в условиях экспериментов является то, что сократимость миокарда (также называемая инотропным статусом) обусловливает изменения силы сокращений, не зависимые от исходной длины волокон и постнагрузки. Сократимость обычно отражает химические и гормональные влияния на сердечные сокращения, например, воздействие катехоламинов. Когда сократимость повышается с помощью фармакологических средств (например, с помощью инфузии норадреналина), кривая взаимосвязи между исходной длиной волокон и силой сокращения смещается вверх (рис. 9.1 С), так что изометрические сокращения вызывают большее напряжение при любой преднагрузке. Подобным образом, при увеличении сократимости в эксперименте с укорочением волокна при фиксированной постнагрузке волокно будет укорачиваться в большей степени по сравнению с нормой и достигнет в конце меньшей длины. Видимо, сократимость увеличивается за счет повышения скорости образования поперечных мостиков между актином и миозином.
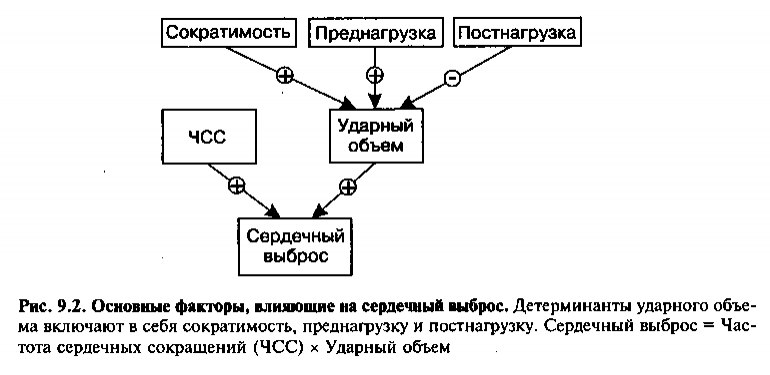
Факторы, определяющие сократительную функцию и сердечного выброса
В норме сердечный выброс соответствует общим метаболическим по-требцрстям организма. Сердечный выброс (СВ) равняется произведению ударного объема (УО, количество выталкиваемой при каждом сокращении крови) на частоту сердечных сокращений (ЧСС):
СВ = УО х ЧСС
Тремя основными детерминантами ударного объема являются пред-нагрузка, постнагрузка и сократимость миокарда (см. рис. 9.2).
ПРЕДНАГРУЗКА
Таблица 9.1. Термины, используемые для описания работы сердца
|
Термин Преднагрузка |
Определение Напряжение стенки желудочка в конце диастолы. В клиническом выражении это степень растяжения миофибрилл сразу перед сокращением; ее часто приблизительно оценивают по конечному диастолическому объему и конечному диастолическому давлению. |
Постнагрузка |
Напряжение стенки желудочка во время сокращения; сопротивление, которое желудочек должен преодолеть, выбрасывая свое содержимое. Ей приблизительно соответствует систолическое левожелудочковое или артериальное давление. |
Сократимость (инотропный статус) |
Свойство сердечной мышцы, с которым связаны не зависимые от пред- и постнагрузки изменения силы сокращения. Последняя меняется под влиянием химических и гормональных факторов (например, катехоламинов). |
Ударный объем |
Объем крови, выбрасываемый желудочком в систолу. (= конечный диастолический объем — конечный систолический объем). |
Термин |
Определение |
Фракция выброса (ФВ) |
Доля конечного диастолического объема, выбрасываемая желудочком во время каждой систолы (в норме 55—75%). - о Ударный объем Конечный диастолический объем |
Сердечный выброс |
Объем крови, выбрасываемой желудочком в минуту (= ударный объем х ЧСС) |
Эластичность |
Внутреннее свойство камеры, которое характеризует взаимосвязь ее объема и давления в ней во время заполнения. Отражает трудность или легкость, с которой камера может быть заполнена. Краткое определение: ~ ДОбъема Эластичность = —------ ЛДавления |
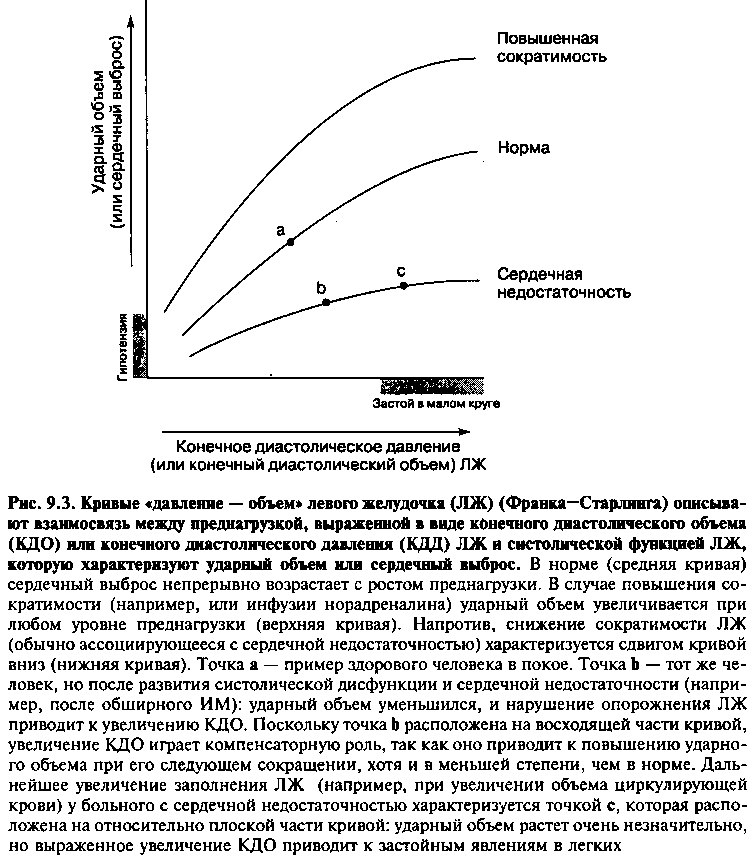
Концепция преднагрузки (таблица 9.1) была разработана для интактного сердца физиологами Франком и Старлингом 100 лет назад. Они показали экспериментально, что, в физиологических пределах, чем больше нормальный желудочек растягивается в диастолу (то есть чем больше он заполняется кровью), тем больший объем крови выбрасывается им в последующую систолу. Эта взаимосвязь описывается кривой Франка—Старлинга, также называемой кривой желудочковой функции (рис. 9.3). Эта кривая представляет собой зависимость систолической функции сердца, оцениваемой с помощью показателей сердечного выброса или ударного объема (по оси ординат), от преднагрузки (по оси абсцисс). Как говорилось выше, за преднагрузку может быть принята степень растяжения миокарда в конце диастолы, сразу перед сокращением. Показателями, коррелирующими с растяжением миокарда, которыми часто пользуются для оценки преднагрузки (обозначена по оси абсцисс), являются конечный диастолический объем левого желудочка (КДО) или конечное диастолическое давление (КДД). Состояния, связанные с уменьшением объема циркулирующей крови, и, таким образом, уменьшающие преднагрузку на желудочек (например, дегидратация или массивное кровотечение) приводят к уменьшению конечного диастолического объема и, вследствие этого, к снижению ударного объема во время систолы. Напротив, увеличение диастолического объема левого желудочка (например, при массивной инфузионной терапии) приводит к большему, чем обычно, ударному объему.
ПОСТНАГРУЗКА
В интактном сердце постнагрузка (таблица 9.1) отражает то сопротивление, которое левый желудочек должен преодолеть, выбрасывая свое содержимое. Более формально она определяется как развивающееся во время систолического изгнания напряжение стенки. Напряжение стенки
(о), как и давление, выражается как сила на единицу площади, и для левого желудочка, согласно уравнению Лапласа для полой сферы, описывается как
где Р — давление в желудочке, г — радиус его полости, ah — толщина стенки. В целом, важным показателем, по которому можно оценивать уровень постнагрузки, является систолическое артериальное давление (которое при отсутствии обструкции на пути крови из желудочка в аорту равняется систолическому давлению в желудочке). Напряжение стенки желудочка повышается при увеличении нагрузки давлением (например, при гипертензии) или размера его полости (например, при дилатации левого желудочка, отмечаемой при многих формах сердечной недостаточности). Как будет рассказано ниже, утолщение стенки желудочка играет компенсаторную роль в уменьшении напряжения стенки, так как сила распределяется на большую массу миокарда на единицу поверхности.
СОКРАТИМОСТЬ
В интактном сердце, как и при опытах на изолированных мышечных сегментах, сократимость определяет тот диапазон силы, которую миокард развивает в условиях заданной пред- и постнагрузки. Каждая из кривых Франка—Старлинга, отражающих зависимость показателей систолической функции желудочка (ударный объем или сердечный выброс) от преднагрузки (конечный диастолический объем или конечное диастолическое давление в левом желудочке), характеризует данный инотропный статус сердца (рис. 9.3). Влияние изменения преднагрузки на ударный объем описывается перемещением вдоль по данной кривой Франка—Старлинга. Изменение сократимости сдвигает всю кривую вверх или вниз. Поэтому, когда сократимость повышается фармакологически (например, с помощью инфузии норадреналина), кривая смещается вверх, так что ударный объем возрастает при любом уровне преднагрузки. Напротив, при назначении препаратов, уменьшающих сократимость (например, Р-блокаторы) или нарушении сократительной функции левого желудочка (как при многих формах сердечной недостаточности), кривая сдвигается вниз, так что при любом уровне преднагрузки ударный объем и сердечный выброс снижаются.
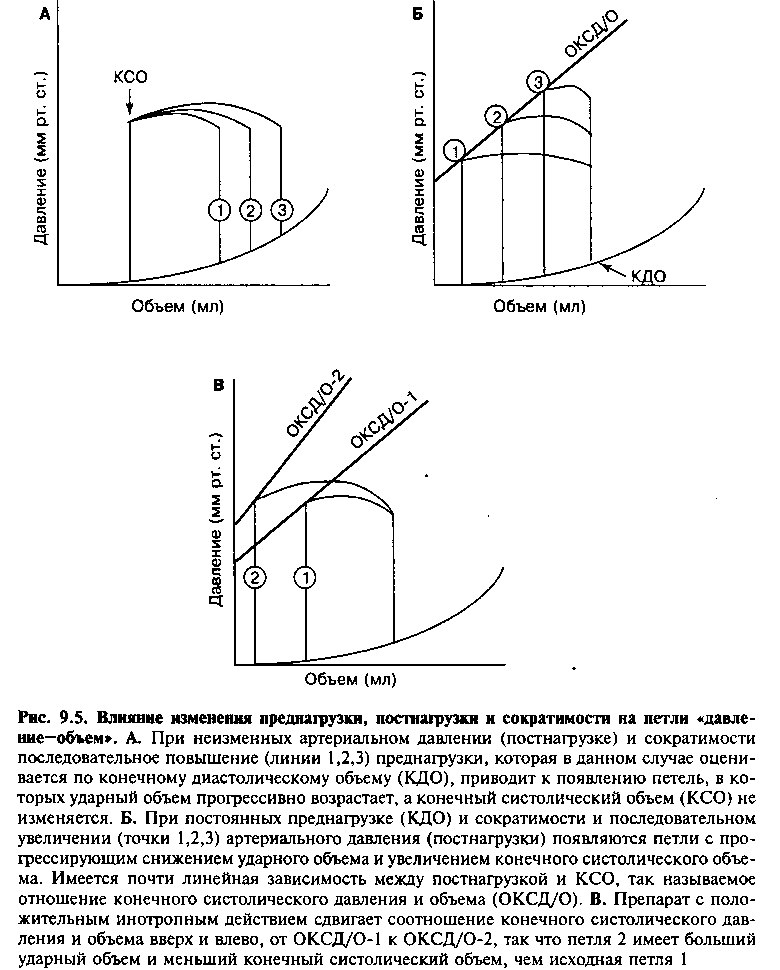
Петля «Давление — объем»
Другим полезным способом графического изображения детерминант функции сердца является петля «давление — объем» желудочка, которая позволяет связать изменения объема желудочка с соответствующими им изменениями давления в течение кардиоцикла (рис. 9.4). Заполнение камеры левого желудочка начинается после открытия митрального клапана в раннюю диастолу (точка а). Кривая между точками а и Ь характеризует диастолическое наполнение. Увеличение объема во время диастолы ассоциируется с небольшим повышением давления, зависящим от способности миокарда к пассивному растяжению или его эластичности (таблица 9.1), аналогично препарату изолированного мышечного сегмента (см. нижнюю кривую на рис. 9.1 А). Затем с началом систолического сокращения давление в желудочке начинает расти. Когда давление в ЛЖ превышает давление в левом предсердии (точка Ь), закрывается митральный клапан. По мере роста давления объем желудочка сначала не меняется, поскольку аортальный клапан остается закрытым — это так называемая фаза изово-люметрического сокращения. Когда давление в желудочке достигает

уровня диастолического давления в аорте, аортальный клапан открывается (точка с) и происходит выброс крови в аорту. Во время выброса крови объем желудочка уменьшается, но давление продолжает расти вплоть до начала его расслабления. Давление, против которого желудочек выбрасывает кровь (постнагрузка), представлено кривой cd. Выброс крови заканчивается во время расслабления желудочка, когда давление в нем становится меньше давления в аорте и аортальный клапан закрывается (точка d). В дальнейшем, в фазе расслабления, давление в желудочке снижается, а объем остается постоянным вплоть до открытия митрального клапана (эта фаза называется изоволюметрическим расслаблением). Когда давление в желудочке становится ниже давления в левом предсердии, открывается митральный клапан (точка а — и цикл повторяется. Обратите внимание, что точка b отражает давление и объем в конце диастолы, а точка d — в конце систолы. Разница между конечным диастолическим и конечным систолическим объемами соответствует количеству выброшенной в аорту за систолу крови (ударному объему).
Изменения любой из детерминант функции сердца приводят к изменениям петли «Давление—объем». Путем анализа эффектов изменения одного из параметров (преднагрузка, постнагрузка или сократимость) на петлю «давление—объем» могут быть предсказаны результирующие изменения давления в желудочке и его объема (рис. 9.5).
ПРЕДНАГРУЗКА
Если постнагрузка и сократимость остаются неизменными, а преднаг-рузка увеличивается (например, при внутривенной инфузии жидкостей), конечный диастолический объем левого желудочка увеличивается. Повышение преднагрузки приводит посредством механизма Франка—Старлинга к увеличению ударного объема, так что конечный систолический объем не меняется по сравнению с исходным уровнем. Это означает, что в норме, при неизменных сократимости и постнагрузке, левый желудочек способен приспосабливать свой ударный объем к своему диастолическому заполнению и эффективно выталкивать содержащуюся в нем кровь.
Следует отметить, что, хотя конечный диастолический объем и конечное диастолическое давление часто используются для оценки преднагрузки без пересчета, степень диастолического заполнения в значительной степени определяется соотношением между объемом и давлением заполнения (известным как эластичность желудочка (таблица 9.1)). При снижении эластичности желудочка (например, при его выраженной гипертрофии) угол наклона кривой диастолического заполнения (сегмент ab на рис. 9.4) становится более пологим, как будет описано ниже. «Жесткий» или малоэластичный желудочек обладает сниженной способностью к заполнению кровью, что приводит к более низкому, чем в норме, конечному диастолическому объему. В этой ситуации, если постнагрузка и сократимость остаются неизменными, конечный систолический объем останется неизменным и, соответственно, ударный объем уменьшится.
ПОСТНАГРУЗКА
Если преднагрузка и сократимость остаются неизменными, а увеличивается постнагрузка (например, при состояниях с высоким сопротивлением выбросу, таких как артериальная гипертензия и аортальный стеноз), левый желудочек вынужден развивать более высокое давление для выброса крови. В этой ситуации ЛЖ выполняет большую работу для преодоления сопротивления сокращению, и его волокна укорачиваются в меньшей степени. Как показано на рисунке 9-5Б, увеличение постнагрузки приводит к повышению систолического давления в желудочке и увеличению по сравнению с нормой конечного систолического объема ЛЖ. Таким образом, при повышении постнагрузки ударный объем желудочка (КДО — КСО) снижается.
Зависимость конечного систолического объема от постнагрузки почти линейная: чем выше постнагрузка, тем больше конечный систолический объем. Эта взаимосвязь изображена на рисунке 9.5 в качестве соотношения: конечный систолический объем / давление (ОКСД/О); она аналогична описанной выше кривой общего напряжения, полученной в экспериментах на изолированной мышце.
СОКРАТИМОСТЬ
Угол наклона линии ОКСД/О на графике петли «давление — объем» находится в функциональной зависимости от сократимости миокарда. В случае увеличения сократимости (например, при инфузии норадреналина) угол ОКСД/О становится более крутым, то есть кривая смещается вверх и влево. В этом случае при любых значениях пред- и постнагрузки желудочек опорожняется более полно (увеличивается ударный объем), и конечный систолический объем уменьшается (рис. 9.5В). Напротив, при снижении сократимости (например, при лечении 0-блокаторами в больших дозах или при дилатационной кардиомиопатии) кривая ОК.СД/О смещается вниз, что ассоциируется с уменьшением ударного объема и увеличением конечного систолического объема. Таким образом, конечный систолический объем зависит от постнагрузки, которая противодействует сокращению желудочка, и его инотропного статуса, но не зависит от конечного диастолического объема желудочка перед сокращением.
Перечислим еще раз коротко основные физиологические принципы, представленные в этом разделе:
1. Ударный объем желудочка (УО) находится в функциональной зависимости от преднагрузки, постнагрузки и сократимости. УО увеличивается при увеличении преднагрузки, уменьшении постнагрузки или усилении сократимости.
2. Конечный диастолический объем желудочка (или конечное диастолическое давление) часто используется для характеристики преднагрузки. Конечный диастолический объем зависит от податливости стенок левого желудочка.
3. Конечный систолический объем желудочка зависит от постнагрузки и сократимости, но не от преднагрузки.
ПАТОФИЗИОЛОГИЯ
Как уже говорилось в предисловии к этой главе, причиной сердечной недостаточности может быть широкий спектр сердечно-сосудистых заболеваний. Все возможные этиологические факторы по механизму развития сердечной недостаточности можно сгруппировать на 1) нарушающие сократимость, 2) повышающие постнагрузку, 3) нарушающие заполнение желудочка. Сердечная недостаточность, которая развивается вследствие нарушения опорожнения желудочка (из-за снижения сократимости или повышения постнагрузки) называется систолической дисфункцией, а развивающаяся вследствие нарушения диастолического расслабления или заполнения желудочка называется диастолической дисфукнкцией. Приблизительно у двух третей больных с сердечной недостаточностью имеется именно систолическая дисфункция, в то время как у остальных преобладает диастолическая дисфункция. На рисунке 9.6 представлены основные заболевания, которые могут привести к сердечной недостаточности.
Систолическая дисфункция
При систолической дисфункции способность пораженного желудочка выталкивать кровь снижена из-за нарушенной сократимости миокарда или перегрузки давлением (то есть, высокой постнагрузки). К потере сократимости могут приводить повреждение кардиомиоцитов, нарушение их функции или фиброз. При перегрузке давлением создается препятствие
желудочковому выбросу за счет значительного увеличения сопротивления потоку. На рисунке 9.7А с помощью петли «давление — объем» изображены эффекты систолической дисфункции вследствие нарушенной сократимости: кривая ОКСД/О смещается вниз, так что систолическое опорожнение желудочка заканчивается при большем конечном систолическом объеме, чем в норме. В результате уменьшается ударный объем. Когда к увеличен-

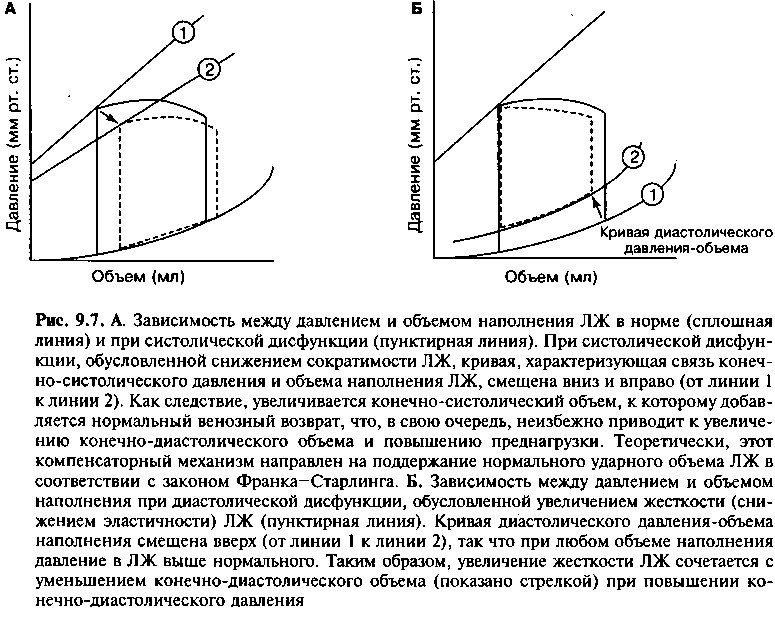
ному конечному систолическому объему добавляется обычное количество крови, притекающее из легочных вен, увеличивается диастолический объем камеры, и конечные диастолические давление и объем превышают норму. Несмотря на то, что это увеличение преднагрузки через механизм Франка-Старлинга приводит к увеличению ударного объема, из-за нарушения сократимости и снижения фракции выброса конечный систолический объем желудочка остается увеличенным.
Во время диастолы стойко повышенное давление в левом желудочке ретроградно через открытый митральный клапан передается на левое предсердие, а затем на легочные вены и капилляры. Повышение гидростатического давления в легочных капиллярах, достигая достаточных величин (обычно > 20 мм рт. ст.), приводит к транссудации жидкости в легочный интерстиций и симптомам застоя в малом круге кровообращения.
Диастолическая дисфункция левого желудочка
Примерно у каждого третьего больного с сердечной недостаточностью (СН) полностью сохранена сократительная (систолическая) функция левого желудочка (ЛЖ). Вместе с тем, многие больные этой категории имеют выраженные нарушения диастолической функции ЛЖ, включая замедление расслабления (активный процесс, требующий затрат энергии) и/или увеличение жесткости ЛЖ (пассивный процесс). Так, острая ишемия миокарда — это пример состояния, при котором преходящее нарушение диастолического расслабления ЛЖ обусловлено недостаточным поступлением энергетических субстратов в миокард. Гипертрофия ЛЖ, фиброз миокарда или рестриктивная кардиомиопатия (глава 10) являются типичными примерами стойкого увеличения жесткости ЛЖ. Последствия диастолической дисфункции наглядно отражены на кривой, характеризующей зависимость между диастолическим давлением и объемом наполнения ЛЖ (петля «давление-объем») (рис. 9.7Б). У больных этой категории наполнение ЛЖ происходит при более высоком диастолическом давлении, т. к. вследствие снижения податливости ЛЖ нижняя часть кривой диастолического наполнения смещается вверх. При диастолической дисфункции нередко отмечают признаки застойной СН, обусловленной ретроградной передачей высокого диастолического давления в систему легочных вен и в большой круг кровообращения.
Правожелудочковая сердечная недостаточность
Несмотря на общие физиологические механизмы развития левожелудочковой (см. начало главы) и правожелудочковой СН, строение и функции левого и правого желудочков сердца во многом различаются. В отличие от ЛЖ, правый желудочек (ПЖ) имеет более тонкие стенки, лучше растяжим, способен наполняться кровью при довольно низком давлении и выбрасывать кровь в малый круг, преодолевая небольшое сопротивление легочных сосудов. Из-за большей растяжимости объем ПЖ может увеличиваться (например, за счет венозного возврата) без существенного повышения давления наполнения. Очевидно, что правожелудочковая недостаточность нередко развивается при внезапном увеличении пост-нагрузки (т. е. при увеличении сопротивления сердечному выбросу), например, вследствие эмболии легочной артерии или тяжелого заболевания легких.
Левожелудочковая СН — наиболее частая причина развития правожелудочковой недостаточности (таблица 9.2), которая в этом случае обусловлена увеличением постнагрузки вследствие дисфункции ЛЖ и повышения сопротивления легочных сосудов. Изолированная правожелудочковая недостаточность встречается реже и, как правило, связана с увеличением постнагрузки правого желудочка, вызванным паренхиматозным заболеванием легких или поражением легочных сосудов (например — эмболией легочной артерии). Наконец, правожелудочковая недостаточность нередко наблюдается у больных со сформировавшимся легочным сердцем (со г pulmonale) в результате первичного обструктивного заболевания легких.
Таблица 9.2. Типичные причины развития правожелудочковой недостаточности
Сердечно-сосудистые заболевания
Левожелудочковая недостаточность
Стеноз устья легочной артерии
Инфаркт правого желудочка
Паренхиматозное заболевание легких
Хроническое обструктивное заболевание легких
Интерстициальное поражение легких (например, саркоидоз)
Респираторный дистресс-синдром взрослых
Хронические инфекционные заболевания легких или бронхоэктазы
Заболевания сосудов легких
Эмболия легочной артерии
Первичная легочная гипертензия
При дисфункции правого желудочка высокое диастолическое давление ретроградно передается на правое предсердие, что сопровождается венозным застоем в большом круге и появлением симптомов правожелудочковой недостаточности (см. ниже). Изолированная правожелудочковая недостаточность может негативно влиять на функцию ЛЖ: уменьшение выброса правого желудочка приводит к снижению наполнения ЛЖ (преднагрузки) и, как следствие, к уменьшению ударного объема и сердечного выброса (СВ).
КОМПЕНСАТОРНЫЕ МЕХАНИЗМЫ
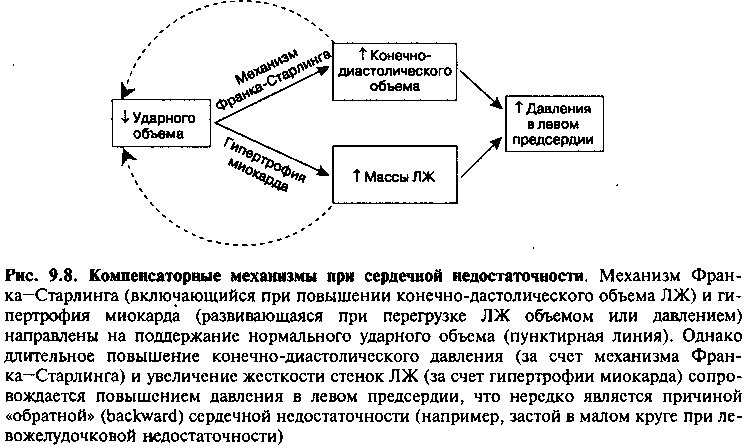
Развитие СН сопровождается активацией ряда компенсаторных механизмов, направленных на увеличение СВ и поддержание артериального давления на уровне, необходимом для адекватного кровоснабжения жизненно важных органов. К их числу относят: 1) механизм Франка—Старлинга; 2) гипертрофию миокрада и 3) нейрогуморальную активацию.
Механизм (закон) Франка—Старлинга
При СН, обусловленной нарушением сократимости ЛЖ, кривая функциональной активности ЛЖ (рис. 9.3) смещена вниз. Как следствие, при любой величине преднагрузки ударный объем сердца всегда оказывается меньше нормального. Снижение ударного объема сопровождается неполным опорожнением полости ЛЖ во время систолы, что приводит к увеличению объема крови, накапливающейся в желудочке во время диастолы (рис. 9.3, б). По закону Франка—Старлинга, сократимость миофибрилл пропорциональна их первоначальному растяжению, следовательно, увеличение конечно-диастолического объема ЛЖ способствует увеличению ударного объема, более полному освобождению полости желудочка от крови во время систолы и поддержанию нормального СВ. Вместе с тем, возможности этого компенсаторного механизма ограничены. Так, при тяжелой СН и выраженном нарушении сократимости миокарда функциональная кривая Л Ж на участке, соответствующем большим значениям конечно-диастолического объема, имеет более пологую форму. В этом случае даже выраженное увеличение конечно-диастолического объема сопровождается относительно небольшим усилением СВ. Более того, рост конечно-диастолического объема и давления (которое передается левому предсердию, легочным венам и капиллярам) может приводить к застою в малом круге и отеку легких (рис. 9.3, в).
Гипертрофия левого желудочка
Сердечная недостаточность сопровождается усилением напряжения (о) стенки ЛЖ, что может быть связано как с дилатацией (увеличением размеров) полости желудочка, так и с необходимостью создания более высокого диастолического давления, способного преодолеть избыточную постнагрузку (например, при СН, вызванной аортальным стенозом или артериальной гипертензией). Длительное увеличение напряжения стенки ЛЖ (в сочетании с активацией нейроэндокринных систем, см. ниже) способствует развитию гипертрофии миокарда (т. е. увеличению массы ЛЖ, обусловленному пролиферацией кардиомиоцитов и отложением большого количества внеклеточного матрикса). Увеличение массы миофибрилл является компенсаторным механизмом, направленным на поддержание силы сокращения миокарда и снижение напряжения в стенке ЛЖ (толщина стенки желудочка является одним из параметров, определяющих величину напряжения). Однако гипертрофия миокарда приводит к увеличению жесткости (снижению эластичности) стенок ЛЖ, и в результате действия этого компенсаторного механизма неизбежно повышается не только диастолическое давление ЛЖ, но и давление в левом предсердии и легочных сосудах (рис. 9.8).
Тип гипертрофии миокарда зависит от того, подвергается ли ЛЖ длительной перегрузке объемом или давлением. При дилатации ЛЖ вследствие перегрузки объемом (например, при митральной или аортальной регургитации) усиливается синтез новых саркомеров, которые располагаются последовательно относительно старых саркомеров. Как следствие, утолщение стенки ЛЖ сопровождается пропорциональным расширением полости желудочка, и такая гипертрофия называется эксцентрической. При длительной перегрузке давлением (артериальная гипертензия, аортальный стеноз) синтезированные саркомеры располагаются параллельно старым, такую гипертрофию миокарда называют концентрической. Концентрическая гипертрофия миокарда характеризуется утолщением стенки ЛЖ без пропорционального увеличения полости желудочка и может приводить к значительному снижению напряжения в стенке ЛЖ.
Нейрогормональная активация
Стимуляция нейроэндокринных систем является одним из основных компенсаторных механизмов при СН, который включает в себя: 1) симпатическую нервную систему, 2) ренин-ангиотензиновую систему, а также 3) усиление продукции антидиуретического гормона (АДГ) в ответ на снижение сердечного выброса (рис. 9.9). Активация этих систем необходима, в том числе, для повышения общего периферического сосудистого сопротивления (ОПСС) и поддержания нормального уровня артериального давления (АД), несмотря на снижение СВ. Поскольку уровень АД равен произведению СВ на ОПСС:
АД = СВ х ОПСС, увеличение ОПСС позволяет компенсировать снижение СВ и поддерживать практически нормальное АД на начальных стадиях СН. Кроме того, активация нейроэндокринных систем сопровождается задержкой натрия и воды в организме, что приводит к увеличению объема циркулирующей крови (ОЦК), преднагрузки и, в соответствии с законом Франка—Старлинга, — к увеличению СВ.
Несмотря на положительные, «компенсаторные» эффекты нейроэндокринной стимуляции, длительная активация указанных систем неизбежно ведет к усугублению СН.
СИМПАТИЧЕСКАЯ НЕРВНАЯ СИСТЕМА
Уменьшение СВ на фоне СН воспринимается барорецепторами каротидного синуса и дуги аорты как сигнал, свидетельствующий о снижении перфузионного давления. Барорецепторы, активность которых прямо
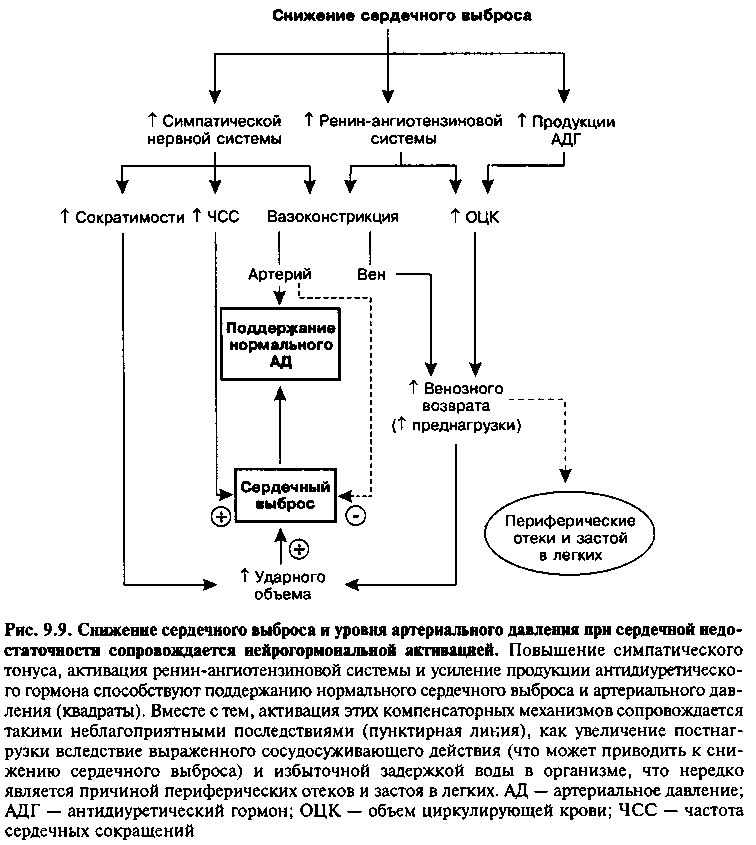
пропорциональна величине АД, передают соответствующую информацию по волокнам 9 и 10 пары черепномозговых нервов в вазомоторный центр продолговатого мозга, в результате чего симпатический тонус сердца и сосудов повышается, а парасимпатический — снижается. Повышение симпатического тонуса сопровождается тахикардией, усилением сократимости ЛЖ и сужением кровеносных сосудов вследствие активации б-ад-ренорецепторов системных вен и артерий (рис. 9.9). Увеличение частоты сердечных сокращений и сократимости ЛЖ непосредственно способствует повышению СВ. Такой же положительный эффект первоначально оказывает и сужение кровеносных сосудов. Так, при сужении вен усиливается венозный возврат, повышается преднагрузка ЛЖ и, по закону Франка—Старлинга, увеличивается СВ (если сократимость ЛЖ соответствует восходящему участку функциональной кривой, рис. 9.3). Сужение мелких артерий приводит к повышению ОПСС и, следовательно, способствует поддержанию АД (напомним, что АД= СВ х ОПСС). а-адренерги-ческие рецепторы распределены в тканях организма так, что при усилении симпатического тонуса в первую очередь кровоснабжаются такие жизненно важные органы, как сердце и головной мозг (за счет кожи, органов брюшной полости и почек).
РЕНИН-АНГИОТЕНЗИНОВАЯ СИСТЕМА
Активность ренин-ангиотензиновой системы у больных с СН повышена (рис. 9.9). Основными факторами, стимулирующими секрецию ренина юкстагломерулярными клетками почек у больных этой категории, являются 1) снижение перфузионного давления в почечной артерии вследствие уменьшения СВ, 2) снижение концентрации натрия в macula densa (плотном пятне) дистального отдела нефрона в результате изменения показателей внутрипочечной гемодинамики, и 3) прямая стимуляция юкстагломерулярных р2-аДренорецепторов при повышении тонуса симпатической нервной системы.
Ренин катализирует превращение ангиотензиногена в ангиотензин I, который под влиянием ангиотензинпревращающего фермента (АПФ) превращается в ангиотензин II (АП) — соединение, оказывающее выраженное сосудосуживающее действие (глава 13). Повышение уровня АП сопровождается увеличением ОПСС, что также способствует поддержанию АД. Кроме того, АП может увеличивать объем циркулирующей крови (ОЦК), 1) связываясь с рецепторами центра жажды в гипоталамусе и стимулируя потребление воды, и 2) действуя на клетки коры надпочечников, усиливая секрецию альдостерона — гормона, регулирующего реабсорбцию натрия в проксимальных канальцах почек (глава 17). Повышение ОЦК сопровождается увеличением преднагрузки, что по закону Франка-Старлинга приводит к повышению СВ (если сократимость ЛЖ соответствует восходящему участку кривой «давление—объем», рис. 9.3).
АНТИДИУРЕТИЧЕСКИЙ ГОРМОН
У многих больных с СН в плазме крови повышен уровень антидиуре-тического гормона (АДГ) задней долей гипофиза. В регуляции уровня АДГ важную роль играют барорецепторы левого предсердия и артерий, а также изменение концентрации АП в плазме крови. Антидиуретический гормон усиливает реабсорбцию воды в дистальных почечных канальцах (Глава 17), что сопровождается увеличением ОЦК, повышением преднагрузки и СВ.
Нейроэндокринные компенсаторные механизмы, играя положительную роль на начальных стадиях СН, в дальнейшем оказывают неблагоприятное действие и могут ускорять прогрессирование заболевания. Так, увеличение ОЦК и венозного возврата нередко сопровождается симптомами застоя в малом круге. Повышение ОПСС приводит к увеличению постнагрузки, что затрудняет работу сердца при левожелудочковой недостаточности и ведет к еще большему уменьшению ударного объема и СВ (рис. 9.9). Увеличение ЧСС требует дополнительных затрат энергии и, следовательно, может неблагоприятно влиять на сократимость пораженного сердца. Наконец, длительное повышение симпатического тонуса приводит по принципу обратной связи к уменьшению количества 0-адренорецепторов в миокарде и усилению синтеза G-белков, что сопровождается снижением чувствительности миокарда к катехоламинам и ослаблением положительного инотропного действия этих гормонов. Неблагоприятные последствия активации нейроэндокринных систем нередко превосходят возможные положительные эффекты, поэтому медикаментозная терапия СН, как правило, направлена на коррекцию этих «компенсаторных» реакций.
При повышении давления в полостях сердца предсердия начинают активно вырабатывать предсердный натрийуретический гормон, действие которого во многом противоположно эффектам других гормонов, выбрасываемых в кровь при СН. Предсердный натрийуретический гормон усиливает выведение воды и натрия из организма, оказывает сосудорасширяющее действие, подавляет секрецию ренина и препятствует эффектам АП (вазоконстрикция, стимуляция секреции альдостерона). Хотя при СН концентрация предсердного натрийуретического гормона в плазме крови увеличивается, его положительное действие может быть ослаблено вследствие сниженной чувствительности некоторых органов-мишеней (в первую очередь — почек).
НАРУШЕНИЕ ФУНКЦИИ КАРДИОМИОЦИТОВ
Сердечная недостаточность сопровождается изменением структуры кардиомиоцитов и нарушением многих биохимических процессов, протекающих в этих клетках. Так, механическое напряжение стенки ЛЖ и нейрогуморальная активация, т. е. процессы, вызывающие гипертрофию миокарда, приводят к нарушению экспрессии генов, кодирующих сократительные белки, компоненты ионных каналов, ферменты, рецепторы клеточных мембран, вторичные посредники и пр. По данным экспериментальных исследований, изменения внутриклеточных структур кардиомиоцитов ведут к нарушениям депонирования ионов кальция в саркоплазматическом ретикулуме, снижению чувствительности миофибрилл к ионам кальция, разобщению процессов возбуждения и сокращения, нарушениям метаболизма энергии и пр. Полагают, что дисфункция кардиомиоцитов при СН обусловлена в первую очередь: 1) нарушением внутриклеточного метаболизма кальция и/или 2) изменением процессов биосинтеза и расщепления макроэргических фосфорных соединений. Вместе с тем, неясно, какие именно изменения структуры и функции кардиомиоцитов могут приводить к развитию СН, и поиск ответа на этот вопрос — одно из основных направлений современных научных исследований в кардиологии.
ПРОВОЦИРУЮЩИЕ ФАКТОРЫ
Многие больные с хронической СН длительное время не имеют явных клинических симптомов заболевания (например, при легких нарушениях сократимости миокарда или благодаря действию описанных выше компенсаторных механизмов). Нередко клинические проявления СН наблюдаются только на фоне провоцирующих факторов, сопряженных с увеличением нагрузки на миокард и развитием декомпенсированной дисфункции ЛЖ. В таблице 9.3 перечислены типичные факторы и состояния, провоцирующие возникновение симптомов СН. Так, симптомы СН могут развиваться при состояниях, сопровождающихся активацией метаболических процессов и, следовательно, требующих адекватного увеличения СВ (например, при лихорадке, инфекционных заболеваниях). Возникновение симптомов СН при тахиаритмиях связано с укорочением периода диастолического наполнения ЛЖ (и отсюда — снижением СВ), а также с увеличением потребности миокарда в кислороде. Брадиаритмии всегда сопровождаются уменьшением СВ (поскольку СВ = ЧСС х ударный объем) и, следовательно, также могут провоцировать возникновение симптомов СН. Избыточное потребление поваренной соли, почечная недостаточность, несоблюдение режима приема диуретиков нередко являются причиной увеличения ОЦК, нарушения венозного оттока и застоя в легких и системных венах. Неконтролируемая артериальная гипертензия часто сопровождается нарушением систолической функции ЛЖ вследствие увеличения пост-нагрузки. Массивные тромбоэмболии легочной артерии приводят не только к гипоксии (и снижению поступления кислорода в миокард), но и к значительному повышению пост-нагрузки на правый желудочек. Наконец, возникновение клинических симптомов у больных с компенсированной СН может быть следствием ишемии или инфаркта миокарда, потребления большого количества алкоголя или приема препаратов, обладающих отрицательным инотропным действием (p-адреноблокаторы, некоторые антагонисты кальция).
Таблица 9.3. Факторы, провоцирующие возникновение симптомов застоя у больных с компенсированной сердечной недостаточностью
Состояния, сопровождающихся активацией метаболических процессов
Лихорадка
Инфекция
Анемия
Тахикардия
Гипертиреоз
Беременность
Увеличение ОЦК (повышение преднагрузки)
Избыточное потребление поваренной соли
Избыточное потребление жидкости
Почечная недостаточность
Состояния, сопровождающиеся повышением постнагрузки
Нелеченная артериальная гипертензия
Эмболия легочной артерии (повышение постнагрузки на правый желудочек)
Состояния, сопровождающиеся нарушением сократимости миокарда
Препараты с отрицательным инотропным эффектом (р-адреноблокаторы)
Ишемия или инфаркт миокарда
Употребление алкоголя
Несоблюдение режима медикаментозной терапии сердечной недостаточности
Выраженная брадикардия
КЛИНИЧЕСКЕ ПРОЯВЛЕНИЯ
Клинические проявления СН обусловлены низким СВ и/или высоким венозным давлением и зависят от того, функции какого из желудочков сердца нарушены в большей степени (таблица 9.4). Симптомы СН могут нарастать постепенно или в некоторых случаях .(например, при быстрой декомпенсации ЛЖ) возникать внезапно в виде острого отека легких (см. ниже).
Таблица 9.4. Типичные клинические проявления сердечной недостаточности
Жалобы |
Данные осмотра |
|
Левожелудочковая недостаточность Диспноэ Ортопноэ Пароксизмальная ночная одышка Слабость |
Усиленное потоотделение Тахикардия, тахипноэ Влажные хрипы в легких Усиление легочного компонента II тона Ритм галопа (третий тон) ± четвертый тон |
Недостаточность по большому кругу Периферические отеки Дискомфорт в правом подреберье (из-за гепатомегалии) |
Набухание шейных вен Гепатомегалия Периферические отеки |
Жалобы
Самым выраженным симптомом хронической левожелудочковой недостаточности является одышка при нагрузке — ее происхождение главным образом связывают либо с венозным застоем в легких, либо с низким СВ. Увеличение давления в легочных венах выше 20 мм рт. ст. сопровождается пропотеванием жидкости в интерстициальную ткань, что может приводить к застою в легких. Следствием этого является ухудшение податливости легких и увеличение нагрузки на дыхательные мышцы, т. к. для сохранения того же объема дыхания больные должны развивать большее отрицательное внутригрудное давление. Кроме того, при избытке жидкости в интерстициальной ткани легких сдавливаются стенки бронхиол и альвеол, что препятствует движению воздушного потока и требует дополнительных усилий при дыхании. Наконец, при отеке интерстициальной ткани легких активируются юкстакапиллярные рецепторы (J-рецепторы), стимуляция которых сопровождается учащенным поверхностным дыханием. Вместе с тем, нередко одышка у больных СН, даже при отсутствии отека легких, является следствием недостаточного кровоснабжения усиленно работающих дыхательных мышц и накопления в них большого количества молочной кислоты. Одышка у больных СН, возникающая первоначально только на фоне физической нагрузки, по мере прогрессирования заболевания может наблюдаться и в состоянии покоя.
К типичным проявлениям СН и низкого СВ относят спутанность сознания и уменьшение дневного диуреза (вследствие гипоперфузии головного мозга и почек, соответственно). Нередко у больных этой категории усилен ночной диурез, т. к. в положении лежа кровоснабжение почек улучшается. Следствием недостаточного снабжения скелетных мышц кислородом может быть слабость и быстрая утомляемость.
Сердечная недостаточность может сопровождаться ортопноэ, ночными приступами сердечной астмы и ночным кашлем. Ортопноэ — это ощущение затрудненного дыхания в положении лежа и уменьшающееся в сидячем положении. Его причиной служит перераспределение крови из органов брюшной полости и нижних конечностей в легкие в положении лежа. На практике тяжесть ортопноэ можно оценить по количеству подушек, которые подкладывает больной во время сна для того, чтобы уменьшить одышку. В некоторых случаях ортопноэ бывает настолько выражено, что больные вынуждены спать в положении сидя.
Ночные приступы сердечной астмы — это тяжелые приступы одышки, от которых больной в испуге просыпается после 2—3 ч сна. Этот симптом наблюдается в положении лежа при проникновении в кровь жидкости из интерстициальных отеков нижних конечностей и последующем увеличении ОЦК и венозного возврата в сердце и легкие. Ночной кашель — еще один симптом застоя в легких; механизмы развития ночного кашля и ортопноэ во многом схожи. При СН может наблюдаться кровохаркание, обусловленное разрывом вен бронхов из-за их полнокровия.
Больные с правожелудочковой недостаточностью, сопровождающейся повышением давления в системных венах, нередко испытывают чувство дискомфорта или боль в правом подреберье вследствие избыточного кровенаполнения печени и растяжения ее капсулы. По этой причине скопление транссудата в брюшной полости (асцит), приводит к потере аппетита (анорексии) и тошноте. Повышение гидростатического давления в венах сопровождается периферическими отеками (особенно на лодыжках). Под влиянием силы тяжести отеки нижних конечностей усиливаются к концу дня, если больной длительное время находился в вертикальном положении, но могут полностью исчезать утром. Накопление большого количества интерстициальной жидкости нередко приводит к увеличению массы тела больного еще до появления периферических отеков.
На практике для оценки тяжести СН часто используют классификацию Нью-Йоркской Ассоциации кардиологов (таблица 9.5).
Физикальное обследование
Результаты физикального исследования зависят от тяжести и продолжительности заболевания, а также наличия у больного право- или левожелудочковой недостаточности (таблица 9.4). Лица с СН I-II функционального класса могут выглядеть вполне здоровыми, тогда как больные с тяжелой хронической формой заболевания бывают крайне истощены, в том числе из-за потери аппетита и возросших метаболических потребностей при затрудненном дыхании. При декомпенсированной левожелудочковой недостаточности нередко наблюдается диффузный цианоз (вследствие низкого СВ) и обильное потоотделение (из-за повышения активности симпатической нервной системы); в результате сужения периферических артерий конечности становятся холодными и бледными, часто развивается тахипноэ. У больных с тяжелой СН встречается дыхание Чейна-Стокса, при котором периоды гипервентиляции чередуются с апноэ разной продолжительности. Дыхание Чейна-Стокса у больных этой категории обусловлено увеличением времени прохождения импульсов между легкими и дыхательным центром продолговатого мозга (при СН нарушается механизм обратной связи, регулирующий степень оксигенации крови). Другим типичным признаком СН и гиперактивности симпатической нервной системы является синусовая тахикардия. Альтернирующий пульс (чередование высоких и низких пульсовых волн) обычно указывает на тяжелую дисфункцию ЛЖ.
Таблица 9.5. Функциональные классы сердечной недостаточности (по классификации Нью-Йоркской Ассоциации кардиологов) | |
I класс |
Физическая активность не ограничена |
II класс |
Легкое ограничение активности. Одышка и слабость после умеренной физической нагрузки (например, после быстрого подъема по лестнице) |
III класс |
Выраженное ограничение активности. Одышка после минимальной физической нагрузки (например, после медленного подъема по лестнице) |
IV класс |
Тяжелое ограничение активности. Симптомы сердечной недостаточности в покое |
У больных с левожелудочковой недостаточностью при аускультации легких выявляют влажные хрипы (чаще мелко- и среднепузырчатые), возникающие при освобождении мелких дыхательных путей, заполненных в начале вдоха транссудатом. На начальных стадиях заболевания влажные хрипы выслушиваются в нижних отделах легких в зонах с максимальным гидростатическим давлением, но по мере прогрессирования застойных явлений они распространяются вверх. Сдавление дыхательных путей при выраженном отеке легких может сопровождаться возникновением сухих, свистящих хрипов — этот симптом иногда называют «сердечной астмой».
При пальпации области сердца обращают внимание на верхушечный толчок, характер которого зависит от причин развития СН: разлитой (при дилатационной кардиомиопатии), «продолжительный» (при перегрузке давлением вследствие аортального стеноза или артериальной гипертензии) или «приподнимающий» (при перегрузке объемом, например, вследствие митральной недостаточности). Высокое давление наполнения ЛЖ приводит к повышению давления в сосудах легких, что сопровождается усилением легочного компонента II тона (так как захлопывание клапана легочной артерии происходит с силой). У взрослых больных часто выявляют протодиастолический тон (S3), возникающий при наполнении расширенной полости ЛЖ (глава 2). Пресистолический тон (S4) возникает во время интенсивного сокращения предсердий и наполнения кровью полости ЛЖ, стенки которого частично утратили эластичность (диастолическая дисфункция ЛЖ). При левожелудочковой недостаточности иногда выявляют шум митральной регургитации, обусловленный растяжением митрального кольца и увеличением расстояния между папиллярными мышцами вследствие дилатации ЛЖ (что приводит к неполному захлопыванию створок митрального клапана во время систолы).
Существует несколько дополнительных физикальных признаков правожелудочковой недостаточности. Так, у больных этой категории вдоль парастернальной линии иногда ощущается толчок правого желудочка; свидетельствующий о его дилатации, а также выслушивается правожелудочковый ритм галопа (S3, S4) или шум трикуспидальной недостаточности, обусловленный дилатацией правого желудочка (так же, как шум митральной недостаточности является следствием дилатации ЛЖ). Повышение системного венозного давления, обусловленное недостаточной сократительной способностью правого желудочка, приводит к набуханию шейных вен, гепатомегалии и болезненности в правом подреберье. Нередко возникают периферические отеки: у ходячих больных — преимущественно на лодыжках и ступнях, а при постельном режиме — в области крестца.
Плевральный выпот может наблюдаться как при правожелудочковой, так и при левожелудочковой недостаточности (вены плевры получают кровь из большого и малого кругов кровообращения). На плевральный выпот может указывать притупленный перкуторный звук над нижне-задними отделами легких.
Данные инструментальных исследований
Давление в левом предсердии (ЛП) в норме не превышает 10 мм рт. ст., и при его увеличении до 15 мм рт. ст. или более на рентгенограмме грудной клетки наблюдают характерное изменение легочного рисунка — сосуды верхних долей становятся крупнее сосудов нижних долей легких (рис. 3.5). Причина этого заключается в следующем: при вертикальном положении тела больного кровоток в нижних отделах легких обычно интенсивнее, чем в верхушках (в силу эффекта гравитации), однако интерстициальные и периваскулярные отеки, наиболее выраженные в основании легких (где выше гидростатическое давление), приводят к сдавлению сосудов нижних отделов, мало влияя на кровеносные сосуды верхушек легких. При увеличении давления в ЛП до 20 мм рт. ст. легочный рисунок становится размытым, и появляются В-линии Керли (горизонтальные линейные тени на рентгенограмме нижних отделов легких, наблюдаемые при отеке междольковых перегородок). Повышение давления в ЛП до 25—30 мм рт. ст. и более может приводить к развитию альвеолярного отека легких и затемнениию легочных полей на рентгенограмме. Необходимо отметить, что при хронической СН изменения легочного рисунка при повышении давления в ЛП нередко могут быть выражены менее четко, чем ожидалось, ввиду того, что происходит компенсаторное усиление оттока лимфы.
При рентгенографическом исследовании у больных СН обычно выявляют кардиомегалию (увеличение кардиоторокального индекса во фронтальной проекции > 50%, см. главу 3). Повышение давления в правом предсердии нередко сопровождается расширением непарной и полунепарной вен. Плевральный выпот может наблюдаться как при правожелудочковой, так и при левожелудочковой недостаточности, однако чаще всего возникает у больных с дисфункцией обоих желудочков сердца.
Анамнестические данные и результаты физикального исследования нередко позволяют выявить причины СН (например, перенесенный обширный инфаркт миокарда, митральный стеноз и пр.). В более сложных случаях для установления этиологии заболевания необходимо провести дополнительные инструментальные исследования. При дифференциальной диагностике СН решающее значение имеет наличие систолической дисфункции ЛЖ (рис. 9.6). Существует большое количество неинвазивных методов оценки функции ЛЖ, например: эхокардиография и изотопная вентрикулография (эти методы описаны в главе 3). Некоторым больным для выявления причин СН показана катетеризация сердца (поражение клапанов, ишемия миокарда и пр.).
ПРОГНОЗ
Прогноз СН при отсутствии адекватной терапии основного заболевания неблагоприятный — через 5 лет после установления диагноза в живых остается только 50% больных. Наиболее высока смертность среди больных с тяжелой СН (III-IV функциональных классов NYHA), выживаемость которых в течение 1 года не превышает 40%. Высокая смертность больных этой категории обусловлена, в основном, выраженной СН, рефрактерной к проводимой терапии. Вместе с тем, при СН часто отмечаются желудочковые аритмии, которые, вероятно, являются основной причиной внезапной смерти этих больных. По данным клинических исследований, повышению выживаемости больных СН способствует медикаментозная терапия некоторыми препаратами сосудорасширяющего действия.
ЛЕЧЕНИЕ
Лечение больных СН зависит от этиологии заболевания. В этом разделе основное внимание уделяется медикаментозной терапии наиболее распространенной формы СН — систолической дисфункции ЛЖ. Лечение больных этой категории должно быть направлено на достижение следующих основных целей:
1. Выявление и лечение основного заболевания, приведшего к развитию СН. Так, некоторым больным может потребоваться протезирование клапанов сердца, аортокоронарное шунтирование, интенсивная антигипертензивная терапия или полный отказ от употребления алкоголя.
2. Устранение факторов, провоцирующих развитие декомпенсации у больных с компенсированной СН (например, адекватная терапия инфекционных заболеваний, аритмий и пр.).
3. Лечение декомпенсации СН:
• Уменьшение застоя в малом и большом круге кровообращения: ограничение потребления поваренной соли и медикаментозная терапия, направленная на выведение из организма избытка воды и натрия (в первую очередь — диуретики). Для уменьшения застойных явлений на практике с успехом применяют препараты с инотропным и сосудорасширяющим действием, прием которых способствует повышению СВ, улучшению перфузии почек и повышению диуреза (см. ниже).
• Увеличение СВ и улучшение кровоснабжения жизненно важных органов. В клинической практике чаще всего применяются препараты инотропного действия, усиливающие сократимость миокарда, и сосудорасширяющие средства, механизм действия которых описан ниже.
4. Повышение выживаемости больных. В настоящее время получены убедительные доказательства того, что терапия некоторыми препаратами сосудорасширяющего действия способствует увеличению продолжительности жизни больных с СН.
Диуретики
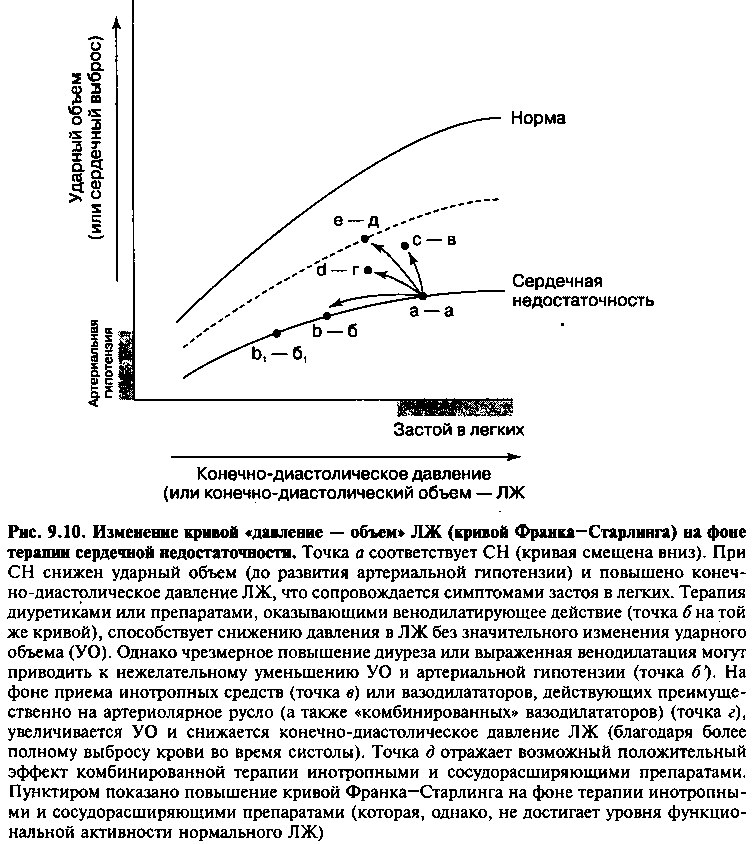
Механизм действия и фармакологические свойства диуретических препаратов подробно описаны в Главе 17. Препараты этого класса усиливают выведение почками воды и натрия, что сопровождается уменьшением ОЦК и венозного возврата. Как следствие, снижается преднагрузка и диастолическое давление в ЛЖ, что предотвращает застой в легких (рис. 9.10, б). Адекватная терапия диуретиками не приводит к клинически значимому уменьшению СВ, поскольку функционирование ЛЖ у больных с застойной СН соответствует «плоскому» участку кривой Франка-Старлинга. Цель терапии диуретиками заключается в том, чтобы уменьшить конечно-диастолическое давление (и, следовательно, ослабить действие гидростатических сил, приводящих к застою в легких) без существенного снижения ударного объема. Вместе с тем, усиление диуреза может сопровождаться снижением давления наполнения ЛЖ до уровня, соответствующего крутому участку функциональной кривой ЛЖ, приводя к нежелательному уменьшению СВ (рис. 9.10, б). Очевидно, что диуретики следует применять только при наличии симптомов застоя в легких (влажные хрипы) или периферических отеках.
При застойной СН наиболее эффективны диуретики, действующие на петлю Генле (фуросемид, буметанид, этакриновая кислота). На практике с успехом применяют и тиазидные диуретики, но они менее эффективны при снижении кровоснабжения почек, типичном для больных СН. Основные побочные эффекты диуретиков перечислены в главе 17. На фоне приема препаратов этого класса у больных СН нередко наблюдают чрезмерное усиление диуреза, что может сопровождаться нежелательным снижением СВ и нарушениями водно-электролитного баланса — в первую очередь, гипокалиемией и гипомагниемией, сопряженными с риском развития опасных для жизни аритмий. Назначать диуретики больным с выраженной диастолической дисфункцией ЛЖ следует с осторожностью, избегая чрезмерного усиления диуреза, т. к. у больных этой категории для адекватного наполнения ЛЖ необходимо повысить диастолическое давление наполнения (рис. 9.7Б). Следовательно, некоторое увеличение давления наполнения может оказывать положительный эффект у больных с диастолической дисфункцией ЛЖ.
Препараты инотропного действия
К лекарственным средствам, обладающим инотропным действием, относятся сердечные гликозиды, агонисты ^-адренорецепторов и ингибиторы фосфодиэстеразы (см. главу 17). Препараты этих групп повышают концентрацию внутриклеточного кальция, что сопровождается усилением сократимости миокарда и смещением кривой Франка—Старлинга вверх (рис. 9.10). Как следствие, при любом конечно-диастолическом объеме (преднагрузке) увеличивается ударный объем и СВ. Эти препараты показаны при лечении больных с систолической, но не диастолической дисфункцией ЛЖ.
Больным с тяжелой формой заболевания, получающим лечение в стационаре, для временного поддержания показателей гемодинамики иногда внутривенно вводят агонисты ^-адренорецепторов (добутамин, дофамин). Длительное применение этих препаратов ограничено, в связи с отсутствием лекарственных форм для перорального приема и быстро развивающейся толерантности — прогрессивном снижении их терапевтической эффективности вследствие уменьшения количества адренорецепторов в миокарде по принципу обратной связи. Ингибиторы фосфодиэстеразы обычно применяют при тяжелой СН I1I-IV функционального класса, требующей внутривенной терапии. Несмотря на высокую эффективность ингибиторов фосфодиэстеразы в начале лечения, результаты клинических исследований свидетельствуют о том, что терапия этими препаратами не способствует значительному увеличению продолжительности жизни больных.
В клинической практике из всех препаратов инотропного действия наиболее широкое распространение получили сердечные гликозиды (глава 17), которые назначают как внутривенно, так и перорально. Сердечные гликозиды усиливают сократимость миокарда, уменьшают дилатацию ЛЖ, увеличивают СВ и способствуют ослаблению симптомов СН. На фоне приема сердечных гликозидов повышается чувствительность барорецепторов, и, следовательно, рефлекторно снижается симпатический тонус, что приводит к уменьшению постнагрузки на ЛЖ у больных СН. Кроме того, сердечные гликозиды позволяют контролировать частоту сердечных сокращений, что оказывает дополнительный положительный эффект у больных с сопутствующей мерцательной аритмией. Терапия сердечными гликозидами ослабляет симптомы СН, но не способствует увеличению продолжительности жизни больных этой категории. Препараты этого класса нецелесообразно применять при лечении больных с диастолической дисфункцией ЛЖ, т. к. они не улучшают расслабления желудочка.
Р-Адреноблокаторы
Ранее считали, что 0-адреноблокаторы противопоказаны при систолической дисфункции ЛЖ, поскольку их отрицательное инотропное действие может привести к усилению симптомов заболевания. Вместе с тем, результаты недавно проведенных клинических исследований указывают на то, что терапия 0-адреноблокаторами парадоксальным образом способствует увеличению СВ и нормализации показателей гемодинамики. Механизм этого явления пока не изучен, но полагают, что положительную роль в этих случаях может играть уменьшение частоты сердечных сокращений, ослабление симпатического тонуса и антиишемический эффект 0-адреноблокаторов, В настоящее время применение 0-адреноблокато-ров при лечении больных с СН остается предметом клинических исследований.
Вазодилататоры
Вазодилататоры, особенно ингибиторы ангиотензинпревращающего фермента относятся к препаратам первого ряда при лечении больных СН. Ранее отмечалось, что активация компенсаторных нейроэндокринных механизмов при СН нередко сопровождается нежелательным сосудосуживающим эффектом, задержкой воды и натрия в организме и увеличением ОЦК. Вазодилататоры позволяют преодолеть эти неблагоприятные последствия действия «компенсаторных» механизмов. Более того, по данным большого количества клинических исследований, терапия некоторыми препаратами сосудорасширяющего действия способствует существенному увеличению выживаемости больных СН. Фармакологические свойства этих препаратов подробно обсуждаются в главе 17.
Препараты, оказывающие преимущественно венодилатирующее действие (например, нитраты), увеличивают емкость венозного русла, снижают венозный возврат и, тем самым, уменьшают преднагрузку ЛЖ. Как следствие, уменьшается диастолическое давление в ЛЖ и гидростатическое давление в легочных капиллярах (эти изменения напоминают гемодинамические эффекты терапии диуретиками). Все это способствует уменьшению застоя в легких и поддержанию нормального СВ, несмотря на снижение давления наполнения ЛЖ (если функциональное состояние ЛЖ у больного с СН соответствует «пологому» участку кривой Франка-Старлинга, рис. 9.10). С другой стороны, если функциональное состояние ЛЖ соответствует «крутому» участку кривой Франка—Старлинга, то выраженная дилатация емкостных вен может приводить к нежелательному снижению ударного объема, СВ, АД и кровоснабжения периферических органов.
Препараты, расширяющие преимущественно периферические артериолы (например, гидралазин), снижают ОПСС и постнагрузку на ЛЖ, что способствует более сильному сокращению миофибрилл во время систолы (рис. 9.5Б). Как следствие, увеличивается ударный объем сердца, что на диаграмме Франка—Старлинга соответствует сдвигу кривой вверх и влево (рис. 9.10). Можно ожидать, что на фоне приема сосудорасширяющих препаратов уровень АД у больных с СН, многие из которых имеют артериальную гипотензию, будет снижаться в еще большей степени. Однако в действительности этого, как правило, не происходит. Уменьшение сосудистого сопротивления при дилатации артериол обычно сопровождается увеличением СВ, а уровень АД не изменяется или снижается незначительно.
Некоторые вазодилататоры способны действовать как на венозное, так и на артериолярное русло. Наиболее важными из них являются ингибиторы ангиотензинпревращающего фермента (АПФ). Эти препараты блокируют образование мощного вазоконстриктора АП, продукция которого усиливается при СН. Более того, на фоне терапии ингибиторами АПФ снижается уровень альдостерона, что способствует выведению из организма натрия, снижению ОЦК и ослаблению симптомов застоя в большом и малом круге кровообращения. Результаты клинических исследований свидетельствуют о том, что ингибиторы АПФ высокоэффективны при лечении больных, перенесших инфаркт миокарда (особенно при выраженном снижении сократимости ЛЖ (глава 7).
По данным широкомасштабных клинических исследований, терапия ингибиторами АПФ не только оказывает положительный эффект на показатели гемодинамики, но и сопровождается достоверным увеличением продолжительности жизни больных с хронической СН. Поэтому современные ингибиторы АПФ являются препаратами первого выбора при лечении больных с дисфункцией ЛЖ. Показано, что длительная терапия изосорбидом динитратом в сочетании с гидралазином (препараты, расширяющие, соответственно, венозное и артериолярное русло) также повышает выживаемость больных с умеренной СН. Однако, по данным сравнительных клинических исследований, эффективность ингибитора АПФ эналаприла достоверно выше, чем комбинации гидралазина и изосорбида динитрата. В настоящее время гидралазин и изосорбид динитрат целесообразно назначать только тем больным, которые плохо переносят ингибиторы АПФ.
Таким образом, при традиционной медикаментозной терапии застойной СН, сопровождающейся дисфункцией ЛЖ, больным следует назначать вазодилататоры (в основном — ингибиторы АПФ), диуретики и/или сердечные гликозиды. Как правило, лечение начинают небольшими дозами ингибиторов АПФ, при наличии симптомов и признаков застоя в малом или большом круге добавляют диуретики. Больным, которые плохо переносят ингибиторы АПФ, можно назначить гидралазин в комбинации с изосорбида динитратом. Если симптомы сохраняются или СВ остается низким, целесообразно применение сердечных гликозидов.
Кроме того, больным с нарушением систолической функции ЛЖ нередко назначают: 1) антикоагулянты (для профилактики тромбоэмболий, особенно при выраженной дисфункции ЛЖ, однако эффективность такой терапии пока не подтверждена результатами контролируемых клинических исследований); и 2) антиаритмические препараты (для предотвращения предсердных и желудочковых аритмий, часто развивающихся на фоне хронической СН, см. главу 12). При тяжелой дисфункции ЛЖ и неэффективности активной медикаментозной терапии следует рассмотреть вопрос о пересадке сердца.
Лечение больных с диастолической дисфункцией ЛЖ
Лечение больных с нарушением диастолической функции ЛЖ должно быть направлено на выявление и коррекцию основного заболевания. Так, при констриктивном перикардите больному может быть показана пери-кардэктомия (глава 14), в других случаях будет необходимо медикаментозное или оперативное лечение ишемической болезни сердца (если диастолическая дисфункция ЛЖ обусловлена преходящими эпизодами ишемии миокарда). Не существует общих рекомендаций по применению инотропных средств у больных с выраженной диастолической дисфункцией ЛЖ. Терапия диуретиками способствует уменьшению периферических отеков и застойных явлений в легких, однако применять препараты этого класса следует с осторожностью, избегая снижения СВ или уровня АД, т.к. для поддержания СВ давление наполнения ЛЖ (частично утратившего эластичность) должно быть выше нормального. При нарушении диастолической функции ЛЖ вследствие артериальной гипертензии или гипертрофической кардиомиопатии с успехом применяют антагонисты кальция, однако эти препараты малоэффективны у больных с нарушением диастолической функции ЛЖ другой этиологии.
ОСТРЫЙ ОТЕК ЛЕГКИХ
Кардиогенный отек легких — тяжелая форма острой левожелудочковой недостаточности — возникает при увеличении гидростатического давления в легочных капиллярах и быстром накоплении жидкости в ин-терстиции с последующим выпотом в альвеолы. Это состояние нередко сопровождается гипоксемией вследствие внутрилегочного шунтирования крови (через невентилируемые участки легких). Отек легких часто развивается внезапно, например, при остром инфаркте миокарда или у больных с компенсированной СН под действием провоцирующих факторов (табл. 9.3). Отек легких для больного — ужасающий опыт борьбы за глоток воздуха, потому что он сопровождается тяжелой одышкой и удушьем.
При осмотре у больных отмечается тахикардия, кожа холодная, бледная, покрыта липким потом вследствие повышения симпатического тонуса и спазма периферических сосудов. Тахипноэ и розовая пенистая мокрота при кашле указывают на скопление транссудата в альвеолах. Первоначально в нижних отделах, а затем над всеми участками легких выслушиваются влажные хрипы, иногда сопровождающиеся свистящими хрипами из-за скопления жидкости в дыхательных путях.
При нормальном осмотическом давлении плазмы крови отек легких обычно возникает, когда давление в легочных капиллярах (пропорциональное диастолическому давлению в ЛЖ) превышает 25 мм рт. ст. (или более 30 мм рт. ст. у больных с постоянно высоким давлением заклинивания легочной артерии).
Отек легких — угрожающее жизни состояние, требующее немедленного медицинского вмешательства, восстановления оксигенации крови и устранения причин отека. Больному придают вертикальное положение, чтобы кровь скапливалась в крупных венах нижних конечностей и уменьшился венозный возврат. Больному дают кислород через маску, а для уменьшения тревоги и расширения периферических вен внутривенно вводят сульфат морфина. Для снижения преднагрузки ЛЖ и гидростатического давления в легочных капиллярах назначают быстродействующие диуретики (например, фуросемид в/в) или нитраты (часто — внутривенно), а в экстренных случаях проводят кровопускание. Для увеличения СВ вводят инотропные препараты. После устранения отека легких и гипоксемии необходимо выявить основное заболевание и назначить больному адекватное лечение.
ЗАКЛЮЧЕНИЕ
1. Сердечная недостаточность — это состояние, при котором сердечный выброс не обеспечивает метаболических потребностей организма (или они обеспечиваются только при значительном увеличении давления наполнения ЛЖ). Чаще всего СН возникает вследствие нарушения систолической функции ЛЖ, но может наблюдаться и при диастолической дисфункции ЛЖ, а также других заболеваниях, сопряженных с нарушением наполнения или выброса крови из ЛЖ.
2. При СН активируются некоторые компенсаторные механизмы, направленные на поддержание сердечного выброса и АД, включая: 1) увеличение ударного объема по закону Франка-Старлинга, 2) развитие гипертрофии ЛЖ и 3) активацию нейроэндокринных систем.
3. Симптомы СН могут усиливаться под действием провоцирующих факторов, сопряженных с возрастанием метаболических потребностей организма, увеличением объема циркулирующей крови, повышением постнагрузки или снижением сократимости миокарда (табл. 9.3).
4. Для эффективного лечения больных с СН необходимо выявить основное заболевание и устранить провоцирующие факторы. Медикаментозная терапия СН включает адекватное применение вазодилататоров (в первую очередь — ингибиторов АПФ), диуретиков и инотропных средств.