Клапанные пороки серрдца
В этой главе рассматриваются патофизиология и клинические проявления клапанных пороков сердца. Все наиболее распространенные пороки будут рассматриваться по отдельности, так как не все случаи стеноза или недостаточности клапанов подчиняются единым патофизиологическим законам.
Обследование больного с клапанным пороком начинается с его тщательного расспроса и физикального исследования, которые обычно позволяют опытному врачу определить тип клапанной патологии. Для точного определения степени поражения необходима дополнительная информация, которую дает электрокардиография, рентгенография органов грудной клетки и эхокардиография. Помимо этого, отдельным пациентам для уточнения тяжести порока и контроля лечения могут понадобиться такие дополнительные методы, как проба с физической нагрузкой и катетеризация сердца. Таким образом, для эффективного лечения больных клапанными пороками сердца требуется точная диагностика порока, определение его тяжести и четкое понимание патофизиологических последствий и прогноза заболевания.
РЕВМАТИЧЕСКАЯ ЛИХОРАДКА
Острая ревматическая лихорадка (ОРЛ) ранее была одной из наиболее часто встречающихся причин поражения клапанов сердца, но в последние 50 лет в развитых странах заболеваемость ею значительно снизилась. В сороковые годы XX века заболеваемость ОРЛ в США превышала 200000 в год; ныне она представляется редкостью. Снижению заболеваемости непосредственно предшествовало появление пенициллина, а также общее улучшение работы органов здравоохранения и уменьшение скученности населения. В последние годы появились сообщения об отдельных вспышках болезни в США, но они носят локальный характер. Тем не менее, в развивающихся странах Среднего Востока, Юго-Восточной Азии и в Индии ОРЛ остается распространенным заболеванием, нередко оканчивающимся летально.
ОРЛ — это воспалительное заболевание, поражающее в первую очередь сердце, кожу и соединительную ткань. ОРЛ является осложнением инфекций верхних дыхательных путей, вызываемым стрептококками группы А, и обычно оно развивается в детском и юношеском возрасте. По эпидемиологическим данным, ОРЛ развивается приблизительно у 3% больных острым стрептококковым фарингитом через 2—3 недели после первичной инфекции. Патогенез ОРЛ остается неизвестным, но он не связан с непосредственным бактериальным поражением сердца. Гипотетические механизмы включают выработку стрептококками токсинов и аутоиммунный процесс вследствие перекрестного реагирования между антйтелами к бактериальным антигенам и антигенами эндокарда. Наиболее частыми симптомами являются озноб, лихорадка, мигрирующие артралгии и слабость. Основные симптомы, являющиеся диагностическими критериями ОРЛ, известны как критерии Джонса (таблица 8.1).
Таблица 8.1. Критерии Джонса (диагностические критерии ревматической лихорадки1)
* Для установления диагноза требуется наличие признаков стрептококковой инфекции в сочетании с 2 большими критериями, или 1 большим и 2 малыми.
Патоморфологически при ревмокардите (то есть при воспалительном процессе в сердце) могут поражаться все три оболочки сердца. Патогномоничными являются «гранулемы Ашоффа», представляющие собой участок фибриноидного некроза, окруженный воспалительными клетками, включая лимфоциты, плазматические клетки и макрофаги, которые со временем исчезают, оставляя за собой рубцовую ткань. Наиболее опасным последствием является вовлечение в воспалительный процесс клапанного эндокарда, что ведет к хроническому ревматическому поражению сердца, характеризующемуся прогрессирующей деформацией и нарушением функции одного или нескольких клапанов. Тем не менее, симптомы дисфункции клапанного аппарата обычно появляются только через 10—30 лет после ОРЛ (в развивающихся странах, при более активном процессе, латентный период может быть короче).
В остром периоде ревмокардит может сопровождаться снижением сократимости левого желудочка и преходящими шумами митральной и аортальной регургитации, а также «шумом Кери-Кумбса», среднедиастолическим шумом на верхушке сердца, вероятнее всего отражающим турбулентность потока через воспаленный митральный клапан. Лечение ОРЛ включает высокие дозы аспирина с противовоспалительной целью, пенициллин для элиминации остаточной стрептококковой инфекции и лечение осложнений (застойная сердечная недостаточность, перикардит).
Большие критерии |
Кардит |
Полиартрит |
Хорея |
Кольцевидная эритема (покраснение кожи с более яркими краями и светлым |
центром) |
Подкожные узелки |
Малые критерии |
Ревматическая лихорадка в анамнезе |
Мигрирующие артралгии |
Лихорадка |
Повышение острофазовых показателей (СОЭ, лейкоцитоз) |
Удлинение интервала PR на электрокардиограмме |
Признаки стрептококковой инфекции |
Антитела (анти-О-стрептолизин) |
Положительный результат мазка из глотки на стрептококки группы А |
Недавно перенесенная скарлатина |
В хронической фазе часто встречается стеноз или недостаточность митрального клапана. У 40% пациентов с ревматизмом развивается стеноз левого атриовентрикулярного отверстия (или, для краткости, митральный стеноз). У 25% больных кроме митрального поражается еще и аортальный клапан. Изредка отмечают также пороки трикуспидального клапана.
Острая ревматическая лихорадка рецидивирует у 10% пациентов, и рецидив может усугубить поражение сердца. Поэтому перенесшие ОРЛ больные должны профилактически получать небольшие дозы пенициллина приблизительно до 30 лет, когда частота контакта со стрептококком и подверженность этой инфекции заметно снижаются.
МИТРАЛЬНЫЕ ПОРОКИ
Стеноз левого атриовентрикулярного отверстия
этиология
Митральный стеноз (МС) почти всегда является следствием перенесенной ревматической лихорадки, так что практически у всех взрослых с этим пороком при аутопсии находят типичную ревматическую деформацию клапана. Примерно у 50% лиц с клинически выраженным митральным стенозом в анамнезе есть указания на ОРЛ, перенесенную примерно за 20 лет до манифестации порока. Другими редкими причинами МС (менее 1% случаев) являются врожденный стеноз левого атриовентрикулярного отверстия, у пожилых — кальцификация створок клапана, распространяющаяся на них с фиброзного кольца, или эндокардит с очень большими вегетациями, создающими препятствие кровотоку.
МОРФОЛОГИЯ
Острое и рецидивирующее воспаление вызывает типичные патомор-фологические проявления ревматического МС. Они включают фиброзное уплотнение и кальцификацию створок клапана, сращение их по комиссурам (зонам соприкосновения створок), утолщение и укорочение сухожильных хорд.
ПАТОФИЗИОЛОГИЯ
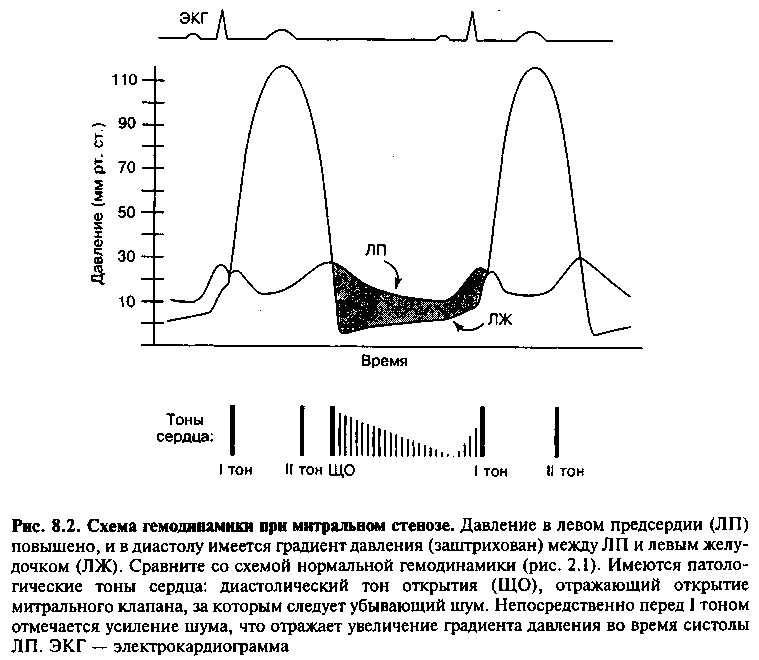
В норме в начале диастолы митральный клапан открывается и кровь беспрепятственно течет из левого предсердия (ЛП) в левый желудочек (ЛЖ). Градиент давления между двумя камерами практически отсутствует. При митральном стенозе, однако, имеется препятствие току крови через клапан, которое затрудняет опорожнение ЛП и способствует развитию патологического градиента давления между ЛП и ЛЖ (рис. 8.1, 8.2). В результате этого давление в левом предсердии превышает нормальное, благодаря чему кровь проталкивается через суженное отверстие. В норме

площадь отверстия митрального клапана составляет 4—6 см2. Митральный стеноз становится гемодинамически значимым при сужении отверстия до 2 см2 и менее. Хотя давление в левом желудочке при МС обычно нормально, в результате возросшего сопротивления митрального клапана его заполнение нарушается, что приводит к уменьшению ударного объема и сердечного выброса.
Высокое давление в левом предсердии при МС передается на малый круг кровообращения, приводя к повышению давления в легочных венах и капиллярах (рис. 8.1). Это повышение гидростатического давления в легочном сосудистом русле может вызвать транссудацию плазмы в легочное интерстициальное пространство и альвеолы, вызывая одышку и другие симптомы застойной сердечной недостаточности. В тяжелых случаях значительное повышение легочного венозного давления приводит к открытию коллатералей между легочными и бронхиальными венами. При этом высокое давление в малом круге кровообращения может спровоцировать разрыв бронхиальной вены в паренхиму легкого, что приводит к кровохарканью.
Повышение давления в левом предсердии при МС может привести к двум различным типам легочной гипертензии: пассивной и активной. У большинства больных с МС развивается пассивная легочная гипертензия. Она представляет собой «облигатное» повышение давления в легочной артерии, которое в условиях повышенного давления в левом предсердии и в легочных венах обеспечивает ток крови в правильном направлении. Кроме того, приблизительно 40% пациентов с МС имеют активную легочную гипертензию, которая характеризуется гипертрофией медии и фиброзом интимы легочных артериол. Активная легочная гипертензия развивается компенсаторно, так как более высокое сопротивление артериол препятствует кровотоку в полнокровное легочное капиллярное русло и снижает капиллярное гидростатическое давление. Таким образом, активная легочная гипертензия «защищает» легочные капилляры от еще более высокого давления и уменьшает застойные явления в легких. Однако эти преимущества достигаются ценой снижения легочного кровотока, что в конце концов приводит к повышению давления в правых камерах сердца. Хроническое повышение давления в правом желудочке приводит к его гипертрофии и, в конце концов, к правожелудочковой недостаточности.
Хроническая перегрузка левого предсердия давлением при МС приводит к увеличению его размера, растяжению волокон предсердной проводящей системы и, вследствие этого, к. мерцанию предсердий (см. главу 12 — быстрому нерегулярному ритму). Мерцательная аритмия при МС приводит к падению сердечного выброса из-за укорочения диастолы при высокой ЧСС, поскольку соответственно укорачивается и время протекания крови через суженное отверстие.
Относительный застой крови в дилатированном левом предсердии при МС, особенно при наличии мерцательной аритмии, предрасполагает к тромбообразованию внутри предсердия. В результате возможны тромбоэмболии периферических артерий, что приводит к таким опасным осложнениям, как окклюзия церебральных артерий (инсульт). Турбулентный поток крови через суженный митральный клапан при МС предрасполагает к развитию инфекционного эндокардита (см. ниже); однако при МС это осложнение встречается реже, чем при других приобретенных пороках сердца.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ОБСЛЕДОВАНИЕ
При отсутствии лечения МС приводит к существенному снижению продолжительности жизни — средняя выживаемость после появления клинических проявлений порока составляет около 7 лет. Даже больные со слабо выраженной симптоматикой без коррекции порока погибают в течение 10 лет (таблица 8.2).
Таблица 8.2. Результаты наблюдения за больными митральным стенозом без операции
Клиническая картина через 10 лет наблюдения, %
Клиническая картина на момент постановки диагноза |
Без изменений |
Ухудшение |
Умерли |
Симптомы отсутствуют |
59 |
25 |
16 |
Незначительно выраженная симптоматика |
21 |
21 |
58 |
Умеренно выраженная симптоматика |
4 |
11 |
85 |
Клинические проявления МС во многом зависят от степени сужения митрального отверстия. Чем тяжелее стеноз, тем более выражены проявления повышения давления в левом предсердии и легочных венах. Наиболее ранними из них являются одышка и снижение толерантности к физическим нагрузкам. При небольшой выраженности МС одышка в покое может отсутствовать; но она появляется при нагрузке из-за увеличения объема протекающей через сердце крови и ускорения сердечного ритма (и укорочения времени диастолического наполнения желудочка), которые способствуют росту давления в левом предсердии. Другими состояниями, приводящими к ускорению ритма сердца и увеличению кровотока, являются лихорадка, анемия, гипертиреоз, беременность и тахиаритмии (мерцание предсердий).
При более тяжелом МС (то есть при малой площади атриовентрикулярного отверстия) одышка появляется даже в покое. Развиваются прогрессирующая слабость и более тяжелые признаки застоя в малом круге — ортопноэ и приступы удушья по ночам. При тяжелом МС и легочной гипертензии появляются признаки правожелудочковой сердечной недостаточности: набухание яремных вен, гепатомеггетия, асцит и периферические отеки. Сдавление возвратного гортанного нерва увеличенной легочной артерией или левым предсердием может вызвать осиплость голоса.
Изредка митральный стеноз диагностируется после развития одного из своих осложнений — мерцательной аритмии, тромбоэмболий, инфекционного эндокардита, кровохаркания, описанных выше в разделе патофизиологии.
При физикальном исследовании можно обнаружить несколько типичных симптомов. При пальпации прекордиальной области часто обнаруживается правожелудочковый сердечный толчок вследствие повышения давления в правом желудочке. При аускультации практически у всех пациентов усилен I тон, ассоциирующийся с закрытием митрального клапана. Механизм его возникновения следующий: из-за высокого градиента давления между предсердием и желудочком элементы створок митрального клапана, сохранившие подвижность, максимально открыты в течение всей диастолы, а в начале систолы они из относительно широко раскрытого состояния быстро захлопываются, в результате чего громкость тона выше, чем в норме (см. главу 2).
Основным аускультативным признаком МС является высокочастотный «щелчок открытия» (ЩО), следующий за II тоном. Считается, что ЩО появляется из-за резкого натяжения сухожильных хорд и стенозированных створок клапана при его открытии. Продолжительность интервала между II тоном и ЩО обратно пропорциональна тяжести порока: чем тяжелее МС, тем выше давление в ЛП и тем раньше при диастолическом расслаблении ЛЖ открывается клапан. За ЩО следует диастолический низкочастотный убывающий шум вследствие турбулентного потока крови через стенозированный клапан (рис. 8.2). С тяжестью МС коррелирует продолжительность, а не громкость шума: чем тяжелее порок, тем более долгое время требуется для опорожнения ЛП и для исчезновения градиента между ЛП и ЛЖ. В конце диастолы вследствие сокращения левого предсердия градиент давления между ЛП и ЛЖ временно возрастает (рис. 8.2) и шум на короткое время делается громче. Такое пресистолическое усиление шума не происходит при развитии мерцательной аритмии, когда отсутствует эффективное сокращение предсердий.
Кроме того, у больных с МС часто выслушиваются шумы, характерные для других клапанных пороков. Например, МС часто сочетается с митральной недостаточностью (см. ниже). Помимо этого, развивающаяся при тяжелом МС правожелудочковая сердечная недостаточность обусловливает появление трикуспидальной регургитации. Убывающий диастолический шум вдоль левого края грудины может отмечаться вследствие сопутствующей аортальной недостаточности (ревматического происхождения) или недостаточности клапана легочной артерии (из-за легочной гипертензии вследствие митрального стеноза).
На ЭАГпри МС обычно обнаруживаются признаки увеличения левого предсердия и, при развитии легочной гипертензии, гипертрофия правого желудочка. Возможно мерцание предсердий. При рентгенографии органов грудной клетки выявляется увеличение левого предсердия, перестройка сосудистого рисунка, интерстициальный отек и линии Керли вследствие отека междолевых перегородок (см. главу 3). При развитии легочной гипертензии также выявляются увеличение правого желудочка и расширение легочных артерий.
Эхокардиография при митральном стенозе обладает наибольшей диагностической значимостью. Она позволяет увидеть утолщенные створки митрального клапана, ненормальное сращение их по комиссурам, ограничивающее раскрытие в диастолу. При эхокардиографии измеряется степень дилатации левого предсердия, возможна визуализация внутрипредсердных тромбов при их наличии. Площадь митрального кольца может быть непосредственно измерена планиметрически в поперечном сечении или рассчитана с помощью измерения скоростей при доплер-эхокардиографии.
Хотя для подтверждения диагноза МС катетеризация сердца не обязательна, она часто проводится для более точного измерения площади митрального кольца и выявления митральной регургитации, легочной гипертензии и коронарной болезни сердца.
ЛЕЧЕНИЕ
Лечение МС включает профилактику рецидива ОРЛ у молодых пациентов и инфекционного эндокардита у всех больных (см. ниже). Для уменьшения явлений застоя используются диуретики. При митральном стенозе, сочетающемся с нарушением сократительной функции левого желудочка или с мерцательной аритмией, показан дигоксин; причем в последнем случае его назначают с целью урежения сердечного ритма (см. главу 17). Для урежения ритма можно также использовать p-блокаторы или такие антагонисты кальция, как верапамил и дилтиазем. Антикоагулянтная профилактика тромбоэмболий показана при мерцателвной аритмии, застойной сердечной недостаточности или тромбоэмболии в анамнезе.
Если симптомы МС не устраняются диуретиками и контролем за ЧСС, требуется хирургическая коррекция порока. Чрескожная трансвенозная митральная вальвулопластика применяется с 1985 года и является «малоинвазивной» процедурой, осуществляемой при катетеризации сердца. При этом через бедренную вену в правое предсердие вводится баллонный катетер, затем проделывают маленькое отверстие в межпредсердной перегородке, через которое катетер проводят в левое предсердие и, наконец, к стенозированному митральному клапану. Там баллон быстро раздувается, разрывая сросшиеся комиссуры. Наибольший успех операции достигается при неосложненном МС, то есть при отсутствии митральной регургитации, кальцификации клапана и тромбоза предсердия. В рандомизированных исследованиях результаты этой методики оказались не хуже, чем при традиционном хирургическом лечении.
Хирургические методы коррекции МС включают открытую митральную комиссуротомию (операцию, при которой сросшиеся комиссуры разделяются непосредственно под контролем зрения) и, в тяжелых случаях, протезирование митрального клапана. Операционная летальность при протезировании митрального клапана приблизительно составляет 1—2%, а 10-летняя выживаемость превышает 80%, что является значительным достижением по сравнению с естественным течением болезни (табл. 8.2).
Недостаточность митрального клапана
этиология
В норме закрытие митрального клапана в систолу требует координированного действия всех компонентов клапанного аппарата. Поэтому митральная недостаточность (МН) может иметь в основе изменения структуры митрального кольца, створок клапана, сухожильных нитей и папиллярных мышц (таблица 8.3). Миксоматозная дегенерация клапана (это состояние называется «пролапсом митрального клапана») вызывает МН, поскольку в систолу увеличенные, растянутые створки не располагаются друг напротив друга, как в норме, а избыточно прогибаются в полость ЛП. При ишемической болезни сердца возможен некроз или транзиторная дисфункция папиллярных мышц, что сказывается на закрытии клапана. При инфекционном эндокардите причиной МН служат перфорация створки или разрыв инфицированной хорды. Первичный (идиопатический) разрыв сухожильных нитей ассоциируется с остро развивающейся тяжелой клапанной недостаточностью. Ревматизм может, как уже было сказано, приводить к МС, или в первую очередь вызывать митральную регургитацию, если преобладают укорочение сухожильных нитей и стягивание створок. Гипертрофическая кардиомиопатия (см. главу 10) ассоциируется с аномальным систолическим движением передней створки митрального клапана, что нарушает его закрытие и у 50% пациентов приводит к значимой МН. Значительная дилатация левого желудочка приводит к МН за счет двух механизмов: 1) увеличивается расстояние между папиллярными мышцами и 2) растягивается митральное кольцо. Кальцификация митрального кольца в старших возрастных группах может быть вариантом нормы, но все же она чаще встречается у пациентов с артериальной гипертензией или стенозом устья аорты. Кальцификация уменьшает подвижность базальных отделов створок, нарушая их экскурсию и систолическое закрытие.
Таблица 8.3. Частые причины митральной недостаточности
Миксоматозная дегенерация (пролапс митрального клапана) Ишемическая болезнь сердца с дисфункцией папиллярных мышц Инфекционный эндокардит
Идиопатический разрыв сухожильных нитей
Ревматическая деформация
Гипертрофическая кардиомиопатия (глава 10)
Дилатация левого желудочка любой этиологии
Патология митрального кольца (кальцификация или растяжение)
ПА ТОФИЗИОЛОГИЯ
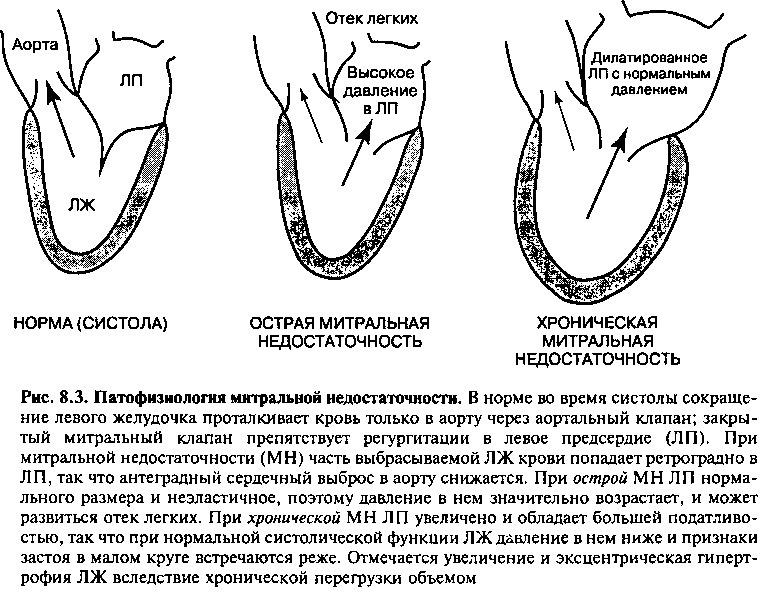
При МН часть ударного объема левого желудочка попадает обратно в ЛП, камеру с более низким давлением (рис. 8.3). В результате антеградный сердечный выброс (в аорту) меньше, чем общий выброс левого желудочка (антеградный кровоток + регургитация). Поэтому прямыми следствиями МН являются: 1) увеличение объема крови и давления в левом предсердии, 2) снижение антеградного сердечного выброса в аорту, 3) перегрузка левого желудочка объемом, так как объем регургитации возвращается в ЛЖ в диастолу вместе с нормальным количеством крови из легочных вен. С целью обеспечения нормального кровообращения и перекачивания дополнительного объема крови ударный объем ЛЖ должен увеличиваться. Это реализуется по механизму Франка—Старлинга (см. главу 9), то есть увеличение диастолического объема ЛЖ (преднагрузки) вызывает большее растяжение миофибрилл с увеличением ударного объема при последующем сокращении. Дальнейшие гемодинамические последствия МН зависят от тяжести и длительности существования порока.
Тяжесть МН и отношение антеградного сердечного выброса к объему регургитации обусловлены пятью факторами: 1) размером митрального отверстия во время регургитации, 2) систолическим градиентом давления между ЛЖ и ЛП, 3) системным сосудистым сопротивлением антеградному току крови из ЛЖ, 4) эластичностью левого предсердия и 5) продолжите-
явностью регургитации во время каждой систолы. Фракция регургитации при МН определяется по формуле:
Объем МР
Суммарный ударный объем ЛЖ
Этот показатель возрастает при любом повышении сопротивления аортальному кровотоку (то есть кровь выбирает путь с наименьшим сопротивлением). Так, высокое системное АД или сопутствующий стеноз устья аорты увеличивают фракцию регургитации. Эластичность левого предсердия (мера растяжимости камеры, описываемая как изменение объема в ответ на изменение давления на одну единицу) обусловливает рост давления в левом предсердии в ответ на объем регургитации. Например, при остро развившейся МН жесткость ЛП относительно велика, поэтому небольшое увеличение объема ЛП вызывает значительный прирост давления в нем, что предотвращает дальнейшую регургитацию. При высокой эластичности ЛП (например, вследствие его длительного растягивания при хронической МН) для достаточного роста внутрипредсердного давления и прекращения обратного тока крови требуется больший объем регургитации.
При острой МН (например, вследствие ишемии папиллярной мышцы или разрыва сухожильной хорды) эластичность левого предсердия нормальная (то есть относительно низкая) и объем внезапно появившейся регургитации приводит к резкому росту давления в ЛП (рис. 8.3). Это повышение давления в ЛП быстро передается на малый круг кровообращения, приводя к застойным явлениям и отеку легких, требующему неотложных мероприятий. При острой МН измерение давления в ЛП или давления заклинивания легочной артерии (непрямой способ оценки давления в ЛП, описанный в главе 3) демонстрирует типичную волну V, отражающую рост давления в ЛП в систолу (рис. 8.4). Кроме того, как и при
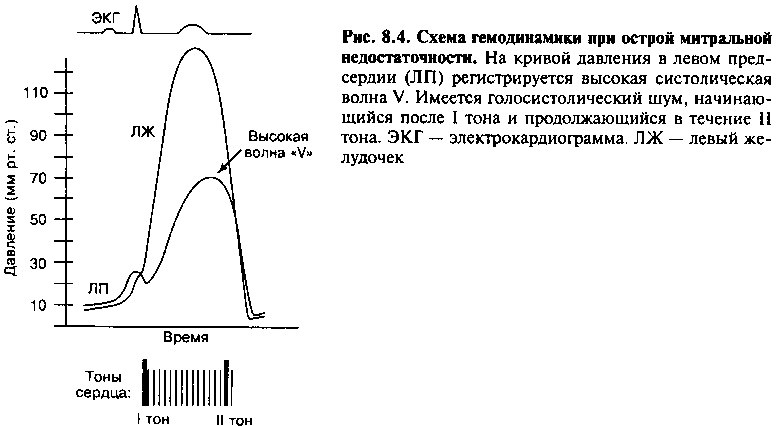
МС, давление в легочной артерии и правых отделах сердца пассивно повышается, чтобы обеспечить антеградный ток крови через сердце.
При острой МН ЛЖ справляется с увеличившимся притоком крови из ЛП за счет механизма Франка—Старлинга. Таким образом, увеличение объема ЛЖ приводит к 1) обязательному повышению диастолического давления в левом желудочке, 2) компенсаторному увеличению ударного объема ЛЖ, так что при отсутствии сердечной недостаточности в конце каждой систолы объем ЛЖ нормализуется. Систолическое опорожнение желудочка при МН облегчается более низким сопротивлением сокращению ЛЖ (то есть постнагрузка при этом ниже, чем в норме), поскольку часть выбрасываемой желудочком крови поступает в левое предсердие, давление в котором ниже, чем в аорте, куда кровь должна поступать в норме.
В отличие от острой ситуации, при более постепенном развитии хронической МН (например, вследствие ревматической деформации или хронического миксоматозного перерождения) ЛП подвергается компенсаторным изменениям, уменьшающим влияние регургитации на малый круг кровообращения (рис. 8.3). В частности, ЛП растягивается, его эластичность возрастает, так что оно может вмещать значительные объемы крови без существенного прироста давления. Таким образом, дилатация ЛП является компенсаторным механизмом, предотвращающим значительное повышение давления в малом круге. Однако ценой такой адаптации является неадекватный антеградный сердечный выброс, так как предпочтительным путем кровотока по сравнению с оказывающей большее сопротивление аортой становится эластичное ЛП с более низким сопротивлением. Соответственно при прогрессивном увеличении регургитации в ЛП начинают доминировать симптомы низкого сердечного выброса (например, слабость). Кроме того, хроническая дилатация ЛП предрасполагает к развитию мерцательной аритмии.
При хронической МН происходит также постепенная компенсаторная дилатация ЛЖ (эксцентрическая гипертрофия, см. главу 9). В отличие от острой МН, из-за повышения эластичности желудочка увеличение его объема не приводит к значительному росту давления. Антеградный выброс при хронической МН поддерживается на близких к норме значениях за счет механизма Франка—Старлинга, обеспечивающего высокий ударный объем. Однако с течением времени (обычно через несколько лет) хроническая перегрузка объемом приводит к нарушению систолической функции левого желудочка, снижению сердечного выброса и появлению симптомов сердечной недостаточности.
Итак, основные различия между острой и хронической митральной недостаточностью связаны с размером и эластичностью левого предсердия (рис. 8.3):
1. Острая митральная регургитация: нормальные размеры и эластичность ЛП, высокое давление в ЛП, высокое давление в легочных венах и отек легких.
2. Хроническая митральная регургитация: увеличение размеров и эластичности ЛП, близкие к норме показатели давления в ЛП и легочных венах, слабость вследствие низкого сердечного выброса.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ОБСЛЕДОВАНИЕ
Как уже должно быть очевидно из раздела патофизиологии, остро развившаяся МН обычно дебютирует симптомами отека легких (глава 9). Симптомы же хронической МН в основном обусловлены низким сердечным выбросом, особенно при нагрузке, и представлены слабостью и быстрой утомляемостью. Пациенты с тяжелой МН или с нарушенной систолической функцией ЛЖ часто жалуются на одышку, у них могут встречаться ортопноэ или приступы ночного удушья. При тяжелой хронической МН также могут появляться симптомы правожелудочковой недостаточности (асцит, периферические отеки).
При физикальном исследовании можно выявить голосистолический шум на верхушке, проводящийся в подмышечную область (рис. 8.4). Он характерен для ревматической МН; при других же ее причинах шум имеет свои особенности. Например, когда ишемическая дисфункция папиллярной мышцы сочетается с нормальным закрытием митрального клапана, струя регургитации может быть направлена к передней стенке левого предсердия, находящейся сразу за аортой. В этой ситуации шум будет лучше выслушиваться над аортой (глава 2) и может не занимать всю систолу. К счастью, систолические шумы МН и аортального стеноза (АС) можно различить при динамической аускультации. Если попросить пациента сжать руки в кулак, системное сосудистое сопротивление возрастет и увеличится выраженность МН и сопровождающего ее шума, а при АС интенсивность шума не изменится. Еще более полезным дифференциальнодиагностическим признаком является влияние изменения продолжительности сердечного цикла (интервала между двумя последовательными сокращениями) на интенсивность систолического шума. У больных с мерцательной аритмией или частыми экстрасистолами степень заполнения левого желудочка прямо пропорциональна длине предшествующего сердечного цикла (то есть, при более длинном цикле заполнение больше). Систолический шум при АС становится громче после длинного сердечного цикла из-за увеличения градиента давления между двумя камерами. При МН громкость шума при изменении продолжительности кардиоциклов существенно не меняется, так как градиент давления между Л Ж и ЛП остается прежним.
Кроме систолического шума, обычной находкой при хронической МН является III тон, отражающий увеличение объема крови, возвращающегося в левый желудочек в начале диастолы. При хронической МН из-за увеличения левого желудочка верхушечный толчок часто смещен латера-льно, в сторону подмышечной области.
При рентгенографии органов грудной клетки у больных с хронической МН можно выявить увеличение левого предсердия и желудочка. Можно также обнаружить одну из причин регургитации — кальцификацию митрального кольца. Йа ЭКГ обычно видны признаки увеличения левого предсердия и гипертрофии левого желудочка. Эхокардиография часто позволяет выявить структурные изменения митрального клапана и, при применении цветной доплерографии, степень выраженности МН. Можно оценить размеры левого желудочка и его функцию (при отсутствии декомпенсации — обычно усиленную из-за увеличения ударного объема). Катетеризация сердца применяется для диагностики ИБС как причины недостаточности (то есть дисфункции папиллярных мышц) и для оценки тяжести регургитации. Характерным гемодинамическим отклонением является большая волна V на кривой давления заклинивания легочной артерии (отражающая давление в левом предсердии) (рис. 8.4).
ПРОГНОЗ И ЛЕЧЕНИЕ
Прогноз хронической МН зависит от ее причины. Например, ревматическая МН отличается очень медленным прогрессированием; 15-летняя выживаемость достигает 70%. С другой стороны, течение МН любой этиологии может внезапно ухудшиться при присоединении осложнений, таких как разрыв сухожильной нити или эндокардит, что требует неотложного вмешательства.
Медикаментозное лечение митральной недостаточности направлено на увеличение антеградного сердечного выброса и уменьшение регургитации в ЛП, а также на снижение выраженности легочного застоя. При острой МН с явлениями сердечной недостаточности лечение включает внутривенное введение диуретиков для купирования отека легких и вазодилататоров (например, нитропруссида натрия) для уменьшения сопротивления антеградному кровотоку и увеличения сердечного выброса. При хронической МН увеличение антеградного кровотока может быть достигнуто назначением пероральных вазодилататоров, таких как ингибиторы ангиотензинпревращающего фермента или гидралазин.
Поскольку хроническая МН вызывает постоянную перегрузку ЛЖ объемом, с течением времени она может привести к нарушению его сократительной функции и, в конце концов, к сердечной недостаточности. Оперативное лечение порока должно проводиться до развития дисфункции левого желудочка, но, учитывая операционную смертность и ограничения, связанные с протезированными клапанами, хирургическое вмешательство стараются максимально отсрочить. Несмотря на более чем 30-летний опыт, определение сроков вмешательства у больного с хронической МН остается одной из самых сложных проблем в практической кардиологии. Это связано с отсутствием четких доказательств улучшения выживаемости после протезирования митрального клапана по сравнению с естественным течением болезни (из-за потенциальных осложнений, связанных с наличием искусственных клапанов), даже при улучшении состояния больных после операции. К счастью, последние достижения хирургии позволяют проводить многим больным реконструктивные операции на митральном клапане, а не его протезирование, и, таким образом, избегать проблем, связанных с искусственными клапанами. Реконструктивные операции включают хирургическое восстановление структур клапана, ответственных за регургитацию. Например, на перфорированную створку накладывают заплату из аутологичного перикарда, а разорванную сухожильную нить подшивают к папиллярной мышце. У таких пациентов послеоперационная выживаемость лучше, чем при естественном течении болезни, что стимулирует проведение подобных операций в ранние сроки.
Операционная летальность составляет приблизительно 2—4% при реконструкции клапана и 8—10% при его протезировании. 10-летняя выжи-вамость составляет более 80% при реконструкции клапана и 50% при его протезировании. В целом, реконструктивные операции на клапане более показаны молодым пациентам с миксоматозной дегенерацией клапана, а протезирование чаще используется у пожилых больных с более тяжелым нарушением его структуры.
Пролапс митрального клапана
Пролапсом митрального клапана (ПМК) называется частое и обычно бессимптомное состояние, при котором створки митрального клапана во время систолы желудочков прогибаются внутрь левого предсердия; иногда это сопровождается митральной регургитацией. Это состояние обозначается также как «гибкий» митральный клапан, миксоматозный митральный клапан или синдром Барлоу. Морфологической основой ПМК является удлинение створок клапана, особенно задней. В норме створки состоят из плотного коллагена и эластинового матрикса. При ПМК нормальная ткань фрагментарно замещается рыхлой «миксоматозной» соединительной ткайью. Кроме того, в более тяжелых случаях, возможны удлинение или разрывы сухожильных нитей, растяжение митрального кольца или утолщение створок. Пролапс митрального клапана имеется примерно у 3—5% здоровой популяции, чаще у женщин. Эта аномалия может наследоваться самостоятельно по аутосомно-доминантному типу или быть симптомом других болезней соединительной ткани, таких как синдромы Марфана и Элерса—Данло.
Пролапс митрального клапана часто протекает бессимптомно, но некоторые больные могут жаловаться на боли в грудной клетке или сердцебиение из-за сопутствующих нарушений ритма. Чаще всего он выявляется при обычном обследовании, когда внимание врача привлекают «щелчок» в середине систолы и поздний систолический шум, лучше всего выслушиваемый на верхушке сердца. Считается, что причиной систолического щелчка является внезапное натяжение пораженной створки или сухожильных нитей в момент резкого прогибания створки в предсердие, а систолический шум является следствием потока регургитации через несостоятельный клапан. Щелчок и шум типичным образом меняются во время динамической аускультации: приемы, повышающие объем ЛЖ (например, быстрое приседание), отсрочивают прогибание створок, так что и щелчок, и шум во время систолы выслушиваются позже (то есть дальше от I тона). Напротив, при уменьшении объема крови в левом желудочке (например, при резком вставании), щелчок и шум выслушиваются раньше (то есть ближе к I тону). Диагноз подтверждается эхокардиографией, которая показывает систолическое смещение назад одной или обеих створок митрального клапана. ЭКГ и рентген органов грудной клетки обычно не выявляют отклонений от нормы, кроме тех случаев, когда хроническая МН приводит к увеличению левого предсердия и желудочка.
Клиническое течение пролапса митрального клапана большей частью благоприятное. От врача в первую очередь требуется успокоить пациента и убедить его в хорошем прогнозе, хотя отдельным больным, при выраженном утолщении створок или МН, показана антибиотикопрофилактика инфекционного эндокардита. Наиболее частым осложнением является возникновение медленно прогрессирующей митральной регургитации. Иногда вследствие разрыва миксоматозно измененной сухожильной нити может отмечаться внезапное появление тяжелой регургитации и отека легких. К другим редким осложнениям относятся инфекционный эндокардит, периферические эмболии вследствие образования микротромбов на увеличенных створках, а также наджелудочковые и желудочковые аритмии.
АОРТАЛЬНЫЕ ПОРОКИ
Аортальный стеноз
этиология
Раньше аортальный стеноз (АС) в основном бывал ревматической этиологии; в настоящее время у лиц старше 65 лет, как правило, он является следствием сенильной дегенерации, а в возрасте моложе 65 лет — кальциноза врожденного двустворчатого клапана. У тех же, у кого АС имеет ревматическую природу, в 95% случаев он сочетается с ревматическим поражением митрального клапана.
МОРФОЛОГИЯ
Патоморфологические изменения при аортальном стенозе зависят от его этиологии:
1. При сенильном АС в результате длительного «изнашивания» эндотелий и фиброзный слой клапана повреждаются, что в конце концов выливается в кальцификацию в других отношениях нормального клапана. Поэтому признаки этого порока обычно обнаруживают у людей старше 70 лет.
2. При наличии врожденного порока двухстворчатого клапана аорты, аномальный кровоток через клапан в течение многих лет приводит к повреждению эндотелия и коллагенового матрикса створок клапана, что приводит к постепенному отложению кальция, как и при сенильной форме, однако кальцификация развивается на десятки лет раньше.
3. При ревматическом АС воспаление эндокарда приводит к склерозу клапана, сращению комиссур, а также к отложению кальция в толще створок.
Независимо от причины, на далеко зашедших стадиях порок имеет единую патоморфологическую картину. В глубине фиброзного слоя створок имеются кальцинаты, которые растут к поверхности, образуя выпуклые или узелковые структуры, достигающие иногда синусов Вальсальвы в корне аорты.
ПА ТОФИЗИОЛОГИЯ
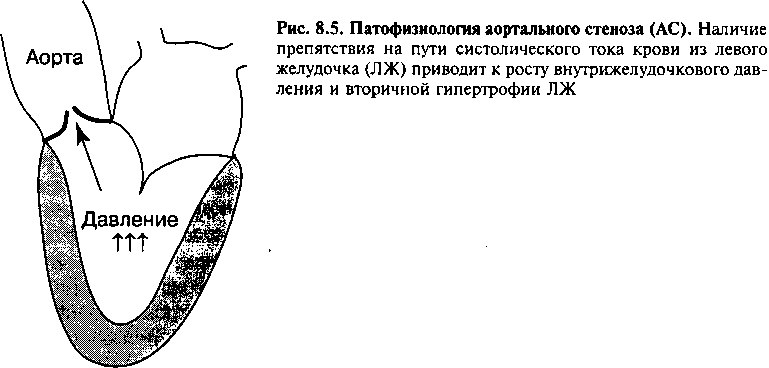
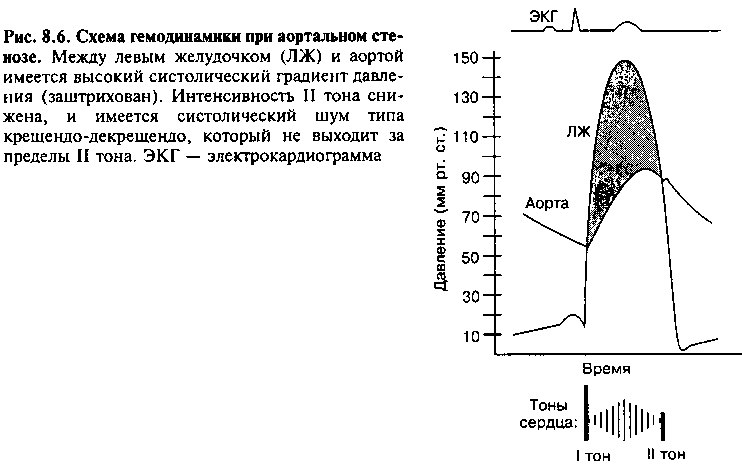
При АС имеется препятствие систолическому кровотоку через аортальный клапан (рис. 8.5). Когда площадь просвета уменьшается более чем на 50% от нормальной, для проталкивания крови в аорту требуется значительное повышение давления в левом желудочке (рис. 8.6). При далеко зашедшем пороке градиент давления между ЛЖ и аортой может составлять 100 мм рт. ст. и более.
С течением времени в ответ на высокое систолическое давление, которое он должен поддерживать, развивается концентрическая гипертрофия левого желудочка. Гипертрофия имеет важное компенсаторное значение, поскольку позволяет уменьшить напряжение стенки (глава 6); однако из-за нее снижается эластичность желудочка. В результате повышается диастолическое давление в ЛЖ, что приводит к гипертрофии ЛП, которому приходится заполнять «жесткий» ЛЖ. Хотя в норме сокращение левого предсердия обеспечивает только небольшую часть ударного объема левого желудочка, при АС его вклад может составлять более 25% от ударного объема жесткого ЛЖ. Таким образом, гипертрофия левого предсердия является компенсаторным механизмом, и потеря его эффективного сокращения (например, в случае развития мерцательной аритмии) может привести к выраженному ухудшению состояния больного.
Тремя основными симптомами, встречающимися у пациентов с далеко зашедшим АС (подробнее о них будет сказано ниже) являются: 1) застойная сердечная недостаточность, 2) стенокардия и 3) обмороки; все они имеют патофизиологическое объяснение. На ранних стадиях АС ненормальное повышение давления в ЛП происходит в основном в конце диастолы, когда при систоле предсердий кровь поступает в утолщенный, неэластичный желудочек. В результате среднее давление в левом предсердии и давление в легочных венах на ранних стадиях болезни существенно не меняются. По мере прогрессирования стеноза, вследствие перегрузки давлением, развивается систолическая дисфункция ЛЖ, что приводит к увеличению конечного диастолического объема и давления в левом желудочке. Сопутствующее значительное повышение давления в ЛП и легочных венах вызывает отек легочных альвеол и застойную сердечную недостаточность.
Вследствие значительного дисбаланса между доставкой кислорода к миокарду и потребностью в нем аортальный стеноз может привести к стенокардии. Потребность миокарда в кислороде увеличивается за счет двух причин. Во-первых, увеличивается мышечная масса ЛЖ, и требуется большая, чем в норме, перфузия. Во-вторых, из-за повышения систолического давления в желудочке увеличивается напряжение его стенки. Кроме того, при АС уменьшается доставка кислорода к миокарду, так как из-за повышенного диастолического давления в левом желудочке снижается градиент перфузионного давления между аортой и миокардом (особенно в субэндокардиальных слоях, где интрамуральное давление максимально).
И, наконец, АС может вызывать обмороки. Хотя гипертрофированный левый желудочек и может создавать высокое давление и обеспечивать нормальный сердечный выброс в покое, он не может значительно увеличивать сердечный выброс при физической нагрузке из-за фиксированного диаметра стенозированного отверстия. Кроме того, нагрузка приводит к расширению сосудов в скелетных мышцах. Таким образом, сочетание периферической вазодилатации и неспособности увеличивать сердечный выброс ведет к снижению церебрального перфузионного давления и, в некоторых случаях — к обморокам при нагрузке.
В норме площадь аортального кольца превышает 3 см2. Когда площадь кольца уменьшается до 1,2 см2 и менее, возникает значительный градиент давления между ЛЖ и аортой (умеренный АС). Если площадь аортального кольца менее 0,7 см2, говорят о критическом стенозе устья аорты.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ОБСЛЕДОВАНИЕ
Долгие годы медленного бессимптомного прогрессирования клапанного стеноза завершаются появлением стенокардии, обмороков и застойной сердечной недостаточности. После появления этих симптомов смертность начинает заметно расти, если только не производится хирургическая коррекция порока (табл. 8.4).
Таблица 8.4. Средняя выживаемость при клинически выраженном аортальном стенозе
Клиническая симптоматика |
Средняя выживаемость |
|
Стенокардия Обмороки Застойная сердечная недостаточность Мерцательная аритмия |
3 года 2 года
|
Выявить аортальный стеноз и оценить его тяжесть часто можно уже при физикальном исследовании. Ключевыми признаками являются: 1) грубый, с поздним максимумом, систолический шум изгнания (рис. 8.6) и 2) малый («parvus») и медленный («tardus») пульс на сонных артериях вследствие препятствия току крови из левого желудочка. Другими частыми симптомами являются наличие IV тона (из-за сокращения предсердия в условиях повышенной жесткости желудочка) и ослабление или полное отсутствие аортального компонента второго тона (рис. 8.6).
На ЭКГ при выраженном пороке часто имеются признаки гипертрофии левого желудочка, хотя более чувствительным методом оценки толщины стенки ЛЖ является эхокардиография. Трансклапанный градиент давления может быть оценен на основании доплеровского измерения скоростей. Катетеризация сердца применяется для оценки тяжести АС и уточнения анатомии коронарного русла, поскольку больные с сопутствующей ИБС нередко нуждаются в одновременном протезировании аортального и операции аортокоронарного шунтирования.
ЛЕЧЕНИЕ
Прогноз при тяжелом, клинически выраженном аортальном стенозе без хирургического лечения крайне неблагоприятен. По данным клиники Мейо, без операции в течение 1 года выживают только 57% больных с тяжелым АС. Единственным эффективным методом лечения далеко зашедшего АС является хирургическая замена аортального клапана.
Протезирование аортального клапана показано пациентам с клинически выраженным или тяжелым АС. После протезирования клапана фракция выброса левого желудочка практически всегда возрастает, даже если исходно она была сниженной. Протезирование аортального клапана оказывает очень благоприятное влияние на прогноз: после операции 10-летняя выживаемость превышает 75%.
В отличие от митрального стеноза, результаты чрескожной баллонной ангиопластики при аортальном стенозе оставляют желать лучшего, поэтому рутинно эта процедура не проводится. Иногда она выполняется как паллиативное вмешательство для временного облегчения симптомов у пожилых больных с тяжелой клиникой, у которых риск операции очень велик.
Бессимптомный АС легкой степени выраженности прогрессирует медленно, и только у 20% больных за 20 лет наблюдения формируется тяжелый клинически выраженный стеноз. Тактика ведения пациентов с бессимптомным АС подразумевает тщательное динамическое наблюдение, антибиотикопрофилактику эндокардита и отказ от препаратов, способных спровоцировать у этих больных артериальную гипотензию (то есть вазодилататоров, диуретиков, нитроглицерина).
Недостаточность аортального клапана
этиология
Аортальная недостаточность (АН), также обозначаемая как недостаточность аортального клапана, может возникать вследствие: 1) поражения створок аортального клапана или 2) расширения корня аорты. Наиболее частые причины АН перечислены в таблице 8.5.
Таблица 8.5. Примеры аортальной недостаточности
Повреждение створок клапанов
1. Ревматическое
2. Эндокардит
3. Врожденное (двустворчатый клапан) Расширение корня аорты
1. Аневризма/расслоение аорты
2. Растяжение аортального кольца
3. Синдром Марфана
4. Сифилис
ПА ТОФИЗИОЛОГИЯ
При АН имеется отсутствующий в норме обратный ток крови из аорты в ЛЖ во время систолы. Поэтому при каждом сокращении ЛЖ должен помимо нормального объема крови, притекающего из ЛП, перекачивать еще и объем регургитации. Гемодинамическая компенсация при этом основана на механизме Франка—Старлинга, благодаря которому увеличивается ударный объем. Факторы, определяющие тяжесть АН, аналогичны имеющим место при митральной недостаточности: 1) величина клапанного отверстия во время регургитации, 2) трансклапанный градиент давления в диастолу, 3) продолжительность диастолы.
Как и при митральной недостаточности, гемодинамические нарушения и симптоматика различны при острой и хронической АН (рис. 8.7). При острой АН ЛЖ имеет нормальные размеры и сравнительно низкую эластичность стенок. Поэтому перегрузка объемом при недостаточности ведет к значительному повышению диастолического давления в ЛЖ. Быстрое возрастание диастолического давления передается на ЛП и малый круг кровообращения, часто приводя к одышке и отеку легких. Поэтому внезапное развитие тяжелой АН является острым хирургическим заболеванием, требующим немедленного протезирования клапана.
При хронической АН в ответ на длительное существование порока ЛЖ претерпевает ряд компенсаторных изменений. АН преимущественно вызывает перегрузку ЛЖ объемом, однако также и давлением; поэтому ком-
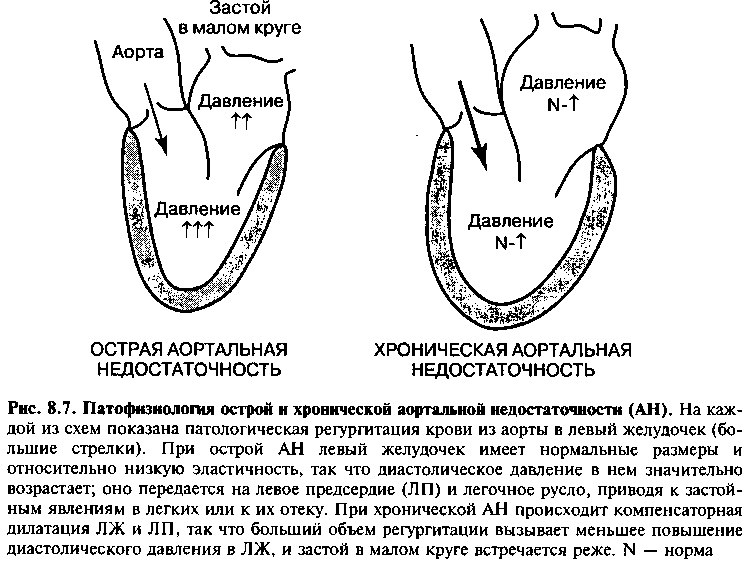
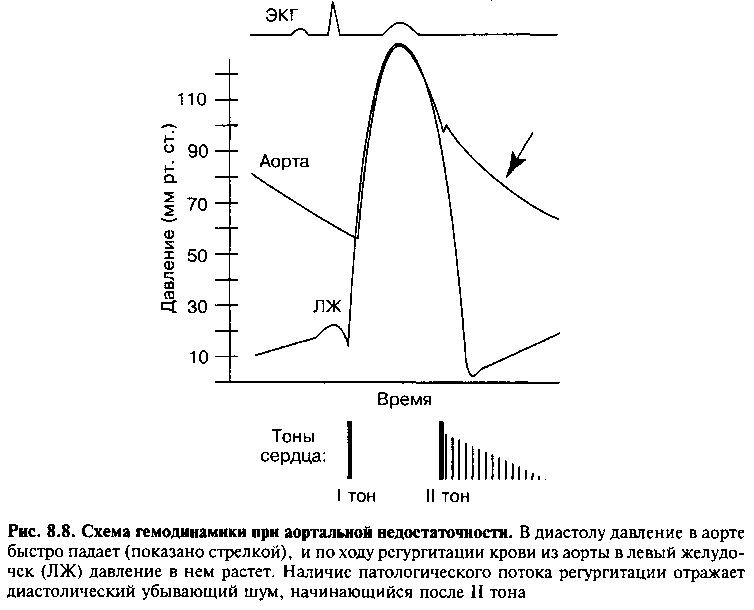
пенсаторными реакциями являются дилатация и, в меньшей степени, гипертрофия. С течением времени за счет дилатации повышается эластичность ЛЖ, который может вмещать большой объем регургитации без значительного повышения диастолического давления. Поэтому не происходит выраженного увеличения давления в ЛП и малом круге кровообращения. Однако, делая возможной регургитацию значительных объемов крови во время диастолы, дилатация ЛЖ заставляет существенно снижаться диастолическое давление в аорте, а с ним и системное диастолическое давление. Комбинация возросшего ударного объема ЛЖ (и, вследствие этого, высокого систолического артериального давления) со сниженным диастолическим давлением в аорте приводит к увеличению пульсового давления (разницы между систолическим и диастолическим давлением), характерному для аортальной недостаточности (рис. 8.8). В результате снижения диастолического давления в аорте падает перфузионное давление в коронарном русле, и доставка кислорода к миокарду уменьшается. К этому фактору присоединяется еще увеличение размера левого желудочка (которое, в свою очередь, повышает напряжение стенки и потребность миокарда в кислороде), и в результате у больных с АН стенокардия может отмечаться даже в отсутствии коронарной болезни сердца.
Поскольку дилатация и гипертрофия ЛЖ обычно компенсируют гемодинамические нарушения при хронической АН, пороку свойственно длительное бессимптомное течение. Тем не менее, прогрессирующее ремоделирование ЛЖ нарушает систолическую функцию миокарда. Это в свою очередь ведет к дальнейшему снижению антеградного выброса и повышению давления в левом предсердии и в малом круге. На этой стадии у больного появляются признаки сердечной недостаточности.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ОБСЛЕДОВАНИЕ
Наиболее частыми симптомами хронической АН являются одышка при физической нагрузке, слабость, снижение толерантности к нагрузкам и неприятное ощущение усиленного сердцебиения из-за высокого пульсового давления. При физикальном исследовании можно выявить «скачущий» пульс (вследствие высокого пульсового давления), усиленный верхушечный толчок и дующий протодиастолический шум вдоль левого края грудины (рис. 8.8). Лучше всего этот шум выслушивается на выдохе, когда пациент наклоняется вперед.
При хронической АН рентгенография органов грудной клетки выявляет расширение сердечной тени за счет левого желудочка. При острой АН оно, как правило, отсутствует; в этой ситуации чаще обнаруживают признаки застоя в легочных сосудах. Доплер-эхокардиография позволяет выявить АН, оценить ее степень, нередко можно также выявить причину порока. Катетеризация сердца применяется для оценки функции левого желудочка, оценки тяжести АН и выявления сопутствующей ИБС.
ЛЕЧЕНИЕ
По данным Национального института здоровья, у 60% больных хронической бессимптомной АН с нормальной сократительной функцией ЛЖ за 10-летний период наблюдения не возникает клинического ухудшения. Поэтому больным с доклинической стадией болезни показано только динамическое наблюдение, включающее периодическую оценку функции ЛЖ (обычно с помощью эхокардиографии), и антибиотикопрофилактика эндокардита. Состояние больных с клиническими проявлениями болезни и сохраненной функцией ЛЖ улучшается при терапии диуретиками и вазодилататорами, например, ингибиторами АПФ или гидралазином, которые снижают постнагрузку. Недавно было показано, что антагонист кальция нифедипин способен тормозить дилатацию ЛЖ, увеличивать его фракцию выброса и удлинять время до операции у больных с тяжелой хронической АН и сохраненной систолической функцией ЛЖ.
Появление клинической симптоматики у пациента с хронической АН обычно отражает снижение сократительной функции ЛЖ. Больные с клинически выраженной тяжелой хронической АН или пациенты без жалоб, но с признаками нарушения систолической функции ЛЖ, в результате регургитации должны направляться на операцию протезирования клапана, которая предотвращает дальнейшее ухудшение функции ЛЖ.
ТРИКУСПИДАЛЬНЫЕ ПОРОКИ
Трикуспидальный стеноз1
Трикуспидальный стеноз (ТС) обычно имеет ревматическое происхождение. Как и при МС, при этом пороке выслушиваются тон открытия и диастолический шум, однако в этом случае шум выслушивается ближе к грудине и усиливается на вдохе вследствие усиления кровотока в правых отделах сердца. При ТС отмечаются набухание шейных вен и увеличение волны «а» на кривой пульса вследствие усиления сокращения правого предсердия для преодоления суженного трикуспидального кольца. Больным обычно показано хирургическое лечение (вальвулопластика или протезирование клапана).
Трикуспидальная недостаточность
Трикуспидальная недостаточность (TH) чаще бывает «функциональной», а не органической природы, развиваясь вследствие увеличения правого желудочка при его перегрузке давлением или объемом, а не вследствие первичного поражения клапана. 20% больных с ревматическим митральным стенозом имеют значительную TH, которая в 80% случаев является «функциональной» и развивается из-за легочной гипертензии с увеличением правого желудочка, а только в 20% оставшихся случаев имеет органическую природу из-за ревматического поражения трехстворчатого клапана. Наиболее чувствительными физикальными признаками являются выраженные волны «V» пульсации яремных вен и пульсация печени из-за регургитации крови из правого желудочка в полые вены. Систолический шум TH выслушивается справа от мечевидного отростка. Обычно он слабый, но усиливается на высоте вдоха. Доплер-эхокардиография является чувствительным методом выявления и оценки степени TH. Лечение функциональной TH направлено в первую очередь на устранение состояний, сопровождающихся увеличением объема правого желудочка или давления в нем; также применяются диуретики, в тяжелых случаях показана хирургическая реконструкция клапана.
ПОРОКИ КЛАПАНА ЛЕГОЧНОЙ АРТЕРИИ
Стеноз устья легочной артерии
Причиной стеноза устья легочной артерии (СУЛА) наиболее часто является врожденная деформация клапана. В тяжелых случаях градиент давления превышает 80 мм рт. ст.,, при умеренной степени порока градиент составляет 40—80 мм рт. ст., а в легких случаях — менее 40 мм рт. ст. Клинические проявления развиваются при градиенте давления > 40 мм рт. ст.
Эффективным методом лечения больных с тяжелым или клинически выраженным СУЛА является катетерная баллонная вальвулопластика.
Недостаточность клапана легочной артерии
Недостаточность клапана легочной артерии (ЛН) часто возникает при тяжелой легочной гипертензии вследствие расширения легочной артерии и дилатации клапанного кольца. При аускультации вдоль левого края грудины выслушивается высокочастотный убывающий шум, который часто невозможно отличить от шума аортальной регургитации (эти два состояния можно легко дифференцировать с помощью доплер-эхокардиогра-фии). Обычно лечение направлено на устранение причины легочной гипертензии.
ПРОТЕЗИРОВАННЫЕ КЛАПАНЫ
После операции протезирования клапанов у больных часто отмечается значительное улучшение гемодинамики и, соответственно, клинической картины, однако само наличие внутрисердечного протеза связано с риском возможных осложнений. Поскольку все имеющиеся сейчас протезы обладают определенными ограничениями, протезирование клапанов не является истинным «излечением».
Современные протезы клапанов делятся на механические и биологические (из животных или человеческих тканей). Старые модели механических протезов относились к типу шариковых, они были довольно объемными и нередко вызывали значительный трансклапанный градиент, а иногда провоцировали внутрисосудистый гемолиз из-за механической травмы эритроцитов. Эти клапаны, однако, поставили впечаляющий рекорд прочности — некоторые модели нормально функционировали по 30 и более лет. Более новые протезы, такие как двустворчатый протез госпиталя св. Иуды, были более плоскими и имели гемодинамические преимущества (меньшие трансклапанные градиенты) без существенного проигрыша в прочности. Клапан госпиталя св. Иуды является шарнирным двустворчатым протезом, состоящим из двух пирополимерных углеродных дисков. Диски открываются друг напротив друга, как двери салуна на Старом Западе.
Несмотря на свою высокую прочность, механические протезы обладают рядом недостатков: в частности, они представляют собой инородную тромбогенную поверхность и требуют постоянной системной антикоагуляции (обычно варфарином) для профилактики тромбоэмболий.
Наиболее часто используемые биопротезы представляют собой фиксированные глутаральдегидом свиные клапаны на поддерживающей рамке. В последние годы также появились протезы из бычьего перикарда и замороженные человеческие трупные протезы. По сравнению с механическими клапанами биопротезы обладают ограниченной прочностью, так что в течение 10 лет до 50% клапанов претерпевают структурные изменения, а после этого срока случаи отказа клапана учащаются еще более. Частота деструкции клапана сильно зависит от его позиции. Так, биопротезы в митральной позиции изнашиваются быстрее, чем в аортальной, это, возможно, объясняется тем, что митральный клапан закрывается во время систолы, а значит, створки при этом подвержены большему напряжению, чем створки аортального клапана, которые закрываются при меньшем давлении в диастолу. Основными причинами нарушения функции биопротезов являются разрывы створок и кальцификация. Несмотря на высокую частоту разрушения, для биопротезов клапанов характерен низкий риск тромбоэмболий и отсутствие необходимости в постоянном приеме антикоагулянтов.
Общим для всех типов клапанных протезов является высокий риск инфекционного эндокардита, частота развития которого составляет 1—2% в год. При развитии эндокардита в первые 60 дней после операции смертность очень высока и достигает 50—80%. При более позднем развитии эндокардита смертность составляет 20—50%. При эндокардите искусственного клапана обычно требуется повторная операция, поскольку почти во всех случаях рядом с клапаном имеется абсцесс (сам протез инфицироваться не может). В некоторых случаях эндокардит биологического протеза клапана поддается лечению одними антибиотиками.
При использовании механических и биопротезов клапанов сердца смертность и частота осложнений после первых 10 лет после операции одинакова.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Микробная инфекция эндокардиальной поверхности сердца, включая его клапаны, различными микроорганизмами является тяжелым состоянием, которое может привести к поражению многих органов и тканей и часто заканчивается летально. Даже в условиях адекватной терапии летальность составляет 10—30%, а при отсутствии своевременного распознавания и правильного лечения достигает 100%.
Клиническая классификация инфекционного эндокардита (ИЭ) основывается на трех признаках: 1) на клиническом течении, 2) на его субстрате и 3) на этиологическом принципе. Согласно первой из классификаций, ИЭ называется острым бактериальным эндокардитом (ОБЭ) при остром развитии симптоматики и тяжелом течении. Возбудителем болезни чаще всего является высоковирулентный и инвазивный микроорганизм, например, золотистый стафилококк. Из-за высокой агрессивности возбудителя ОБЭ может развиваться на ранее интактных клапанах. При менее остром течении говорят о подостром бактериальном эндокардитом (ПБЭ), который вызывается менее вирулентной флорой, например, зеленящим стрептококком. ПБЭ наиболее часто развивается у лиц с предшествующей патологией клапанов.
В зависимости от поражающегося у больного субстрата (второй классификационный принцип) ИЭ делится на: 1) эндокардит нативных клапанов (ЭНК), 2) эндокардит протезированных клапанов (ЭПК) и 3) эндокардит при внутривенной наркомании (ЭВН). До 60-80% инфекционного эндокардита приходятся на ЭНК. Для каждой из этих разновидностей характерны своя доминирующая микрофлора и свои особенности течения. Например, представитель микрофлоры кожи эпидермальный стафилококк является частой причиной эндокардита протезированных клапанов, но почти не встречается при поражении нативных клапанов.
Третий классификационный принцип основан на микробиологической характеристике возбудителя (например, «эндокардит, вызванный золотистым стафилококком»). В оставшейся части этой главы будет использоваться деление эндокардитов по клиническому течению, но следует помнить, что на практике используются все три классификации.
Патогенез
В патогенезе эндокардита задействовано несколько факторв: 1) повреждение эндокарда, 2) тромбообразование в месте повреждения, 3) бактериемия и 4) адгезия бактерий к поврежденной эндокардиальной поверхности. Первые два фактора создают благоприятные условия для инфицирования, а два последних обусловливают инвазию возбудителя внутрь эндокарда. Наиболее частой причиной повреждения эндотелия является турбулентный кровоток вследствие патологии клапанного аппарата, когда высокоскоростные потоки крови механически повреждают поверхность эндотелия. Более чем у 70% больных удается выявить лежащие в основе эндокардита структурные и гемодинамические нарушения (таблица 8.6). Инородные тела в кровеносном русле, такие как центральные венозные катетеры и клапанные протезы, также могут вызывать повреждение эндотелия.
Таблица 8.6. Предрасполагающие к эндокардиту заболевания сердца
• Ревматические клапанные пороки
• Другие приобретенные пороки сердца:
Аортальный стеноз с кальцификацией
Аортальная недостаточность
Митральная недостаточность
Пролапс митрального клапана (при выслушивании шума или выявлении регургитации при доплерографии)
• Гипертрофическая обструктивная кардиомиопатия
• Врожденные пороки сердца, включая:
Дефект межжелудочковой перегородки
Открытый боталлов проток
Тетраду Фалло
Коарктацию аорты
Двустворчатый аортальный клапан
Стеноз легочной артерии
• Имплантированные устройства в кровеносном русле, включая:
Протезы клапанов
Легочно-системные сосудистые шунты
Желудочково-предсердные шунты при гидроцефалии
• Эндокардит в анамнезе
После повреждения эндокардиальной поверхности клапана к обнажившейся субэндокардиальной соединительной ткани прилипают тромбоциты, которые инициируют отложение фибрина и формирование стерильного тромба (так называемой «вегетации»). Этот процесс называется небактериальным тромботическим эндокардитом (НБТЭ) или «марантическим» эндокардитом. НБТЭ создает в эндокарде благоприятную среду для микроорганизмов: 1) фибриново-тромбоцитарные отложения облегчают адгезию бактерий, 2) фибрин закрывает прикрепившиеся микробы и, ингибируя хемотаксис и миграцию фагоцитов, предохраняет их от защитных сил макроорганизма.
При наличии НБТЭ поступление с кровотоком микроорганизмов к поврежденной поверхности может привести к развитию инфекционного эндокардита. В таблице 8.7 перечислены наиболее частые возбудители эндокардита и их относительная частота встречаемости. Способность микроорганизма вызывать эндокардит определяется тремя факторами: 1) проникновением в кровоток, 2) сохранением жизнеспособности микроорганизма в циркулирующей крови, 3) способностью к адгезии к эндокарду. Бактерии могут попадать в кровоток при повреждении кожного покрова или слизистых организма, например, из полости рта при стоматологических вмешательствах или с кожи при внутривенном введении препаратов. Хотя транзиторная бактериемия является относительно частым явлением, к развитию эндокардита приводят только те микроорганизмы, которые способны сохранять жизнеспособность в циркулирующей крови и прикрепляться к вегетациям. В частности, приблизительно 90% случаев эндокардита обусловлено грамположительной флорой, и в первую очередь из-за ее устойчивости к деструкции системой комплемента. Кроме того, частота развития эндокардита коррелирует со способностью определенных видов стрептококка продуцировать декстран, компонент клеточной стенки бактерии, ответственный за адгезию к тромбу.
Таблица 8.7. Наиболее распространенные возбудители инфекционного эндокардита
Микроорганизм |
Частота (%) |
Стрептококки |
70 |
Зеленящий |
35 |
Энтерококки |
10 |
Другие стрептококки |
25 |
Стафилококки |
20 |
Золотистый |
18 |
Коагулазанегативные |
2 |
Другие микроорганизмы |
10 |
(например, грамотрицательные, гемо-филюс, грибы) |
После своей адгезии к поврежденной поверхности микроорганизмы защищаются от фагоцитарной активности покрывающим их фибрином. Теперь они могут свободно размножаться, в результате чего вегетации еще больше увеличиваются. Наличие инфицированных вегетаций является источником постоянной бактериемии и может приводить к развитию ряда осложнений. Эти осложнения имеют в своей основе: 1) механическое повреждение сердца, 2) тромботические или септические эмболии и 3) иммунное повреждение, обусловленное отложением комплексов антиген-антитело. Так, локальное распространение инфекции внутри сердца может привести к прогрессирующему разрушению клапанов с исходом в сердечную недостаточность, образованию абсцессов или деструкции проводящей системы сердца. Кусочки вегетаций могут вызывать периферические эмболии, наиболее часто в центральную нервную систему, почки и селезенку, провоцируя инфекционное поражение или инфаркты этих органов. Отложение иммунных комплексов может приводить к гломерулонефриту, артриту, васкулиту. Все эти осложнения могут оказаться фатальными.
Клинические проявления
Острый ИЭ отличается бурным быстро прогрессирующим течением; заболевание начинается с высокой лихорадки и потрясающего озноба. Напротив, подострый ИЭ начинается исподволь, с невысокой температуры и ряда неспецифических симптомов, таких как утомляемость, анорексия, слабость, миалгии, потливость по ночам. Подострый ИЭ часто напоминает другие болезни, например, грипп или инфекцию верхних дыхательных путей, и его ранняя диагностика требует высокой степени настороженности. При этом помогает наличие в анамнезе клапанного порока и других состояний, предрасполагающих к эндокардиту.
Системный воспалительный ответ на инфекцию обусловливает развитие таких симптомов, как лихорадка и спленомегалия, а также ряд лабораторных отклонений, таких как лейкоцитоз со сдвигом влево (увеличение процента нейтрофилов и незрелых гранулоцитов из-за острого воспаления), повышение скорости оседания эритроцитов и, более чем в 50% случаев, повышение уровня ревматоидного фактора в крови.
При объективном исследовании сердца можно выявить шум, отражающий первичную клапанную патологию, приведшую к ИЭ. В других случаях можно обнаружить также появление новых шумов вследствие обусловленной эндокардитом недостаточности одного или нескольких клапанов. Поражение клапанов правых отделов сердца, редко встречающееся у обычных людей, очень типично для наркоманов (ЭВН). В целом, шумы чаще выявляются при ПБЭ, чем при ОБЭ. С другой стороны, оценка динамики аускультативной картины при ОБЭ может оказаться особенно полезной, так как изменение характера шума с течением времени (например, усиление регургитации) может отражать быстропрогресси-руюшую деструкцию клапанов, более характерную для ОБЭ. С течением времени повреждение клапанов может приводить к появлению признаков застойной сердечной недостаточности.
Инфицированные эмболы могут разноситься кровотоком практически во все внутренние органы, включая кожу, мозг, почки, кишечник и селезенку. Эмболии в центральную нервную систему отмечаются у 33% пациентов. Поражение почек, иммунного или эмболического генеза, может манифестироваться гематурией, болью в боку или почечной недостаточностью. Инфаркты легких (эмболии легочной артерии) и их инфицирование (пневмония) наиболее часто встречаются при эндокардите правых отделов сердца. Эмболии и последующее инфицирование vasa vasorum могут привести впоследствии к локальному образованию аневризм (так называемые «микотические аневризмы»), которые ослабляют сосудистую стенку и могут разрываться. Микотические аневризмы могут обнаружиться в аорте, внутренних органах и на периферии, но особенно опасно их образование в церебральных сосудах, где их разрыв может вызвать фатальное внутричерепное кровоизлияние.
Другие физикальные признаки ИЭ связаны с септическими эмболиями или дистальным иммунокомплексным васкулитом. Например, образуются петехии — маленькие круглые образования красно-коричневого цвета на коже и слизистых. Под ногтями можно обнаружить «следы от заноз» — небольшие линейные кровоизлияния, возникающие в результате микроэмболий в ногтевое ложе. Безболезненные слегка выпуклые пятна на ладонях и стопах называются «пятнами Джейнуэя». Нежные, размером с горошину эритематозные узелки, появляющиеся в первую очередь на внутренней стороне пальцев рук и ног, известны как «узелки Ослера». Эмболии в сетчатку обусловливают появление так называемых «пятен Рота», представляющих собой микроинфаркты; при исследовании глазного дна они выглядят как белые пятна с геморрагическим венчиком.
Диагностика и адекватное лечение эндокардита основаны на идентификации возбудителя с помощью посевов крови. Лечение затем может быть направлено на элиминацию конкретного возбудителя с учетом его чувствительности к антибиотикам. Этиологический агент может быть выделен в культуре приблизительно в 95% случаев. Этого не удается сделать в случае недавнего назначения антибиотиков или если микроорганизм требует особых питательных сред.
В диагностике применяются и другие методы. Электрокардиограмма может выявить инфекционное поражение проводящей системы сердца, которое может обусловливать блокады сердца различной степени и появление нарушений ритма. Эхокардиография существенно облегчает диагностику, когда удается непосредственно визуализировать вегетации. Она также полезна в выявлении таких осложнений эндокардита, как клапанные пороки и образование абсцессов. Чреспищеводная эхокардиография гораздо более чувствительна в выявлении вегетаций, чем стандартное трансторакальное исследование.
Лечение эндокардита предусматривает длительное (4—6 недель) внутривенное введение этиотропных антибиотиков в больших дозах. Хирургическое вмешательство, обычно протезирование клапана, предпринимается только в случае неэффективности антибактериальной терапии или развитии жизнеугрожающих осложнений, таких как тяжелая клапанная дисфункция с явлениями сердечной недостаточности, повторные эмболии и формирование абсцесса миокарда.
Возможно, наиболее важным аспектом лечения является профилактика эндокардита, заключающаяся в назначении антибиотиков лицам из групп риска в связи с вызывающими бактериемию вмешательствами (таблица 8.8).
Таблица 8.8. Процедуры, требующие профилактики эндокардита
Стоматологические манипуляции, при которых возможны кровотечения из десен
Бронхоскопия жестким бронхоскопом и операции на верхних дыхательных путях
Операции на мочеполовом тракте, включая:
Катетеризацию мочевого пузыря
Цистоскопию
Простатэктомию
Родоразрешение через естественные пути (при наличии внутриутробной инфекции)
Операции на желудочно-кишечном тракте, включая холецистэктомию
ЗАКЛЮЧЕНИЕ
Клапанные пороки сердца являются важной причиной инвалидизации и смертности. В настоящее время патофизиология этих состояний изучена достаточно основательно, что дает возможность использовать как простые диагностические методы, которые можно применить непосредственно у постели больного, так и сложные исследования гемодинамики. Краткий обзор наиболее типичных признаков самых частых клапанных пороков представлен в таблице 8.9.
Таблица 8.9, Краткая характеристика основных клапанных пороков
Порок |
Этиология |
Клиника |
Физикальные признаки |
Механизмы компенсации |
Митраль- |
Последствия ревматической |
• Симптомы левожелудоч- |
• Громкий I тон |
• Вазоконстрикция легочных |
ный стеноз |
лихорадки |
ковой (а позднее и правожелудочковой) сердечной недостаточности1 |
|
артериол «защищает» легочное русло |
Митральная |
Острая: |
Острая: |
• Расщепление II тона |
Острая: |
регургитация |
Хроническая:
|
Хроническая:
|
• Голосистолический шум на верхушке |
Хроническая:
|
Аортальный стеноз |
|
|
|
• Компенсаторная гипертрофия левого желудочка |
Аортальная регургита |
• Врожденная (например, двустворчатый клапан) |
|
• Высокое пульсовое давление |
• Механизм Франка-Старлинга позволяет повысить |
ция |
|
(иногда) |
|
ударный объем и поддерживать нормальный конечный систолический объем • (Хроническая) Гипертрофия левого желудочка |