Ишемическая болезнь сердца
В 1772 году английский врач Уильям Геберден описал заболевание, при котором у больных во время ходьбы появлялось неприятное ощущение в грудной клетке. Назвав этот дискомфорт «стенокардией», Геберден отметил, что он быстро исчезал, когда пациент останавливался, но вновь появлялся при возобновлении нагрузки. Хотя он не знал причин этого явления, судя по всему, его сообщение было первым описанием симптомов ишемической болезни сердца, состояния, обусловленного недостаточным кровоснабжением миокарда, от которого сейчас страдают миллионы американцев и которое ответственно за более чем 600 000 смертей ежегодно.
Клинические проявления ишемической болезни сердца очень разнообразны. Она может сопровождаться симптомами, связанными с физической нагрузкой, подобными описанным Геберденом, и до сих пор называющимися стенокардией. В других случаях ишемия не сопровождается клиническими проявлениями, при этом говорят о «немой» ишемии. Эта глава описывает весь спектр синдромов, ассоциированных с ишемической болезнью сердца (табл. 6.1), и их патогенетических механизмов.
Таблица 6.1. Клинические определения
|
Синдром Ишемическая болезнь сердца |
Описание Состояние, при котором дисбаланс между потребностью миокарда в кислороде и его доставкой приводит к ишемии миокарда и накоплению продуктов метаболизма; наиболее часто развивается вследствие атеросклероза коронарных артерий («коронарная болезнь сердца») |
Стенокардия |
Дискомфорт в грудной клетке и соседних анатомических областях, вызываемый ишемией миокарда |
Стабильная стенокардия |
Хронический тип преходящей стенокардии, провоцируемой физической активностью или эмоциями и купируемой в течение нескольких минут в покое; эпизоды часто ассоциируются с преходящей депрессией сегмента ST, но стойкое повреждение миокарда не развивается |
Вариантная стенокардия |
Типичная стенокардия, обычно покоя, которая развивается из-за спазма коронарных артерий, а не из-за увеличения потребности миокарда в кислороде; эпизоды часто сопровождаются транзиторными колебаниями сегмента ST (обычно элевация) |
Нестабильная стенокардия |
Характерно увеличение частоты и продолжительности приступов стенокардии, провоцируемых меньшей нагрузкой или развивающихся в покое; при отсутствии лечения часто развивается инфаркт миокарда |
Немая ишемия |
Бессимптомные эпизоды ишемии миокарда; может быть выявлена на ЭКГ или с помощью других инструментальных методов |
Синдром |
Описание |
Инфаркт миокарда (см. главу 7) |
Участок некроза миокарда, обычно вследствие длительного прекращения кровотока; наиболее часто развивается вследствие острого тромбоза в месте атеросклеротического стеноза коронарной артерии; может быть первым клиническим проявлением ишемической болезни сердца, или ему предшествует стенокардия |
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ СТЕНОКАРДИИ
Наиболее типичное проявление ишемической болезни сердца, стенокардия, в буквальном переводе означает «сдавление в груди». Хотя многие болезни с локализацией в грудной клетке могут приводить к подобному дискомфорту, «стенокардией» называют состояние дисбаланса между доставкой кислорода к миокарду и потребностью в нем. Ведущей причиной такого дисбаланса является ишемическая болезнь сердца, при которой уменьшение доставки кислорода обусловлено атеросклеротическим сужением одной или нескольких коронарных артерий.
В нормальном сердце поддерживается равновесие между потребностью миокарда в кислороде и его доставкой коронарными артериями. Даже при интенсивной нагрузке, когда метаболические потребности сердца возрастают, также растет доставка кислорода к кардиомиоцитам, и баланс сохраняется. Следующие разделы рассматривают ключевые факторы, определяющие потребность и доставку кислорода к миокарду в норме (рис. 6.1) и при ИБС.

Доставка кислорода к миокарду
Доставка кислорода к миокарду зависит от способности крови переносить кислород и состояния коронарного кровотока. Способность переносить кислород определяется содержанием в крови гемоглобина и системной оксигенацией. При отсутствии анемии или патологии легких кисло-родсвязывающая способность остается достаточно стабильной величиной. Однако коронарный кровоток гораздо более динамичен, и его регуляция поддерживает соответствие доставки кислорода метаболическим потребностям.
Как и во всех кровеносных сосудах, коронарный кровоток (Q) прямо пропорционален перфузионному давлению в сосуде (Р) и обратно пропорционален коронарному сосудистому сопротивлению (R). Это выражается как Q ос P/R.
Однако в отличие от остальных артериальных систем, в которых основной кровоток происходит в систолу, в коронарных сосудах максимальный ток крови приходится на диастолу. Причиной этого является ограничение систолического кровотока из-за сдавления артерий сокращающимся миокардом, а также из-за динамики выброса крови в аорту. Во время систолы быстрый ток крови через аортальный клапан вызывает эффект Вентури, в результате чего вдоль стенок проксимальной аорты возникает локальное снижение давления. Таким образом, систолическое давление в синусах Вальсальвы и устьях коронарных артерий становится ниже, чем в самой аорте, и перфузионное давление в коронарных артериях снижается.
В диастолу коронарный кровоток осуществляется беспрепятственно, так как снижающий давление эффект Вентури не возникает при закрытом аортальном клапане и прекращении быстрого тока крови, а также потому что миокард в фазе расслабления вызывает лишь незначительное внешнее сдавление сосудов. Таким образом, для коронарных артерий перфузионное давление определяется диастолическим давлением в аорте. Состояния, при которых диастолическое давление в аорте снижается (например, гипотензия или аортальная регургитация), уменьшают коронарное перфузионное давление и могут нарушать доставку кислорода к миокарду.
Коронарное сосудистое сопротивление является еще одной основной детерминантой коронарного кровотока. В нормальных артериях сопротивление динамически модулируется 1) силами, сдавливающими коронарные артерии извне и 2) факторами, влияющими на собственный тонус артерий.
ВНЕШНЯЯ КОМПРЕССИЯ
Внешняя компрессия коронарных сосудов осуществляется в течение сердечного цикла сокращением окружающего миокарда. Степень компрессии прямо пропорциональна интрамиокардиальному давлению и поэтому, как уже говорилось выше, максимальна во время систолы. Более того, во время сокращения миокарда субэндокардиальные слои, подвергающиеся воздействию высокого внутрижелудочкового давления, сдавливаются больше, чем остальные мышечные слои. Это одна из причин того, что субэндокардиальные слои наиболее подвержены ишемическому повреждению.
ВНУТРЕННИЙ КОНТРОЛЬ КОРОНАРНОГО ТОНУСА
В отличие от большинства тканей, сердце не может при необходимости увеличивать степень поглощения кислорода, так как она почти максимальна уже в базальных условиях. Таким образом, любое повышение потребности в кислороде должно вызывать увеличение коронарного кровотока', ведущую роль в этом процессе играет саморегуляция коронарного сосудистого сопротивления. К факторам, участвующим в регуляции коронарного сосудистого сопротивления, относят локальное накопление продуктов обмена, эндотелиальные факторы и нервные влияния.
Местное накопление продуктов обмена
Локальное накопление метаболитов заметно влияет на тонус коронарных сосудов и помогает приспосабливать доставку кислорода к меняющимся метаболическим потребностям. Основными регуляторными факторами являются 1) кислород, действующий как вазоконстриктор, и 2) аденозин, являющийся вазодилататором. Считается, что молекулярный кислород заставляет закрываться прекапиллярные сфинктеры. Таким образом, при снижении перфузии снижается также напряжение кислорода, что приводит к дилатации прекапиллярных сфинктеров и увеличению кровотока и доставки кислорода.
При гипоксемии аэробный метаболизм и окислительное фосфорилирование в митохондриях ингибируются. При этом регенерация макроэр-гических фосфатов, включая АТФ, невозможна. В результате аденозин дифосфат (АДФ) и монофосфат (АМФ) накапливаются и последовательно расщепляются до аденозина. Аденозин является мощным вазодилататором и считается основным метаболическим медиатором сосудистого тонуса. Связываясь с рецепторами на гладкомышечных клетках сосудов, аденозин уменьшает вход кальция внутрь клетки, что приводит к расслаблению, вазодилатации и увеличению коронарного кровотока. Другими метаболитами, обладающими местным вазодилатирующим эффектом, являются лактат, ацетат, ионы водорода и диоксид углерода.
Эндотелиальные факторы
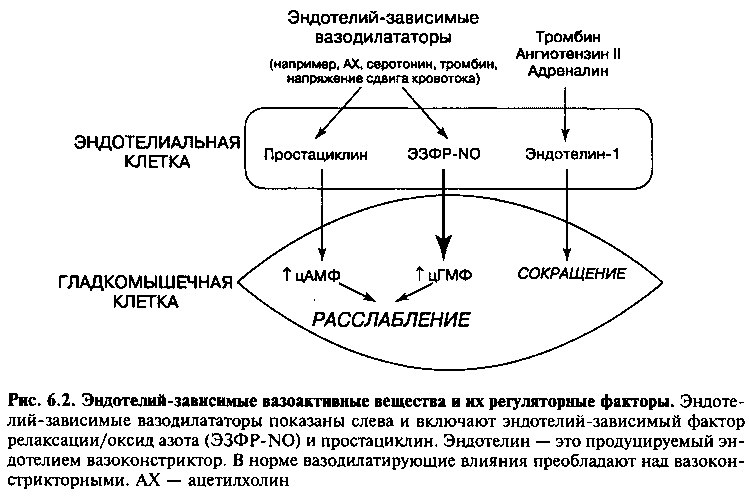
Клетки эндотелия сосудистой стенки вырабатывают ряд вазоактивных веществ, участвующих в регуляции сосудистого тонуса. Вазодилататоры, синтезируемые эндотелием, включают эндотелий-зависимый фактор релаксации и простациклин. Эндотелии-1 является примером естественного продуцируемого эндотелием вазоконстриктора.
Идентификация и важнейшие эффекты эндотелий-зависимого фактора релаксации описываются в Приложении 6.1. Этот фактор был идентифицирован как оксид азота или очень близкое вещество и поэтому далее обозначается как ЭЗФР-NO. ЭЗФР-NO регулирует сосудистый тонус, заставляя соседние гладкомышечные клетки расслабляться через механизм, зависимый от циклического ГМФ. Продукция ЭЗФР-NO нормальным эндотелием происходит в базальных условиях и дополнительно стимулируется многими факторами и состояниями. Например, повышенное его количество синтезируется при воздействии на эндотелий ацетилхолина (АХ), тромбина, факторов, высвобождаемых из агрегирующих тромбоцитов (например, серотонина и АДФ), или в результате напряжения сдвига, создаваемого кровотоком. Хотя прямым эффектом многих из этих субстанций на сосудистую стенку является вазоконстрикция, вызванное ими высвобождение из нормального эндотелия ЭЗФР-NO парадоксальным образом приводит к вазодилатации (рис. 6.2).
Метаболит арахидоновой кислоты простациклин обладает сходными с ЭЗФР-NO вазодилатирующими свойствами (рис. 6.2). Он высвобождается эндотелием в ответ на многие стимулы, включая гипоксию, напряжение сдвига, ацетилхолин и тромбоцитарные факторы (например, серотонин), и вызывает расслабление гладких мышц через механизм, зависимый от циклического АМФ.
Эндотелии-1 является мощным вазоконстриктором, который вырабатывается клетками эндотелия и частично противодействует вазодилатирующей активности ЭЗФР-NO и простациклина. Его экспрессия стимулируется рядом факторов, включая тромбин, ангиотензин II, адреналин и напряжение сдвига кровотока.
В нормальных условиях эндотелий способствует релаксации сосудистых гладкомышечных клеток (вазодилатации) под действием ЭЗФР-NO и простациклина, эффекты которых преобладают над эндотелиальными вазоконстрикторами (рис. 6.2). Однако, как мы увидим впоследствии, при его дисфункции (как, например, при атеросклерозе) эндотелий продуцирует недостаточное количество вазодилататоров, так что баланс сдвигается в сторону вазоконстрикции.
Нервная регуляция
Контроль сосудистого сопротивления со стороны нервной системы имеет как симпатический, так и парасимпатический компонент. В норме вклад парасимпатической нервной системы, по-видимому, незначителен, однако симпатические рецепторы играют важную роль. Коронарные артерии обладают как а-, так и р2-адренорецепторами. Стимуляция а-ад-ренорецепторов приводит к вазоконстрикции. Напротив, стимуляция Р2-адренорецепторов способствует вазодилатации.
Взаимодействие между метаболическими, эндотелиальными и нервными регуляторными факторами определяет общее воздействие на коронарный сосудистый тонус. Например, катехоламиновая стимуляция
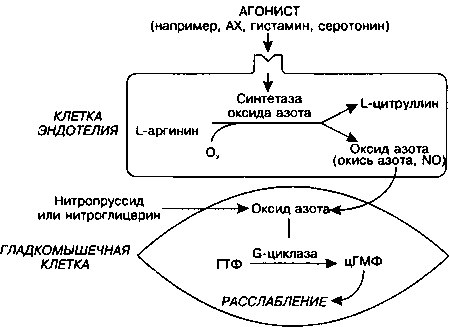
Приложение 6.1: Эндотелий-зависимый фактор релаксации и оксид азота
Клетки эндотелия нормальной артерии синтезируют вещества с мощным вазодилатирующим эффектом, которые участвуют в регуляции сосудистого тонуса. К ним относятся простациклин (метаболит арахидоновой кислоты) и эндотелий-зависимый фактор релаксации (ЭЗФР).
ЭЗФР был впервые описан в 1970-х гг. В экспериментах было показано, что ацетилхолин (АХ) обладает двояким действием на кровеносные сосуды: его прямым эффектом на гладкомышечные клетки сосудов является вазоконстрикция, но если гладкомышечные клетки покрывает интактная эндотелиальная выстилка, вместо вазовонстрикции развивается вазодилатация. Последующие работы показали, что под действием АХ эндотелиальные клетки продуцируют химический медиатор (который был назван ЭЗФР), который быстро диффундирует к подлежащим гладкомышечным клеткам, вызывая их расслабление и последующую вазодилатацию сосуда.
По данным последних исследований таинственный ЭЗФР на самом деле представляет собой оксид азота (NO) или близкое к нему вещество. Когда АХ (или другие эндотелий-за-висимые вазодилататоры, например, серотонин или гистамин) связывается с эндотелиальной клеткой, повышается уровень внутриклеточного свободного кальция, который активирует фермент синтетазу NO (NOC). NOC катализирует образование NO из аминокислоты L-аргинина (см. рисунок). NO диффундирует из эндотелия к подлежащим гладкомышечным клеткам, где активирует гуанилатциклазу (G-циклазу). G-циклаза, в свою, очередь, превращает гуанозинтрифосфат (ГТФ) в циклический гуанозинмонофосфат (цГМФ). Повышение внутриклеточного цГМФ приводит к расслаблению гладкомышечной клетки посредством механизмов, связанных со снижением содержания Са4"1- в цитоплазме. Повышение цГМФ также подавляет миграцию гладкомышечных клеток.
В отличие от эндотелий-зависимых вазодилататоров, некоторые агенты вызывают релаксацию гладких мышц независимо от наличия эндотелиальных клеток. Например, лекарства нитропруссид натрия и нитроглицерин вызывают вазодилатацию, создавая для гладкомышечных клеток внешний источник NO и затем активируя G-цик-лазу с образованием цГМФ без участия клеток эндотелия.
В лаборатории катетеризации сердца внутрикоронар-ное введение АХ у здоровых людей вызывает дилатацию
сосуда, по-видимому за счет высвобождения ЭЗФР-NO. Однако при состояниях, вызывающих дисфункцию эндотелия, таких как атеросклероз, внутрикоронарное введение АХ приводит к парадоксальной вазоконстрикции. Судя по всему, это является отражением снижения продукции ЭЗФР-NO при дисфункции эндотелия, так что преобладает прямой вазоконстрикторный эффект АХ в отношении гладкой мускулатуры. Особый интерес представляет тот факт, что потеря вазодилатирующего ответа на инфузию АХ развивается у лиц с определенными факторами риска (например, повышением холестерина ЛНП, гипертензией, при курении сигарет) даже при отсутствии явной атероматозной бляшки. Таким образом, нарушение высвобождения ЭЗФР-NO может быть ранним и чувствительным предиктором последующего развития атеросклеротических поражений.
(Модифицировано из Furchgott, RF. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA 1996; 276:1186-1188.) сердца может вначале вызвать коронарную вазоконстрикцию посредством а-адренергического нервного механизма. Однако катехоламины вызывают также повышение потребления миокардом кислорода через увеличение ЧСС и сократимости (Pj-адренергический эффект) и, вследствие этого, увеличивают продукцию метаболитов, приводящих к конечной коронарной вазодилатации.
Потребность миокарда в кислороде
Факторами, определяющими потребность миокарда в кислороде, являются: 1) напряжение стенки желудочка, 2) частота сердечных сокращений, 3) сократимость (инотропный статус). Кроме того, очень небольшие количества кислорода требуются для обеспечения энергией базального метаболизма кардиомиоцитов и электрической деполяризации.
Напряжение стенки желудочка (о) — это тангенциальная сила, воздействующая на кардиомиоциты и раздвигающая их; на противодействие этой силе тратится определенная энергия. Напряжение стенки зависит от внутрижелудочкового давления (Р), радиуса желудочка (г), и толщины стенки желудочка (h). Упрощенное уравнение Лапласа выглядит как
Таким образом, напряжение стенки прямо пропорционально радиусу левого желудочка. Состояния, при которых увеличивается заполнение левого желудочка (например, аортальная и митральная регургитация), вызывают увеличение радиуса желудочка и рост напряжения стенки и по-
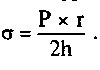
требления кислорода. Напротив, любой физиологический или фармакологический маневр, направленный на уменьшение заполнения и размера левого желудочка (например, лечение нитратами), уменьшает напряжение стенки и потребление миокардом кислорода.
Напряжение стенки также пропорционально систолическому давлению в желудочке. Обстоятельства, приводящие к росту внутрижелудочкового давления, такие как аортальный стеноз и гипертензия, увеличивают напряжение стенки и потребление кислорода. В условиях сниженного внутрижелудочкового давления (например, гипотензивная терапия) потребление кислорода снижается.
Наконец, напряжение стенки обратно пропорционально толщине стенки желудочка, так как сила распределяется на большую мышечную массу. Гипертрофированное сердце имеет более низкие значения напряжения стенки и потребления кислорода на грамм ткани, чем сердце с более тонкими стенками. Поэтому при развитии гипертрофии в условиях хронической перегрузки давлением (например, при аортальном стенозе) она играет компенсаторную роль, снижая потребление кислорода.
Вторым фактором, определяющим потребность миокарда в кислороде, является частота сердечных сокращений (ЧСС). При ускорении ритма увеличивается число сокращений и расход АТФ в минуту, что приводит к росту потребности в кислороде. Напротив, замедление ЧСС (например, при использовании 0-блокатора) снижает расход АТФ и соответственно — потребление кислорода.
И, в-третьих, потребность миокарда в кислороде определяется сократимостью миокарда, то есть силой его сокращений (рассматривается в главе 9). Циркулирующие катехоламины или препараты с положительным инотропным эффектом напрямую увеличивают силу сердечных сокращений и утилизацию кислорода. Напротив, агенты с отрицательным инотропным эффектом, например, 0-блокаторы, уменьшают потребление кислорода миокардом.
В заключение можно сказать, что в норме механизмы саморегуляции воздействуют на тонус коронарных артерий таким образом, чтобы доставка кислорода к миокарду находилась в соответствии с потребностью в нем. В отсутствие стенозов коронарных артерий механизмы саморегуляции обеспечивают достаточное постоянство коронарного кровотока, пока перфузионное давление в аорте составляет приблизительно 60 мм рт. ст. и выше. Однако, в условиях распространенного коронарного атеросклероза, падение перфузионного давления дистальнее стеноза артерии и дисфункция эндотелия вовлеченного сегмента приводят к несоответствию между имеющимся кровотоком и метаболическими потребностями миокарда.
ПАТОФИЗИОЛОГИЯ ИШЕМИИ
Традиционно считалось, что ишемия миокарда при коронарной болезни сердца развивается в результате фиксированного сужения просвета сосуда атеросклеротической бляшкой и ограничения притока крови к миокарду. Однако последние исследования показали, что снижение кровотока происходит в результате комбинации стеноза сосуда и ненормального сосудистого тонуса, обусловленного атеросклеротической дисфункцией эндотелиальных клеток.
Стеноз сосуда
Гемодинамическая значимость атеросклеротических стенозов коронарных артерий связана как с гидродинамическими механизмами, так и анатомией коронарного русла.
ГИДРОДИНАМИКА
Согласно закону Пуазейл"г, СОсуде описывается формулой
где Q — кровоток, ДР — разница Давления между точками измерения, г — радиус сосуда, т| — вязкость крови, a L — длина сосуда. По аналогии с законом Ома, кровоток также равен отношению разности давления к сопротивлению кровотоку (R
Скомбинировав обе формулы, можно выразить сопротивление кровотоку в сосуде как
Таким образом, сосудистое сопротивление отчасти зависит от геометрического компонента L/r4. Поэтому гемодинамическая значимость стенозирующего поражения зависит от его протяженности и, что гораздо важнее, от степени возникающего в результате сужения сосуда (то есть уменьшения г).
АНАТОМИЯ
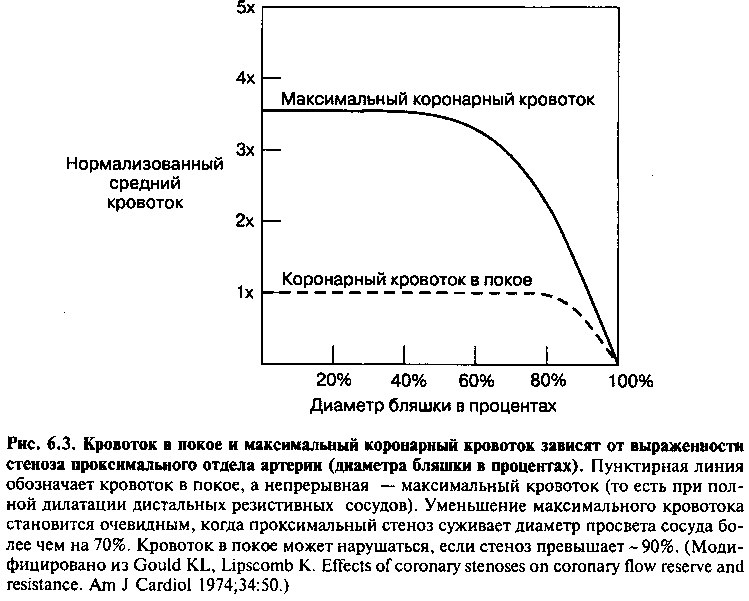
Коронарные артерии состоят из больших проксимальных эпикардиальных сегментов и меньших дистальных резистивных сосудов. Проксимальные сосуды подвержены развитию атеросклероза, который приводит к стенозирующим поражениям. Дистальные сосуды обычно свободны от гемодинамически значимых бляшек и могут менять свой тонус в зависимости от метаболических потребностей. Эти резистивные сосуды выполняют резервную функцию, расширяясь при нагрузке, когда потребность в кислороде возрастает, а также и в покое при наличии выраженного проксимального стеноза.
Гемодинамическая значимость и, соответственно, патофизиологические последствия различных степеней сужения коронарных артерий зависят как от степени стеноза эпикардиальной части сосуда, так и выраженности компенсаторной вазодилатации дистальных резистивных сосудов (рис. 6.3). Если диаметр просвета сужен менее чем на 60%, максимальный кровоток по артерии нарушается несущественно, и в ответ на нагрузку резистивные сосуды могут расширяться и обеспечивать адекватный кровоток. Когда стеноз достигает приблизительно 70% и более диаметра, сопротивление кровотоку таково, что для обеспечения адекватной перфузии необходима полная дилатация резистивных сосудов уже в покое. В этой ситуации при увеличении потребности в кислороде (например, в результате повышения ЧСС и силы сокращений при физической нагрузке) остается лишь незначительный резерв коронарного кровотока, и максимальный кровоток в сосуде снижается. При этом потребность в кислороде превышает его доставку и возникает ишемия миокарда. При степени стеноза, превышающей примерно 90%, кровоток может быть недостаточен для обеспечения базальных потребностей даже несмотря на максимальную дилатацию резистивных сосудов, и ишемия может развиться уже в покое.
Между интактными артериями и участками дистальнее атеросклеротического стеноза развиваются коллатеральные сосуды (см. главу 1), и кровоток по ним может смягчить снижение доставки кислорода к мио-
карду. Но при критическом сужении сосудов роль коллатералей для предотвращения ишемии миокарда при физической нагрузке недостаточна.
Дисфункция эндотелиальных клеток
В дополнение к фиксированному стенозу сосуда важный вклад в снижение доставки кислорода к миокарду при хронической ИБС вносит дисфункция эндотелия. Ненормальное функционирование эндотелиальных клеток может участвовать в патофизиологиии ишемии двумя путями: 1) через неадекватную коронарную вазоконстрикцию и 2) через потерю нормальных антитромбогенных свойств.
НЕАДЕКВАТНАЯ ВАЗОКОНСТРИКЦИЯ
В норме физическая активность или умственное напряжение приводит к коронарной вазодилатации. Полагают, что этот эффект регулируется активацией симпатической нервной системы, при этом возросшие кровоток и его напряжение сдвига вызывают высвобождение эндотелиальных вазодилататоров, таких как ЭЗФР-NO. Считается, что в норме релаксирующий эффект ЭЗФР-NO в отношении гладкомышечных клеток артерии превышает прямой а-адренергический сосудосуживающий эффект катехоламинов, в результате чего происходит вазодилатация. Однако у пациентов с дисфункцией эндотелия (например, при атеросклерозе) в результате нарушения продукции эндотелиальных вазодилататоров начинает превалировать прямой эффект катехоламинов, так что вместо этого развивается относительная вазоконстрикция. Возникающее в результате снижение коронарного кровотока и снабжения миокарда кислородом усугубляет ишемию. Кроме того, у пациентов с факторами риска ИБС, такими как гиперхолестеринемия, сахарный диабет, гипертензия, курение, нарушение эндотелий-зависимой вазодилатации отмечается даже в анатомически нормальных коронарных артериях, что позволяет предположить, что дисфункция эндотелия развивается на очень ранних стадиях атеросклеротического процесса. У пациентов с нарушенной функцией эндотелия даже вазодилатирующие эффекты локальных метаболитов (таких как аденозин и гипоксия) ослабляются, что затрудняет регуляцию сосудистого тонуса с помощью метаболических стимулов.
При острых коронарных синдромах (например, нестабильной стенокардии) неадекватная вазоконстрикция также имеет важное значение. Причиной нестабильной стенокардии обычно считается разрыв атеросклеротической бляшки с последующей агрегацией тромбоцитов и образованием тромба. В норме продукты агрегирующих тромбоцитов в формирующемся тромбе (например, серотонин, АДФ) приводят к вазодилатации, так как они стимулируют выработку ЭЗФР-NO. Однако при дисфункции эндотелия преобладают прямые сосудосуживающие влияния тромбоцитарных факторов, и происходит вазоконстрикция (рис. 6.4), что приводит к снижению кровотока.
АГРЕГАЦИЯ ТРОМБОЦИТОВ
Продуцируемые эндотелием факторы, такие как ЭЗФР-NO и простациклин, имеют антитромботическую функцию, поскольку они уменьшают агрегацию тромбоцитов (рис. 6.4). Однако в условиях дисфункции эндотелия их высвобождение снижено и поэтому антитромботический
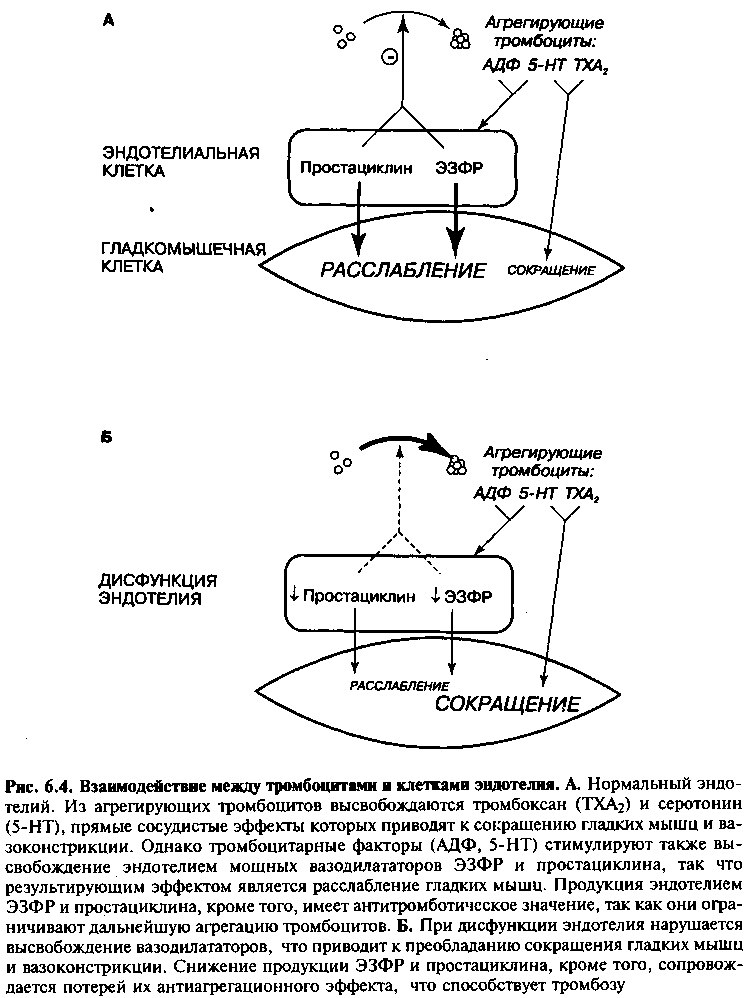
эффект ослабляется. Таким образом, при связанных с тромбозом синдромах (например, нестабильной стенокардии, остром инфаркте миокарда) уменьшение продукции ЭЗФР-NO и простациклина делает возможными агрегацию тромбоцитов, секрецию прокоагулянтов и потенциальных вазоконстрикторов, что способствует дальнейшему угнетению кровотока.
Другие причины ишемии миокарда
Помимо ишемической болезни сердца (ИБС), ряд других состояний также может привести к дисбалансу между потребностью миокарда в кислороде и его доставкой и, в результате, — к ишемии. Причины снижения доставки кислорода к миокарду включают: 1) снижение перфузионного давления в аорте (например, вследствие артериальной гипотензии или аортальной недостаточности) и 2) значительное уменьшение кислородс-вязывающей способности крови (например, при анемии или гипоксемии). Например, у пациента с массивным желудочно-кишечным кровотечением может развиться ишемия миокарда и стенокардия даже в отсутствие коронарного атеросклероза из-за снижения доставки кислорода к тканям вследствие потери гемоглобина.
С другой стороны, выраженное увеличение потребности миокарда в кислороде может вызвать ишемию в отсутствие коронарного атеросклероза и других причин нарушения доставки кислорода к миокарду. Это происходит, например, при тяжелом аортальном стенозе, когда значительно увеличивается напряжение стенки в связи со значительным повышением систолического давления в левом желудочке.
ИШЕМИЧЕСКИЕ СИНДРОМЫ
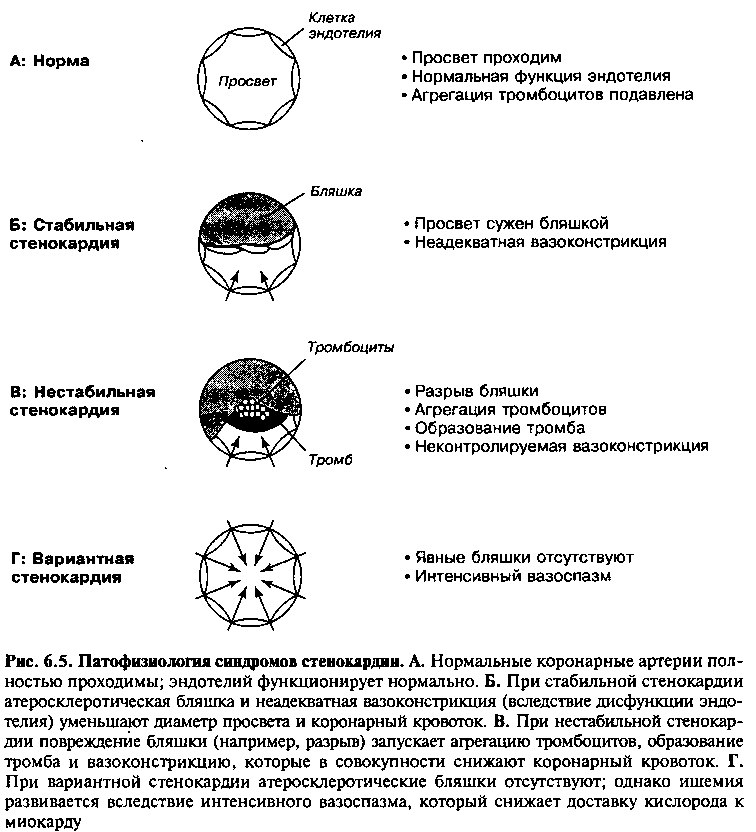
Ишемия миокарда возникает, когда имеется дисбаланс между доставкой кислорода к миокарду и потребностью в нем. Однако в зависимости от вклада различных патофизиологических процессов, могут развиваться различные клинические синдромы (рис. 6.5).
Стабильная стенокардия (рис. 6.5Б)
Когда атеросклеротическая бляшка сужает просвет коронарной артерии приблизительно на 70% и более, сниженный кровоток может быть достаточным для обеспечения потребности миокарда в кислороде в покое, но недостаточным для компенсации любого существенного увеличения этой потребности (рис. 6.3). При физической нагрузке активация симпатической нервной системы приводит к увеличению ЧСС, артериального давления и сократимости; все эти факторы увеличивают потребность миокарда в кислороде. Если потребность в кислороде выше доставки, развивается ишемия, часто сопровождающаяся стенокардией. Ишемия и ее симптомы сохраняются до тех пор, пока не произойдет снижение избыточной потребности в кислороде и не восстановится кислородный баланс. Хроническая, предсказуемая, преходящая стенокардия при нагрузках или эмоциональном стрессе обозначается как «стабильная».
Одним из факторов, которые потенциально могут усугублять неадекватную доставку кислорода при стабильной стенокардии, является неадекватная вазоконстрикция, обусловленная эндотелиальной дисфункцией, хотя бы частично, ассоциированной с атеросклерозом. В норме повышение потребности в кислороде при нагрузке уравновешивается увеличением кровотока, так как накопление локальных метаболитов вызывает вазодилатацию. Однако при дисфункции эндотелия вазодилатация нарушается, и возможно парадоксальное сужение сосудов в ответ на обусловленную нагрузкой стимуляцию их а-адренорецепторов катехоламинами.
В результате степень сужения артерий у больных атеросклерозом не обязательно должна быть постоянной. Напротив, она может изменяться во времени из-за дополнительных колебаний коронарного тонуса. У некоторых пациентов со стабильной стенокардией колебания тонуса играют минимальную роль в снижении доставки кислорода к миокарду, и уровень физической активности, вызывающей стенокардию, практически постоянен. У этих пациентов «стенокардия с фиксированным порогом». В других случаях степень динамической обструкции, вызванной вазоконстрикцией или вазоспазмом, играет более существенную роль, и у этих больных может быть «стенокардия с вариабельным порогом». Например, бывают дни, когда пациент может выполнять нагрузки без дискомфорта в грудной клетке, но в другие дни тот же уровень потребности миокарда в кислороде вызывает симптомы — эта разница отражает колебания сосудистого тонуса в участках с фиксированным стенозом.
Нестабильная стенокардия
У пациента с хронической стабильной стенокардией может возникнуть внезапное увеличение тяжести и продолжительности приступов стенокардии, их начало при меньшей нагрузке и даже в покое. Подобное утяжеление симптомов называется нестабильной стенокардией и часто предшествует острому инфаркту миокарда. Хотя большинство пациентов с нестабильной стенокардией имеют тяжелый коронарный атеросклероз, иногда она развивается и у лиц с незначимыми стенозами. Поэтому патогенез нестабильной стенокардии вероятнее всего, многофакторный. Наиболее часто ключевым событием является изъязвление и разрыв атеросклеротической бляшки (рис. 6.5В). Активация тромбоцитов и образование тромба в месте дефекта бляшки могут приводить к дальнейшему сужению просвета, ухудшая, таким образом, и без того сниженный коронарный кровоток.
Уменьшение доставки крови к миокарду при нестабильной стенокардии усугубляется вазоконстрикторными эффектами агрегирующих тромбоцитов и тромба. В норме вазоактивные вещества, высвобождающиеся из тромбоцитов, такие как тромбин и серотонин, обычно вызывают эндо-телий-опосредованную вазодилатацию (рис. 6.4). Однако при дисфункции эндотелия эти тромбоцитарные факторы, а также тромбин внутри тромба, вместо этого вызывают вазоконстрикцию. Более того, при дисфункции эндотелия эндотелиальные антагонисты тромбоза (ЭЗФР-NO и простациклин) не в состоянии ингибировать агрегацию тромбоцитов. Таким образом, при этих критических случаях теряется ключевой защитный механизм в отношении тромбоза.
Вариантная стенокардия
У небольшой части больных ИБС развиваются эпизоды локального спазма коронарных артерий в отсутствие явных атеросклеротических поражений.
Этот синдром называется «вариантной» стенокардией, или стенокардией «Принцметала». В данном случае стенокардия обусловлена только интенсивным вазоспазмом, который снижает доставку кислорода к миокарду и вызывает его ишемию (рис. 6.5Г). Механизм развития такого выраженного спазма окончательно не выяснен. Считается, что многие из этих пациентов имеют начальный атеросклероз, проявляющийся только дисфункцией эндотелия, так как у пациентов с этим состоянием ответ на многие эндоте-лий-зависимые вазодилататоры (например, АХ и серотонин) ненормален.
Вариантная стенокардия часто развивается в покое, поскольку причиной ишемии в этом случае является выраженное транзиторное снижение доставки кислорода, а не повышение потребности миокарда в нем.
Немая ишемия
Эпизоды ишемии миокарда иногда развиваются в отсутствие субъективного дискомфорта или боли, и такие случаи называются «немой ишемией». Эти бессимптомные эпизоды могут сосуществовать с типичными приступами стенокардии. У некоторых пациентов немая ишемия может быть единственной манифестацией ИБС. Как можно догадаться, диагностика немой ишемии может быть затруднительной. Для ее выявления пользуются такими инструментальными методами, как амбулаторное мониторирование ЭКГ или нагрузочная проба (см. ниже). По данным одного исследования, немые ишемические эпизоды выявляются у 40% пациентов со стабильной стенокардией и у 2,5—10% не предъявляющих жалоб мужчин среднего возраста. Учитывая важность симптома стенокардии как физиологического сигнала тревоги, не следует недооценивать опасность бессимптомной ишемии.
Причина, по которой одни эпизоды ишемии являются «немыми», в то время как другие сопровождаются симптоматикой, до конца не ясна. Выраженность ишемии не может полностью объяснить эти различия, так как некоторые пациенты могут переносить без симптомов даже инфаркт миокарда. Поскольку немая ишемия миокарда чаще наблюдается у диабетиков, можно полагать, что она связана с нарушенным восприятием боли вследствие периферической нейропатии.
Синдром X
Этот термин применяется к пациентам с типичными симптомами стенокардии, у которых отсутствуют признаки значимого стенозирующего поражения коронарных артерий при коронароангиографии. У некоторых из этих пациентов при проведении пробы с физической нагрузкой выявляются достоверные признаки ишемии. Патогенез ишемии в этой ситуации может быть связан с неадекватным вазодилатационным резервом резистивных коронарных артерий. Считается, что резистивные сосуды (которые слишком малы, чтобы быть видимыми при коронароангиографии) у таких пациентов могут неадекватно расширяться в периоды возрастания потребности миокарда в кислороде. Прогноз этих пациентов лучше, чем при явных атеросклеротических поражениях.
ПОСЛЕДСТВИЯ ИШЕМИИ
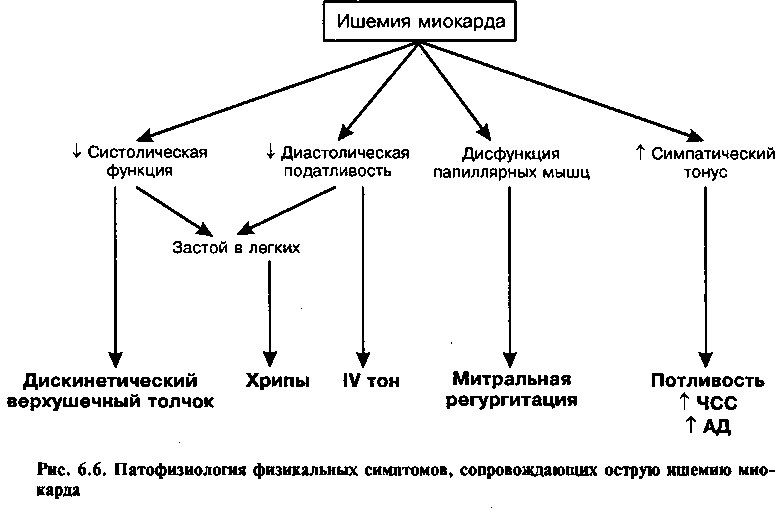
Последствия преходящей ишемии миокарда отражают его неадекватную оксигенацию и локальное накопление продуктов метаболизма. Во время ишемии кардиомиоциты переключаются с аэробного на анаэробный путь метаболизма. Сниженная продукция АТФ нарушает взаимодействие между сократительными белками и приводит к транзиторному снижению как систолической сократимости, так и диастолического расслабления левого желудочка. К тому же происходит местное накопление продуктов анаэробного метаболизма (например, лактата, серотонина, аденозина). Считается, что одна или несколько из этих субстанций активируют периферические болевые рецепторы сегментов С7-ТЬ4 и вызывают стенокардию.
При болевом синдроме, сопровождающем острый приступ ишемии, генерализованная симпатическая и парасимпатическая стимуляция может вызвать тахикардию, потливость, тошноту. Поскольку ишемия приводит к внезапному нарушению диастолического расслабления миокарда, в это время повышается жесткость левого желудочка и растет внутрижелудочковое диастолическое давление. Повышенное давление передается на легочное сосудистое русло и может вызывать одышку и отек легких. К тому же преходящие нарушения транспорта ионов в кардиомиоците и локальное накопление метаболитов могут вызывать опасные желудочковые нарушения ритма.
После разрешения острого ишемического эпизода (то есть после восстановления баланса между доставкой кислорода и потребностью в нем) симптомы стенокардии полностью исчезают. При кратковременной ишемии стойкие повреждения миокарда отсутствуют.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Наиболее важной частью клинического обследования пациента с ИБС является опрос. Поскольку боль в грудной клетке — очень распространенная жалоба, чрезвычайно важно сфокусироваться на тех ее характеристиках, которые позволяют отличить ишемию миокарда от других причин дискомфорта в грудной клетке. С диагностической точки зрения было бы идеально расспрашивать и осматривать пациента во время эпизода стенокардии, но у большинства больных в момент осмотра симптомы отсутствуют. В связи с этим необходимо тщательное выяснение определенных характеристик приступа.
Характер боли
Наиболее часто стенокардия описывается как «давление», «сжимание», «тяжесть» или «стягивание» в грудной клетке. Как боль это ощущение описывается очень редко, и пациенты могут поправить врача, если он использует слово «боль» для характеристики симптомов стенокардии. Ангинозные боли не бывают ни острыми, ни колющими, и их интенсивность существенно не меняется при акте дыхания или движениях грудной стенки. Речь идет о стойком дискомфорте, который продолжается несколько минут, редко более 5—10. Он всегда продолжается более двух секунд, и этот факт позволяет дифференцировать их от более острых мышечно-скелетных болей. Иногда пациент описывает ощущение следующим образом: «слон сел на грудь».
Описывая стенокардию, пациент может положить сжатый кулак на грудину, как будто плотно сжатые пальцы подтверждают сдавливающий характер дискомфорта — это называется признаком Левина. Как уже отмечалось выше, стенокардия часто сопровождается такими сопутствующими симптомами, как одышка, потливость, тошнота.
Локализация
Ангинозные боли обычно носят разлитой характер, а не локализуются в одной точке. Они наиболее часто ощущаются за грудиной или в прекордиальной области слева, но моут также локализоваться в любой другой части грудной клетки, спине, руках, шее, нижней части лица или верхней части живота. Боль часто иррадиирует в плечи и внутреннюю поверхность рук, особенно слева.
Провоцирующие факторы
Стенокардия, если она не вызвана вазоспазмом, провоцируется теми факторами, которые повышают потребность миокарда в кислороде (например, увеличение ЧСС, сократимости или напряжения стенки). Они включают физическое напряжение, гнев и другие сильные эмоции. Другими факторами, которые повышают потребность миокарда в кислороде и провоцируют ангинозный дискомфорт у пациентов с ИБС, являются обильная еда и холодная погода. Последняя вызывает периферическую вазоконстрикцию, которая, в свою очередь, влияет на напряжение стенки левого желудочка, который должен преодолевать повышенное сопротивление.
Стенокардия обычно проходит в течение нескольких минут после прекращения вызвавшей ее нагрузки, а при сублингвальном приеме нитроглицерина — еще быстрее (менее 3—5 минут). Эта реакция помогает дифференцировать ишемию миокарда от многих других причин, вызывающих дискомфорт в грудной клетке.
Если стенокардия развивается в первую очередь за счет повышения тонуса коронарных артерий или вазоспазма, симптомы часто возникают в покое, вне зависимости от нагрузок, повышающих потребность миокарда в кислороде. Иногда больные просыпаются ночью от приступа стенокардии, развившегося по этому механизму, или в результате эмоционального стресса (дурной сон), повышающего потребность в кислороде.
Частота
Хотя необходимый для возникновения боли уровень нагрузки может оставаться достаточно постоянным, частота эпизодов значительно варьирует, поскольку пациенты быстро узнают, какие действия вызывают дискомфорт, и избегают их. Поэтому при сборе анамнеза необходимо спрашивать больных об имеющихся ограничениях повседневной активности.
Факторы риска
В дополнение к описанию болей в грудной клетке тщательно собранный анамнез позволяет выявить факторы риска, предрасполагающие к атеросклерозу и ИБС, в том числе курение, гиперхолестеринемию, артериальную гипертензию, сахарный диабет и раннее развитие ИБС у родственников (см. главу 5).
Таблица 6.2. Причины рецидивирующей боли в грудной клетке
Состояние |
Диагностические признаки |
|
Кардиологические Ишемия миокарда |
|
Перикардит |
|
|
Гастроэнтерологические Пищеводный рефлюкс |
|
Язвенная болезнь |
|
Спазм пищевода |
|
Состояние |
Диагностические признаки |
Печеночная колика |
|
|
Мышечно-скелетные Косто-хондральный синдром |
|
Шейный радикулит |
|
ДИАГНОСТИКА
Стенокардию могут имитировать различные состояния, такие как пищеводный рефлюкс, спазм пищевода, печеночная колика, перикардит и патология костно-мышечной системы: миалгия, остеохондроз позвоночника, шейный радикулит. Ключевым моментом в дифференциации этих расстройств от ишемии миокарда остается анамнез. В отличие от стенокардии, желудочно-кишечные причины повторяющихся болей в грудной клетке часто провоцируются определенными видами пищи и не связаны с нагрузкой. Скелетно-мышечная боль обычно более поверхностна или локализуется в определенной точке (то есть пациент может указать на больное место одним пальцем) и часто изменяется при перемене положения тела. Полезные дифференциально-диагностические признаки перечислены в таблице 6.2.
Физикальное исследование
Если представляется возможность осмотреть пациента во время ангинозного приступа, могут быть выявлены несколько транзиторных симптомов (рис. 6.6). Часто из-за повышения тонуса симпатической нервной системы отмечается ускорение ЧСС и подъем артериального давления. Ишемия миокарда может приводить к дисфункции папиллярных мышц и, как следствие, к митральной регургитации, а также к нарушениям локальной сократимости желудочка, и, как следствие, к изменению характера верхушечного толчка. Ишемия может снижать растяжимость желудочка, он становится жестким, что приводит к появлению во время предсердной систолы IV тона и ритма галопа (см. главу 2). Однако если во время осмотра пациента дискомфорт отсутствует, никаких физикальных отклонений от нормы может не быть.
Методы диагностики
При подозрении на стенокардию диагноз ишемической болезни сердца можно поставить с помощью ряда исследований. Многие из них являются дорогостоящими, поэтому очень важно правильно выбрать план обследования для каждого пациента.
ЭЛЕКТРОКАРДИОГРАФИЯ
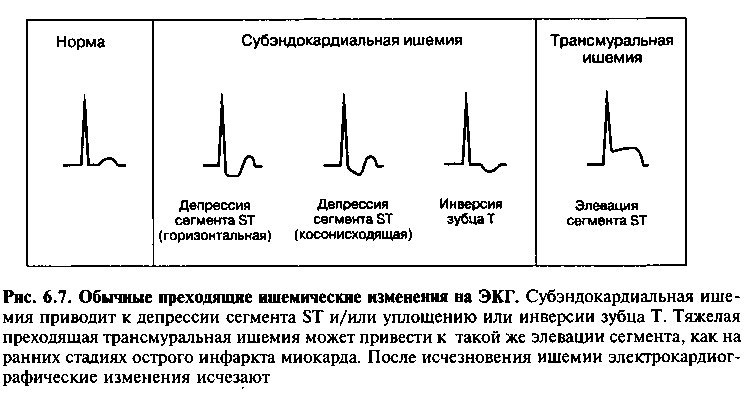
Одним из наиболее полезных методов является ЭКГ, снятая во время болевого эпизода. Это легко достижимо, когда симптомы возникают у госпитализированных больных; в амбулаторной практике же «поймать» такие эпизоды у пациентов весьма сложно. Во время ишемии миокарда могут отмечаться изменения сегмента ST и зубца Т (рис. 6.7). Острая ишемия обычно приводит к транзиторной горизонтальной или косонисходящей депрессии сегмента ST и уплощению или инверсии зубца Т. Иногда видна элевация сегмента ST, что предполагает более тяжелую трансмуральную ишемию миокарда, а также вызывается интенсивным вазоспазмом при «вариантной стенокардии», В отличие от острого ИМ, все отклонения сегмента ST быстро нормализуются после купирования симптомов. Если ЭКГ снимают вне ишемического эпизода, она может быть нормальной, или могут отмечаться «неспецифические» изменения сегмента ST и зубца Т. Признаки предшествующего инфаркта миокарда (то есть патологические зубцы Q) также указывают на наличие ИБС.
ПРОБЫ С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
ЭКГ, снятая во время эпизода дискомфорта в грудной клетке или вне его, может быть нормальной и не исключает диагноза ишемической болезни сердца. Поэтому важным диагностическим подспорьем оказывается проба с физической нагрузкой (также называемая пробой на толерантность к физической нагрузке). Во время этой пробы пациент выполняет постоянно возрастающую нагрузку на тредмиле или велоэргометре. За больными ведется наблюдение для выявления дискомфорта в грудной клетке или сильной одышки. Постоянно регистрируются ЧСС и ЭКГ, и через регулярные промежутки времени контролируется АД. Тест продолжается до развития приступа стенокардии, появления признаков ишемии миокарда на ЭКГ, достижения целевой ЧСС или усталости пациента, делающей невозможным продолжение нагрузки.
Тест считается положительным в отношении ИБС, если развивается типичный для пациента приступ болей в грудной клетке или возникают характерные для ишемии изменения ЭКГ (то есть горизонтальная или ко-сонисходящая депрессия сегмента ST > 1 мм). При использовании этих критериев чувствительность пробы при выявлении пациентов с анатомически значимым поражением коронарных артерий составляет приблизительно 65—80%, а специфичность — 65—75%. Тест может рассматриваться как резко положительный при выявлении одного из следующих признаков тяжелой ИБС: 1) ишемические изменения ЭКГ возникают в первые 3 минуты нагрузки или сохраняются в течение 5 минут после ее прекращения; 2) глубина депрессии сегмента ST > 2 мм; 3) падение систолического АД во время нагрузки (за счет вызванного ишемией нарушения сократимости); 4) развитие желудочковых нарушений ритма высоких градаций или 5) пациент не может переносить нагрузку более 2 минут из-за сердечно-легочной недостаточности. У пациентов с такими результатами пробы чаще бывает тяжелое многососудистое поражение коронарных артерий.
Информативность пробы может нарушаться приемом некоторых препаратов. Например, p-блокаторы или некоторые антагонисты кальция могут сделать невозможным достижение целевой ЧСС. В этих случаях следует иметь в виду цель, ради которой проводится нагрузочная проба. Если она проводится для того, чтобы установить, есть ли у пациента ИБС, тогда эти препараты должны быть отменены за 24—48 часов перед пробой. С другой стороны, у пациентов с подтвержденной ИБС при необходимости оценить эффективность подобранной схемы лечения проба проводится на фоне приема препаратов.
РАДИОИЗОТОПНЫЕ НАГРУЗОЧНЫЕ ПРОБЫ
Поскольку стандартная нагрузочная проба опирается на вызванные ишемией изменения на ЭКГ, этот вид проб менее применим у пациентов с исходными отклонениями сегмента ST (например, при блокаде левой ножки пучка Гиса или гипертрофии левого желудочка). К тому же стандартная нагрузочная проба может дать неоднозначные результаты у больных с высоким клиническим риском ИБС. В этих случаях с нагрузочными пробами может комбинироваться сцинтиграфия миокарда, что позволяет преодолеть эти ограничения и повысить чувствительность и специфичность пробы.
При перфузионной сцинтиграфии миокарда (описана в главе 3) радионуклид (обычно таллий-201 или технеций-99ш-сестамиби) вводится внутривенно на пике нагрузки и сразу же проводится исследование. Радионуклид накапливается пропорционально степени перфузии жизнеспособных кардиомиоцитов. Поэтому зоны сниженной перфузии (то есть зоны ишемии) во время нагрузки не накапливают радионуклид и выглядят как «холодные очаги». Однако погибшие участки тоже не захватывают радиоизотоп, и поэтому тоже будут выглядеть как «холодные очаги». С целью дифференциации транзиторной ишемии от рубцовой ткани через несколько часов проводится повторное исследование. Если холодный очаг исчезает, это трактуется как транзиторная ишемия миокарда. Если он остается не измененным, то вероятнее всего речь идет об инфаркте. Эти радионуклидные технологии имеют приблизительно 90%-ную чувствительность и 80—90%-ную специфичность при выявлении клинически значимой ИБС. Поскольку они являются дорогостоящими, применение перфузионной сцинтиграфии миокарда должно быть ограничено случаями, когда изменения на исходной ЭКГ не позволяют интерпретировать результаты стандартного теста с физической нагрузкой, или когда клинические симптомы ишемии не подтверждается результатами стандартного стресс-теста.
СТРЕСС-ЭХОКАРДИОГРАФИЯ
В некоторых клиниках используют сочетание физической нагрузки с эхокардиографическим исследованием. В данном случае речь идет об альтернативной методике, позволяющей выявить нарушения сократимости миокарда как проявление транзиторной ишемии, вызванной физической нагрузкой.
ФАРМАКОЛОГИЧЕСКИЕ НАГРУЗОЧНЫЕ ПРОБЫ
У пациентов, не способных выполнять физическую нагрузку (например, при тяжелом артрите), могут выполняться фармакологические нагрузочные пробы с использованием различных препаратов, включая инотропный амин добутамин (который повышает потребность миокарда в кислороде за счет увеличения ЧСС и усиления сократимости) или дипиридамол. Дипиридамол блокирует захват из крови аденозина и его деградацию. Возникающее в результате повышение концентрации аденозина вызывает коронарную вазодилатацию, что увеличивает кровоток в участках миокарда, кровоснабжаемых интактными коронарными артериями. Поскольку в ишемизированных зонах артерии уже и так максимально дилатированы из-за накопления локальных метаболитов, возникает «синдром обкрадывания», когда кровь оттекает от пораженных участков и они выглядят как «холодные очаги» на сцинтиграфии. Вместо радионуклидного исследования фармакологический стресс-тест может проводиться в сочетании с эхокардиографией.
КОРОНАРОАНГИОГРАФИЯ
Наиболее точным способом выявления стенозов коронарных артерий является коронароангиография, при которой атеросклеротические бляшки визуализируются рентгенологически в результате введения контрастного вещества в артерию (рис. 6.8; также см. главу 3). Риск, связанный с этой процедурой, низкий, но он достоверно больше, чем при описанных выше неинвазивных исследованиях.
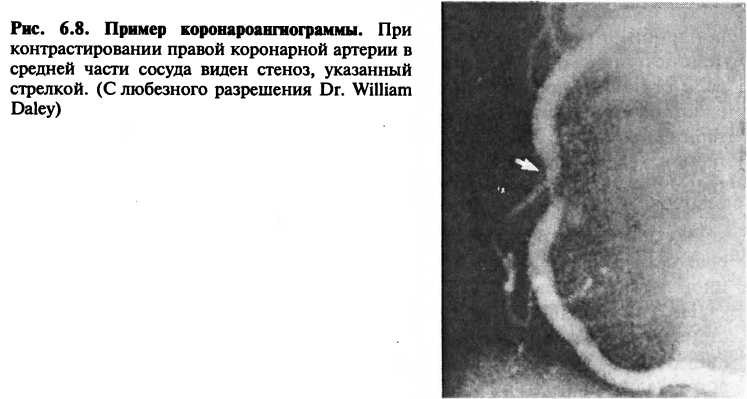
Диагноз ИБС может быть поставлен у большинства пациентов на основании данных анамнеза, подкрепленных результатами неинвазивных исследований. Катетеризация сердца и коронароангиография должны применяться в случаях, когда медикаментозная терапия не эффективна, болезнь дебютирует нестабильной стенокардией или когда неинвазивные тесты выявили столь серьезные отклонения, что вероятна тяжелая ИБС, требующая реваскуляризации.
Хотя коронароангиография считается «золотым стандартом» в диагностике ИБС, необходимо отметить, что она дает только анатомическую информацию. Клиническая значимость выявляемых при ангиографии поражений зависит не только от тяжести стеноза, но и от физиологических последствий. Поэтому при выборе тактики лечения больного учитывают не только наличие стенозов, но прежде всего их физиологические последствия: клинические проявления, жизнеспособность участков миокарда, кровоснабжающихся стенозированными сосудами, и выраженность систолической дисфункции желудочка (см. ниже). Более того, при стандартной ангиографии нельзя оценить строение атеросклеротической бляшки и риск ее разрыва.
ТЕЧЕНИЕ ЗАБОЛЕВАНИЯ
У больных хронической ИБС стабильный характер стенокардии напряжения может сохраняться без изменений многие годы. Однако у некоторых пациентов течение заболевания в любой момент может утяжеляться развитием нестабильной стенокардии, инфаркта миокарда или внезапной коронарной смерти. Эти осложнения часто связаны с острым тромбозом в месте разрыва атеросклеротической бляшки (как было описано в главе 7). Почему эти осложнения развиваются у одних больных и не развиваются у других, остается предметом интенсивных продолжающихся клинических и фундаментальных исследований.
До начала современной эры комбинированной фармакотерапии, коронарной ангиопластики и хирургических вмешательств, исследования демонстрировали, что ежегодная смертность больных с ИБС коррелировала с числом сосудов, имеющих гемодинамически значимые стенозы (таблица 6.3). Например, у пациентов с выраженным стенозом одной артерии смертность составляла < 4% в год. У лиц с двумя пораженными артериями ежегодная смертность составляла 7—10%, а при распространенном трехсосудистом поражении она колебалась в пределах 10—12%. При гемодинамически значимом стенозе ствола левой коронарной артерии уровень смертности резко повышался — до 15-25%. Эти показатели были еще хуже у аналогичных больных со сниженной сократительной функцией левого желудочка.
По данным последних исследований, локализация и выраженность стенозов сохраняют свое значение, но выявлены и другие факторы, влияющие на смертность: 1) степень нарушения сократительной функции левого желудочка, 2) низкая толерантность к физическим нагрузкам и 3) тяжесть стенокардии. При определении тактики лечения принимаются во внимание все эти факторы.
Необходимо отметить, что последние три десятилетия смертность от ИБС существенно снизилась; стандартизированный по возрасту показатель смертности уменьшился более чем на 50%. Судя по всему, это связано с: 1) снижением риска атеросклеротических заболеваний в результате изменения образа жизни (например, меньшей распространенностью курения, потреблением менее жирной пищи, увеличением объема физических нагрузок); 2) улучшением качества лечения и выживаемости при остром инфаркте миокарда (см. главу 7) и 3) успехами медикаментозного и хирургического лечения хронической ИБС.
Таблица 6.3. Прогноз больных стенокардией (до начала современной эры агрессивного медикаментозного/хирургического лечения)
Число стенозированных сосудов |
Ежегодная смертность (%)* |
1 |
< 4 |
2 |
7-10 |
3 |
10-12 |
Стеноз основного ствола левой коронарной артерии |
15-25 |
ЛЕЧЕНИЕ
Целью лечения хронической ИБС является улучшение качества жизни пациента за счет снижения частоты ангинозных приступов, профилактика острого инфаркта миокарда и улучшение выживаемости. Ключевым принципом, направленным на долгосрочные перспективы, является воздействие на факторы риска, лежащие в основе атеросклеротического поражения коронарных артерий. Таким образом, необходимы меры по контролю артериальной гипертензии и сахарного диабета, снижению уровня холестерина и уменьшению потребления жиров, отказу от курения, предотвращению стрессовых ситуаций и контролю за массой тела. Последние исследования показали заметное снижение коронарных событий и смертности у пациентов, которым удалось с помощью диеты и фармакотерапии существенно снизить уровень холестерина ЛНП крови (см. главу 5).
Стратегия, лежащая в основе современного лечения ишемии миокарда, заключается в восстановлении баланса между доставкой кислорода к миокарду и потребностью в нем и в профилактике осложнений фиброзных бляшек.
Купирование острого приступа стенокардии
При развитии приступа стенокардии пациент должен прекратить физическую нагрузку. Препаратом выбора является нитроглицерин, органический нитрат, принимаемый сублингвально. При всасывании препарата нитроглицерина через слизистую оболочку рта появляется легкое жжение. Лекарство действует через 1-2 минуты и купирует ишемию миокарда в основном за счет расслабления гладких мышц сосудистой стенки, а также вследствие дилатации вен. Расширение вен снижает венозный возврат к сердцу, в результате чего уменьшается объем левого желудочка (а значит, напряжение его стенки) и снижается потребление миокардом кислорода.
Другим эффектом нитратов является коронарная вазодилатация с соответствующим влиянием на коронарный кровоток. Этот эффект у большинства пациентов со стенокардией имеет минимальное значение, так как аккумуляция локальных метаболитов уже привела у них к максимальной вазодилатации. Однако при преобладании в генезе ишемии вазоспазма вазодилатация, индуцируемая нитратами, весьма полезна.
Профилактика повторных ишемических эпизодов
В профилактике приступов стенокардии также на первое место обычно выходят фармакологические препараты. Целью этих лекарств является снижение нагрузки на сердце и, таким образом, потребности миокарда в кислороде, и повышение перфузии миокарда. Наиболее широко применяются три класса препаратов: органические нитраты, р-адреноблокато-ры и антагонисты кальция (табл. 6.4).
Органические нитраты (например, нитроглицерин, изосорбида динитрат, изосорбида мононитрат), как уже отмечалось, купируют ишемию в первую очередь за счет дилатации вен и, возможно, за счет коронарной вазодилатации. Органические нитраты являются старейшим классом ан-тиангинальных препаратов и выпускаются в нескольких формах. Сублингвальные таблетки или спрей нитроглицерина предназначены для купирования острых приступов из-за быстрого начала их действия. Кроме того, быстродействующие нитраты, принятые перед нагрузкой, обычно вызывающей стенокардию, могут быть полезны для профилактики приступа стенокардии напряжения.
Долгосрочная профилактика стенокардии может достигаться с помощью различных форм нитратов, включая таблетки изосорбида ди- или мононитрата для приема внутрь или трансдермальный пластырь с нитроглицерином, наклеиваемый один раз в сутки. Долгосрочную терапию нитратами ограничивает развитие толерантности к ним (то есть снижение эффективности лекарства при его постоянном приеме), которая в какой-то мере развивается у большинства пациентов. Этот нежелательный эффект может быть предотвращен созданием безнитратного промежутка продолжительностью в несколько часов, обычно когда пациент спит.
Не существует данных, что нитраты улучшают выживаемость или предотвращают развитие инфарктов у больных хронической ИБС; они применяются только для облегчения симптомов болезни. Наиболее частыми побочными эффектами этих препаратов являются головная боль, головокружение и сердцебиение за счет вызванной рефлекторной синусовой тахикардии. Последняя может быть нивелирована комбинацией нитратов с В-блокаторами.

(3-блокаторы (описываются далее в Главе 17) обладают антиангиналь-ным эффектом, основанным на снижении потребности миокарда в кислороде. Они взаимодействуют с p-адренорецепторами, которые бывают двух типов. р2-адренорецепторы локализуются в периферических кровеносных сосудах и в бронхах, а Р]-адренорецепторы встречаются почти исключительно в миокарде. Стимуляция Pj-адренорецепторов катехоламинами или другими симпатомиметиками приводит к ускорению ЧСС и усилению сократимости миокарда. Поэтому антагонисты адренорецепторов уменьшают силу сокращений желудочка и замедляют ритм, снижая таким образом потребность миокарда в кислороде и предупреждая ишемию.
Ряд недавних исследований продемонстрировал способность этой группы препаратов снижать частоту повторных инфарктов миокарда и смертность от ИБС (см. главу 7). Более того, было показано, что р-блока-торы снижают вероятность первичного инфаркта миокарда у пациентов с гипертензией. Поэтому p-блокаторы считаются препаратами первой линии в лечении коронарной болезни сердца.
Р-блокаторы обычно хорошо переносятся, но имеют несколько возможных побочных эффектов. Они могут провоцировать бронхоспазм у пациентов с сопутствующей астмой из-за антагонизма с р2-адренорецеп-торами бронхиального дерева. Хотя селективные Pt-адреноблокаторы теоретически менее склонны вызывать бронхоспазм у таких пациентов, полной селективности препаратов в отношении Р] -рецепторов не отмечается, и в целом следует избегать применения всех p-блокаторов у больных с обструктивными болезнями легких.
p-блокаторы иногда вызывают слабость и сексуальную дисфункцию и могут ухудшить контроль гликемии у пациентов с диабетом. Они теоретически могут ухудшить перфузию миокарда посредством блокады вазодилатирующих р2-адренорецепторов коронарных артерий. Однако этот эффект обычно нивелируется механизмом саморегуляции и вазодилатацией коронарных артерий в ответ на накопление локальных метаболитов. p-блокаторы не показаны при брадикардии и нарушениях атриовентрикулярной проводимости.
Антагонисты кальция (см. главу 17) блокируют потенциалзависимые кальциевые каналы типа L, однако эффекты индивидуальных препаратов этого класса различны. Дигидропиридины (например, нифедипин) являются мощными вазодилататорами. Они устраняют ишемию миокарда посредством: 1) снижения потребности миокарда в кислороде {венодилатация уменьшает наполнение желудочка и его размер; артериальная вазодилатация снижает сопротивление, против которого сокращается желудочек — и то, и другое уменьшает напряжение стенки) и 2) увеличения доставки кислорода к миокарду путем расширения коронарных артерий. Последний механизм делает их также мощными препаратами для лечения спазма коронарных артерий.
Другие антагонисты кальция — верапамил и дилтиазем — также являются вазодилататорами, но менее сильными, чем дигидропиридиновая группа. Однако эти агенты обладают дополнительными положительными антиангинальными эффектами: они снижают силу сокращений желудочка (инотропное действие) и замедляют ритм сердца. Соответственно, верапамил и дилтиазем через эти механизмы уменьшают потребность миокарда в кислороде.
В недавних исследованиях поднимался вопрос о безопасности дигидропиридиновых антагонистов кальция короткого действия при лечении ишемической болезни сердца. В метаанализах рандомизированных исследований эти препараты ассоциировались с повышением частоты инфарктов миокарда и смертности. Если эти данные подтвердятся, эти негативные эффекты могут быть связаны с быстрым гемодинамическим ответом и колебаниями артериального давления, вызываемыми препаратами короткого действия. Поэтому сейчас для лечения стабильной стенокардии рекомендуются только антагонисты кальция длительного действия, в качестве препаратов второго ряда, если симптомы ИБС не устраняются p-блокаторами и нитратами.
Три класса антиангинальных препаратов могут применяться в виде монотерапии или в комбинациях. Однако следует с осторожностью сочетать p-блокатор с недигидропиридиновым антагонистом кальция (то есть, верапамилом и дилтиаземом), поскольку сумма их отрицательных хронотропных эффектов может привести к чрезмерной брадикардии, а отрицальных инотропных эффектов — к застойной сердечной недостаточности.
Несмотря на контроль симптомов стенокардии, ни один из классов антиангинальных препаратов не позволяет замедлить или вызвать обратное развитие атеросклеротического процесса, лежащего в основе хронической коронарной болезни. Однако результаты последних исследований свидетельствуют, что эта цель достигается медикаментозным снижением уровня холестерина ЛНП (см. главу 5).
Антиагрегантная терапия аспирином является стандартным дополнением к схеме лечения ИБС. Агрегация тромбоцитов и тромбоз задействованы в патогенезе инфаркта миокарда (см. главу 7) и нестабильной стенокардии. Аспирин ингибирует агрегацию тромбоцитов (и соответственно уменьшает последующее высвобождение из них прокоагулянтов и вазоконстрикторов) и обладает доказанным снижением риска инфаркта миокарда у больных стабильной стенокардией. При отсутствии противопоказаний (аллергии, патологии желудка) аспирин назначается больным с подтвержденной ИБС пожизненно, особенно после перенесенного инфаркта миокарда. Учитывая ключевую роль агрегации тромбоцитов и тромбоза в патогенезе коронарных синдромов, разрабатываются новые и более мощные антитромбоцитарные агенты.
Пациентов, у которых под действием медикаментозной терапии стенокардия исчезает, далее ведут консервативно с постоянным мониторингом факторов риска. Однако приходится прибегать к более агрессивной реваскуляризации, если: 1) стенокардия рефрактерна к медикаментозной терапии, 2) возникают неприемлемые побочные эффекты, 3) у пациента одна из разновидностей тяжелой ИБС, при которых хирургическая реваскуляризация улучшает выживаемость (см. ниже). Два наиболее распространенных метода реваскуляризации — это чрескожная транслюминальная коронарная ангиопластика и операция аортокоронарного шунтирования.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) — это проводимая под рентгеновским контролем процедура, при которой катетер с баллоном на конце вводится через периферическую артерию (обычно бедренную или плечевую) и проводится в стенозированный сегмент коронарной артерии. Баллон на конце катетера затем раздувается под большим давлением, так что стеноз расширяется и коронарная перфузия увеличивается, после чего катетер удаляется. Расширение просвета коронарной артерии достигается сжатием бляшки и нередко разрывом внутри бляшки и растяжением подлежащей медии. Только некоторые типы стенозов подлежат баллонной дилатации, но ангиопластика бывает успешной приблизительно в 90% подобных случаев. Риск инфаркта миокарда во время процедуры меньше 5%, а смертность составляет приблизительно 1 % или даже менее. К сожалению, примерно в трети случаев в месте ангиопластики через 6 месяцев развивается рестеноз, что требует повторной процедуры.
Кроме баллонной ангиопластики, применяется ряд других чрескожных методик реваскуляризации. При направленной коронарной атероэкто-мии у места стеноза устанавливают окончатый цилиндр, внутри которого находится круглое металлическое лезвие. Раздувая баллон, прижимают окошечко цилиндра к месту предполагаемой бляшки и с помощью вращающегося в цилиндре лезвия постепенно срезают бляшку. Фрагменты бляшки удаляются через катетер. При ротационной атероэктомии используется быстро вращающийся буравчик, позволяющий пройти сквозь кальцифицированную или фиброзную бляшку. Чрескожные лазерные катетерные методики позволяют «испарить» атеросклеротическую бляшку. К сожалению, ни одна из этих современных технологий не имеет доказанных преимуществ над стандартной баллонной ангиопластикой в отношении длительности сохранения проходимости сосуда.
Новейшим достижением среди чрескожных катетерных методик является имплантация коронарных стентов — тонких, похожих на пружинку устройств из сверхпрочной стали, которые в сложенном состоянии проводятся в зону стеноза с помощью катетера. Установленный в месте стеноза стент раскрывается посредством раздувания внутри него баллона под большим давлением. Затем баллон удаляется, а стент остается навсегда и служит каркасом, обеспечивающим проходимость артерии. По последним данным, стентирование позволяет добиться большей степени расширения просвета, значительно снижает частоту рестенозов и потребность в повторной ангиопластике. В настоящее время для дальнейшего снижения частоты тромбозов и рестенозов исследуются комбинации новых мощных антитромботических средств и стентирования.
Операция аортокоронарного шунтирования (АКШ) подразумевает пересадку сегментов собственных кровеносных сосудов с целью обходного кровотока в пораженных коронарных артериях. Используются два типа трансплантатов (рис. 6.9). В первом случае используется фрагмент подкожной вены — «ненужного» сосуда, удаляемого с ноги, который подшивается одним концом к аорте, а другим — к сегменту коронарной артерии дистальнее стеноза. При другой методике создают прямой анастомоз внутренней грудной артерии (ветви подключичной артерии) с коронарной артерией дистальнее стеноза. Поскольку было показано, что внутренняя грудная артерия (еще один «ненужный» сосуд) длительно сохраняет проходимость у большего процента пациентов по сравнению с венозными трансплантатами, желательно использовать этот сосуд при реваскуляризации ключевых мест кровотока, таких как передняя межжелудочковая артерия. Маммарно-коронарный шунт сохраняет свою проходимость через 10 лет у 90% пациентов. Напротив, венозные трансплантаты проходимы в 80% случаев через 12 месяцев, но через 10 лет после операции более 50% из них окклюзируются. Однако недавно были получены сведения, что агрессивная гиполипидемическая терапия после АКШ может улучшить долгосрочную проходимость венозных трансплантатов.
После АКШ стенокардия исчезает у подавляющего большинства больных, и переносимость нагрузок обычно улучшается. Большие клиниче-
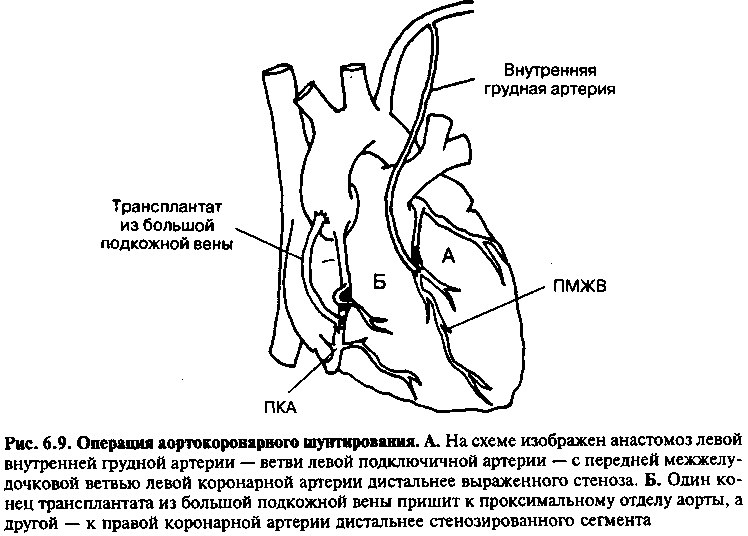
ские исследования показали преимущества АКШ над медикаментозным лечением ИБС в отношении выживаемости только у определенных подгрупп больных: 1) пациентов с гемодинамически значимым стенозом ствола левой коронарной артерии или 2) пациентов со значимыми стенозами всех трех основных коронарных артерий или их ветвей, особенно при нарушении систолической функции левого желудочка.
Многие пациенты с хронической стабильной стенокардией могут успешно лечиться только медикаментозно. Однако механическая реваскуляризация рекомендуется пациентам с рефрактерной стенокардией или при развитии непереносимых побочных эффектов антиангинальных препаратов. Чрескожная ангиопластика проводится больным с подходящей для катетерных технологий анатомией коронарного русла. Пациентам с не подходящими для ангиопластики стенозами, а также в группах высокого риска, где было показано улучшение выживаемости после хирургического вмешательства (перечислены в предыдущем абзаце); рекомендуется АКШ. Кроме того, по последним данным, у диабетиков с многососудистым поражением, которым можно провести как ангиопластику, так и АКШ, выживаемость, тем не менее, лучше после хирургического вмешательства.
Лечение нестабильной стенокардии
У большинства пациентов с нестабильной стенокардией имеется распространенное атеросклеротическое поражение венечных артерий, осложненное наличием тромбоцитарного тромба и/или дополнительной вазоконстрикцией. Оба эти фактора вызыывают недостаточное кровоснабжение сердца. Поэтому эффективная терапия направлена против всех этих факторов.
Больной с симптомами нестабильной стенокардии должен быть госпитализирован и находиться на постельном режиме для снижения потребности миокарда в кислороде. С целью дифференциации нестабильной стенокардии от необратимого некроза, то есть инфаркта миокарда, используется регистрация ЭКГ в динамике и определение сывороточных маркеров повреждения миокарда (см. главу 7). С целью восстановления баланса между доставкой кислорода к миокарду и потребностью в нем назначаются p-блокаторы и нитраты (часто внутривенно). У пациентов, которые ранее не получали p-блокаторы, назначение препаратов этого класса уменьшает вероятность прогрессирования нестабильной стенокардии и развития инфаркта миокарда. Антагонисты кальция этим преимуществом не обладают; они не предотвращают развития инфарктов и не снижают смертность при нестабильной стенокардии. Поэтому антагонисты кальция при нестабильной стенокардии или не следует использовать вообще, или использовать только как препараты второго ряда для купирования боли у пациентов, не отвечающих на p-блокаторы и нитраты.
Ввиду того, что агрегация тромбоцитов и формирование тромба играют центральную роль в патофизиологии нестабильной стенокардии, стандартом лечения является антиагрегационная (то есть аспирин) и антикоагулянтная (то есть внутривенный гепарин) терапия. Оба эти препарата как в виде монотерапии, так и в комбинации существенно уменьшают прогрессирование нестабильной стенокардии и инфаркта миокарда. Напротив, тромболитические агенты, которые чрезвычайно эффективны при остром инфаркте миокарда, не продемонстрировали способности уменьшать при нестабильной стенокардии смертность или число осложнений. Поэтому эти средства не применяются в этой ситуации. Если пациент не отвечает достаточно быстро на лечение аспирином, гепарином, p-блокаторами и нитратами, следует провести экстренную корона-роангиографию, за которой часто следует реваскуляризация.
Драматическим осложнением хронической ишемической болезни сердца и нестабильной стенокардии является острый инфаркт миокарда, о котором речь пойдет в следующей главе.
ЗАКЛЮЧЕНИЕ
1. Ишемия миокарда развивается из-за дисбаланса между доставкой кислорода и потребностью в нем. Доставка кислорода к миокарду определяется кислородсвязывающей способностью крови и коронарным кровотоком. Последний зависит от коронарного перфузионного давления и сосудистого сопротивления. Ключевые факторы, определяющие потребность миокарда в кислороде, включают напряжение стенки сердца, частоту сердечных сокращений и сократимость.
2. При наличии атеросклеротического поражения доставка кислорода к миокарду нарушается. Атеросклеротические бляшки вызывают сужение просвета сосуда и уменьшают кровоток в эпикардиальных коронарных артериях. Кроме того, связанная с атеросклерозом дисфункция эндотелия вызывает неадекватную вазоконстрикцию резистивных коронарных сосудов.
3. Стенокардия является наиболее частым симптомом транзиторной ишемии, и ее диагностика во многом основана на описании пациентом этого дискомфорта. Приступ стенокардии может сопровождаться признаками и симптомами адренергической стимуляции, отеком легких и транзиторной систолической и диастолической дисфункцией левого желудочка.
4. Лабораторные методы, применяющиеся для диагностики стенокардии, включают электрокардиографию (депрессия сегмента ST, то есть субэндокардиальная ишемия миокарда, или его элевация — трансмуральная ишемия), пробу с физической нагрузкой или фармакологические пробы и коронароангиографию.
5. К стандартным препаратам, применяемым для лечения стабильной стенокардии, относятся органические нитраты, p-блокаторы и антагонисты кальция (в виде монотерапии или в комбинациях), также аспирин, а при наличии показаний — гиполипидемическая терапия. Модифицируемые факторы риска атеросклероза нуждаются в коррекции. Отдельным пациентам необходима ангиопластика или операция аортокоронарного шунтирования.