Методы визуализации и катетеризации сердца
Методы визуализации играют основополагающую роль в оценке сердечной функции и патологии. Наиболее часто используемые методы визуализации — это рентгенография грудной клетки, эхокардиография, сердечная катетеризация с синеангиографией и изотопные исследования. В диагностике сердечно-сосудистых заболеваний находят все большее распространение компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
Эта глава представляет обзор применения указанных методов, используемых для оценки сердечно-сосудистых расстройств. Она может рассматриваться как справочник, в который можно заглядывать при прохождении последующего материала.
РЕНТГЕНОГРАФИЯ СЕРДЦА
Глубина проникновения рентгеновских лучей в тело человека обратно пропорциональна плотности тканей. Ткани, в которых содержится воздух (например, легкие), слабо поглощают рентгеновские лучи и, следовательно, фотопленка в этих местах будет черной. В отличие от этого, плотные материалы, такие как кости, поглощают рентгеновские лучи значительно сильнее, и их изображения будут казаться белыми или матовыми. Для проведения границы между двумя структурами они должны различаться по плотности. Миокард, клапаны и другие внутрисердечные структуры обладают плотностью, сравнимой с плотностью омывающей их крови и, следовательно, не могут быть выявлены с помощью рентгенографии, если они не кальцифицированы. Тем не менее, границы сердца и легких могут быть очерчены отчетливо, так как сердце и наполненное воздухом легкое сильно различаются по плотности. При отеке легких, фиброзе или спавшемся легком плотность легочной ткани окажется сравнимой с плотностью сердца и сердечные контуры окажутся размытыми.
Фронтальные и боковые рентгенограммы являются рутинными для изучения состояния сердца и легких (рис. 3.1). Фронтальный вид обычно представляет собой передне-заднее (ПЗ) изображение, для получения которого источник рентгеновских лучей располагается за спиной пациента, лучи проникают через тело и освещают фотопленку, расположенную у грудной клетки. В стандартном боковом положении фотопленка располагается с левой стороны пациента, а рентгеновские лучи распространяются сквозь тело по направлению справа налево. Фронтальная рентгенограмма особенно хороша, когда требуется оценить размер левого желудочка, ушко левого предсердия, легочную артерию, аорту и верхнюю полую вену; боковой снимок оценивает размер правого желудочка, задние границы левого предсердия и желудочка и передне-задний размер грудной клетки. В некоторых случаях оптимальная оценка сердечных размеров требует как правого, так и левого боковых снимков.
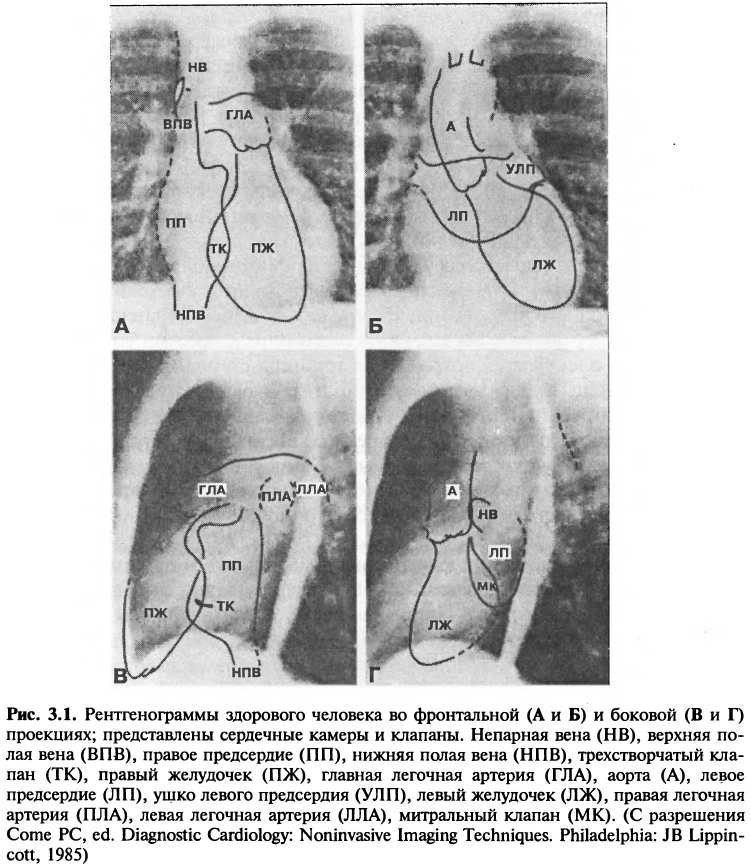
Тень сердца
Рентгенограммы грудной клетки используются для оценки размеров сердечных камер и легочных осложнений сердечных заболеваний. Изменения в размерах камер отображаются в изменении формы сердца. При фронтальном снимке взрослого человека тень сердца должна занимать 50% или менее от максимальной ширины грудной клетки, измеренной между внутренними краями ребер. У детей нормальный диаметр сердца может достигать 60% от размера грудной клетки. Для наблюдения за изменениями размеров сердца удобно пользоваться отношением серд-це/грудная клетка вместо абсолютных значений размеров.
Существуют ситуации, при которых силуэт сердца неправильно отображает его размеры. Например, при приподнятой диафрагме или узком передне-заднем размере грудной клетки сердце может казаться более широким. В результате этого ширина тени сердца может превышать половину размера грудной клетки, хотя настоящий размер сердца нормальный. Поэтому, прежде чем делать заключение о расширении сердца по фронтальному его изображению, необходимо сделать снимок в боковой проекции. Наличие выпота в перикарде также может вызвать увеличение тени сердца, так как жидкость и миокард одинаково пропускают рентгеновские лучи.
Рентгенограммы выявляют изменения, связанные с расширением сердечных камер и больших сосудов. Гипертрофия сердца может не отражаться на снимке, так как при гипертрофии обычно происходит уменьшение размеров полости сердца при отсутствии изменений внешнего контура сердца. Гипертрофию сердца чаще всего определяют по вольтажу комплекса Q.RS электрокардиограммы, а толщина стенок может быть определена с помощью других методов, например, эхокардиографии. Основными причинами расширения камер сердца и больших сосудов являются сердечная недостаточность, пороки сердца, аномальные внутри- и вне-сер-дечные шунты и некоторые легочные заболевания. Так как для расширения сердца требуется некоторое время, то недавно возникшие пороки сердца, такие как острая митральная недостаточность, могут иногда протекать без расширения сердца.
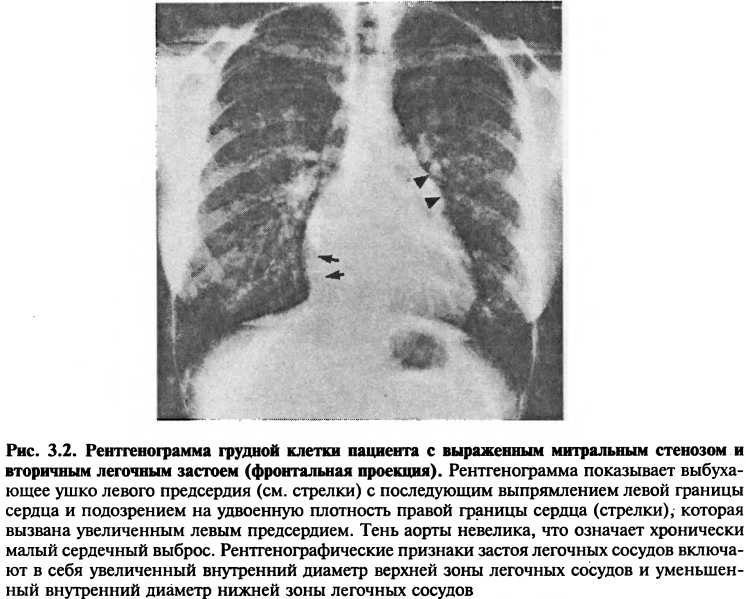
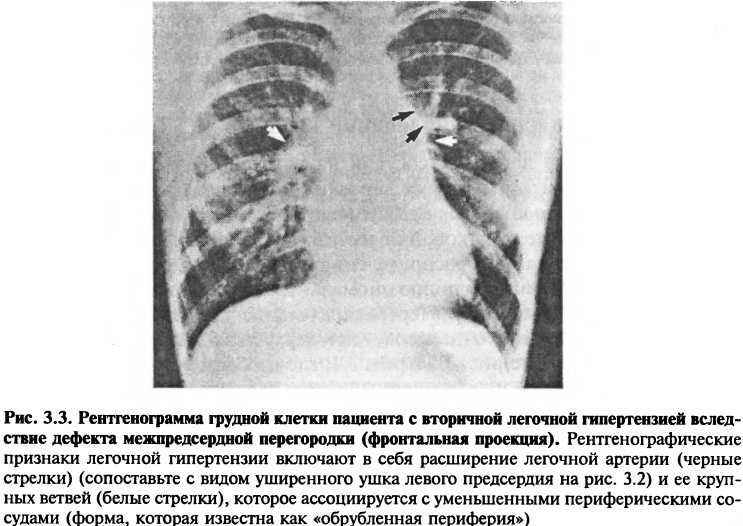
Характер расширения камер сердца может дать информацию о наличии специфических заболеваний. Например, расширение левого предсердия и правого желудочка, сопровождаемое явными признаками легочной гипертонии, говорит о митральном стенозе (рис. 3.2). В отличие от этого, расширение легочной артерии и правых сердечных камер, но без расширения левых отделов сердца, говорит об обструкции легочных сосудов или увеличенном потоке крови через легочную артерию (например, из-за дефекта межпредсердной перегородки) (рис. 3.3).
Форма уширенной камеры также может указывать на причину заболевания. Например, при перенаполнении объема левого желудочка из-за клапанной недостаточности, желудочек стремится расшириться в основном вдоль своей большой оси, при этом верхушка сердца смещается вниз и влево. Напротив, когда расширение левого желудочка происходит из-за первичной дисфункции миокарда, длина и ширина левого желудочка обычно увеличиваются одновременно, при этом сердце приобретает шаровидную форму.
Расширение аорты и легочной артерии также может быть видно при рентгеноскопии грудной клетки. Причины расширения аорты включают в себя аневризму, расслоение и пороки аортального клапана (рис. 3.4). Легочная артерия может быть увеличенной у пациентов со сбросом крови слева направо, что увеличивает легочный кровоток (рис. 3.3); то же происходит у пациентов с легочной гипертензией, вызванной различными причинами. У некоторых больных с легочным стенозом обнаруживается изолированное увеличение проксимального отдела левой легочной артерии.

Легочные проявления заболеваний сердца
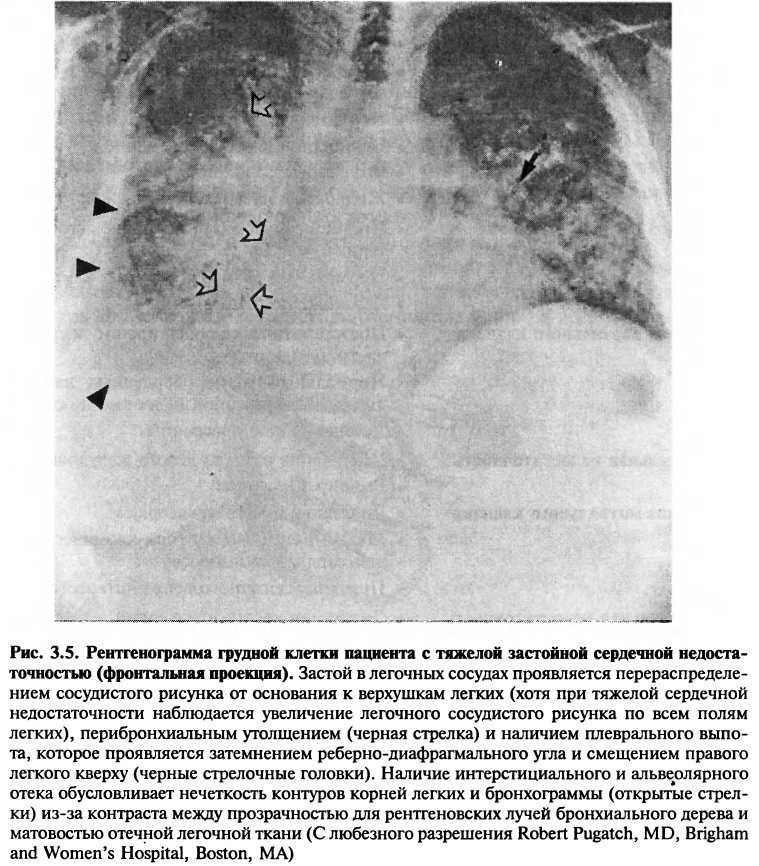
Изображение легочных сосудов на рентгенограмме грудной клетки позволяет оценить изменения давления в легочных артериях и венах, а также легочного кровотока. Увеличенное венозное легочное давление вследствие левожелудочковой недостаточности приводит к усилению сосудистого рисунка, перераспределению крови от основания к верхушкам легких, отеку легких, наличию аномальных септальных линий и плеврального выпота (рис. 3.5). Перераспределение кровотока проявляется в расширении теней легочных сосудов в верхушках легких или увеличении их числа. (Сравните рис. 3.5 с рис. 3.1, где изображены здоровые легкие.) Интерстициальный и альвеолярный отеки являются причинами затемнения в области корней легких (известного как «вид бабочки») и воздушных бронхограмм. Септальные линии (известные как линии Керли), которые свидетельствуют об отеке междольковых перегородок, обусловлены интерстициальным отеком. Плевральный выпот вызывает затемнение реберно-диафрагмальных углов.
Изменения в легочном кровотоке могут также вызвать перестройку в рисунке легочных сосудов. Локальное снижение кровотока в отдельных частях легких может быть вызвано эмболией легочной артерии или эмфизематозными буллами. Расширение крупных ветвей легочных артерий, сопровождающееся уменьшением периферических сосудов (в виде «обрубленной периферии») говорит о легочной гипертензии (рис. 3.3).
Таблица 3.1 подводит основные результаты использования рентгенографии в диагностике основных сердечных заболеваний.
ЭХОКАРДИОГРАФИЯ
Эхокардиография играет важную роль в диагностике и динамической оценке многих нарушений сердечной деятельности. Эта методика безопасна, не требует инвазивного вмешательства, относительно недорогая; она дает возможность довольно точно изучать значительную часть нарушений работы сердца. Высокочастотные (ультразвуковые) волны, генерируемые с помощью пьезоэлектрического датчика, проникают сквозь ткани и отражаются от поверхности раздела сред с различным акустическим сопротивлением. Отраженные волны возвращаются к датчику и вызывают механическую деформацию пьезоэлемента. Расстояние между датчиком и отражающей импульсы анатомической структурой вычисляется компьютером в реальном масштабе и трансформируется в изображение.

Используют три вида эхокардиограмм: 1) М-режим, 2) двумерное изображение и 3) доплеровское изображение. Каждый вид изображений может быть получен из различных точек. Обычно производят трансторакальное сканирование, при котором датчик располагают на поверхности грудной клетки. Когда требуется большое структурное разрешение, то производится чреспищеводное сканирование.
В диагностике сердечно-сосудистых заболеваний ультразвуковая техника впервые была использована в режиме одномерной эхокардиограммы в М-ре-жиме. Сейчас этот вид эхокардиографии в первоначальном виде используется редко, потому что он дает только ограниченные данные, из-за узкой развертки ультразвукового пучка. Изображения, полученные таким способом, используются для оценки толщины стенок и размеров полостей сердца, а также для точного анализа движения клапанов во времени (рис. 3.6).
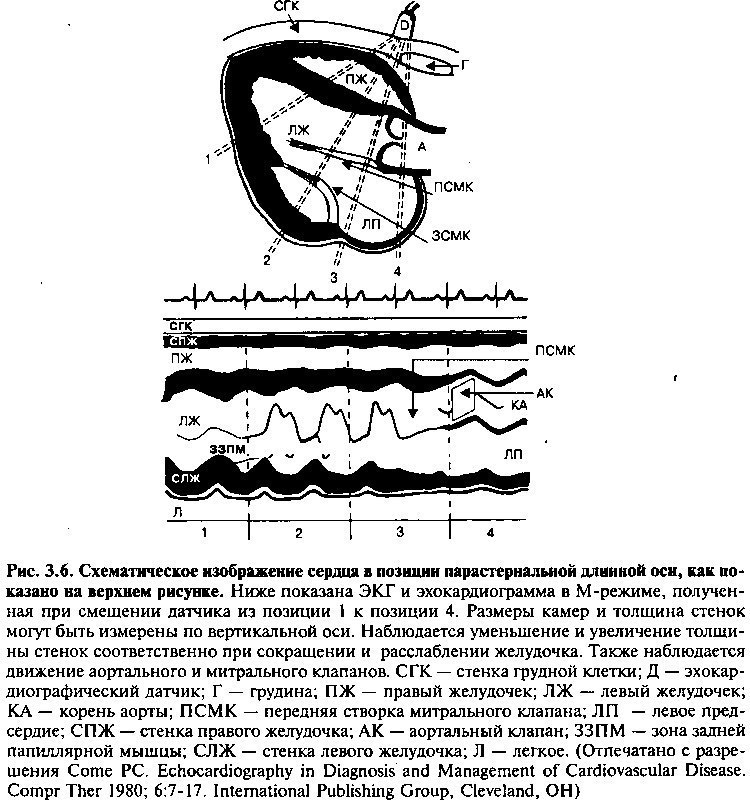
При двумерной эхокардиографии датчик испускает большое количество ультразвуковых пучков, образующих широкий конус. Возвращенные сигналы интегрируются и образуют двумерные изображения сердца на видеоэкране. Таким образом, эта техника описывает анатомические соотношения и показывает движение сердечных структур по отношению друг к другу. Возможность использования широкого ультразвукового пучка позволяет при двумерной эхокардиографии определять и отображать движение клапанов и стенок, аномальное шунтирование крови и внутрисердечные образования, такие как вегетации на клапанах, тромбы и опухоли.
При двумерной эхокардиографии каждая плоскость (рис. 3.7) отображает только часть сердечной структуры. Оптимальная оценка сердца достигается путем комбинации различных изображений, получаемых с разных точек. Это включает в себя парастернальный обзор вдоль длинной
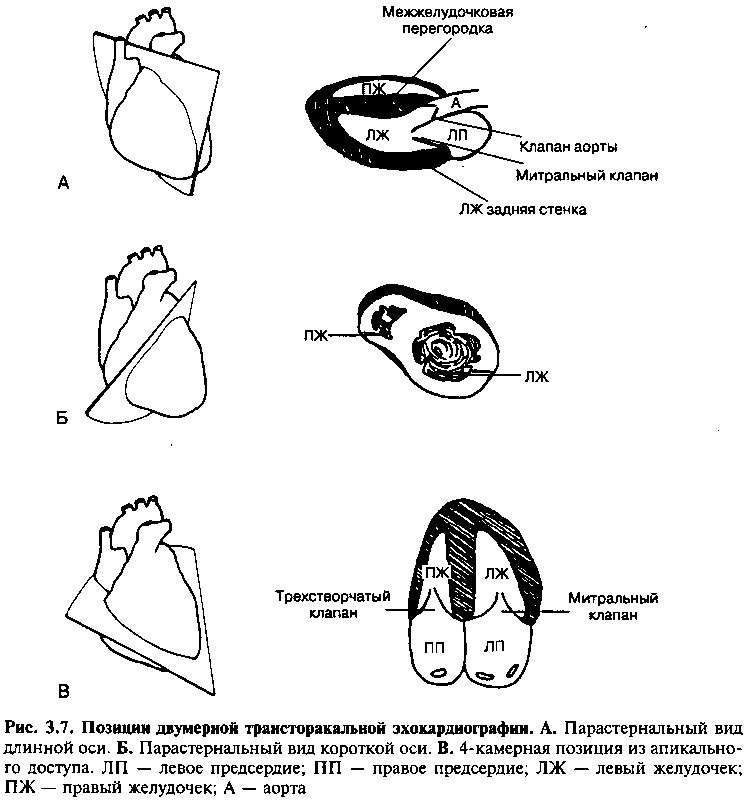
и короткой оси 4 камер сердца с верхушки сердца. При парастернальном доступе вдоль длинной оси датчик должен находиться в третьем или в четвертом межреберном промежутке слева от грудины. Этот доступ особенно полезен для оценки левого предсердия, митрального клапана, левого желудочка и выходного тракта левого желудочка, который включает в себя аортальный клапан и прилегающую внутрижелудочковую перегородку. Для получения парастернального изображения вдоль короткой оси датчик разворачивают на 90°. Такой доступ показывает поперечное сечение сердца.
Для получения изображения аортального и митрального клапанов, а также движения стенки левого желудочка, эхокардиограмма снимается с нескольких уровней. Сканирование из апикального доступа происходит, если датчик расположен у точки максимального сердечного толчка. При сканировании из апикального доступа четырехкамерный вид сердца позволяет оценить митральный и трехстворчатый клапаны, камеры желудочка и предсердия, включая движения латеральной, перегородочной и верхней стенки верхнего желудочка. Двухкамерный вид показывает только левые отделы сердца и описывает движение передней, нижней стенки и верхушки. Среди некоторых больных, например, у больных обструкцией дыхательных путей или ожирением, указанные выше виды не позволяют получить адекватное изображение сердечных структур, т. к. ультразвуковой сигнал ослабляется из-за увеличения толщины воздушного слоя или жировой ткани. При обследовании подобных больных используют субкостальный доступ: датчик устанавливается ниже реберной дуги, что дает более четкую картину четырех сердечных камер.
Доплеровская эхокардиография оценивает направление кровотока, его турбулентность и скорость, а также позволяет оценить значения градиентов давления внутри сердца и магистральных сосудов. Доплеровская диагностика основывается на том физическом принципе, что волны, отраженные от двигающегося объекта, претерпевают частотный сдвиг, который связан с относительной скоростью объекта. При цветном картировании кровотока используют произвольно выбранную цветовую шкалу, которая позволяет с помощью цвета полуколичественно оценить направление, скорость и турбулентность кровотока. Эти цвета затем накладываются на двумерную эхокардиограмму и показывают стенозы и регургитации клапанов, вне- и внутрисердечные шунты. Например, доплеровская эхокардиограмма, снятая у больного митральной регургитацией, показывает струю обратного кровотока в левое предсердие во время систолы (рис. 3.8).
Современные эхокардиографические аппараты автоматически преобразуют сдвиги звуковых частот в измеряемую скорость потока крови. Формула такова:
где V — скорость кровотока (м/с); fs — доплеровский частотный сдвиг (кГц), с — скорость звука в тканях тела (м/с); 0 — угол между звуковым импульсом и направлением кровотока; fQ — частота звука, исходящего от датчика (МГц).


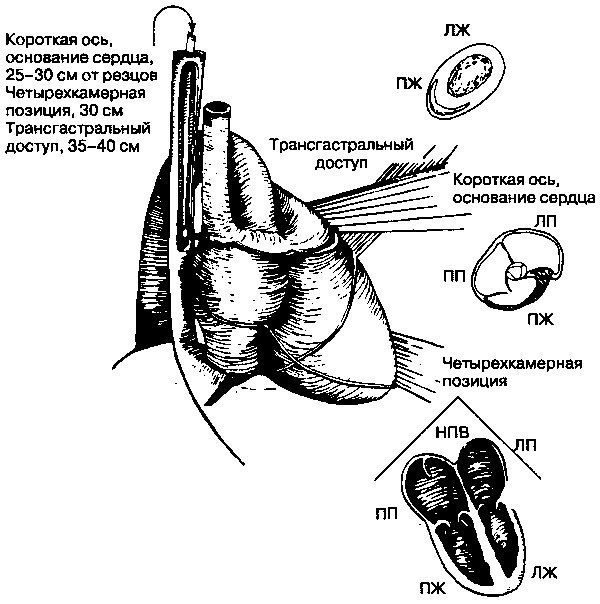
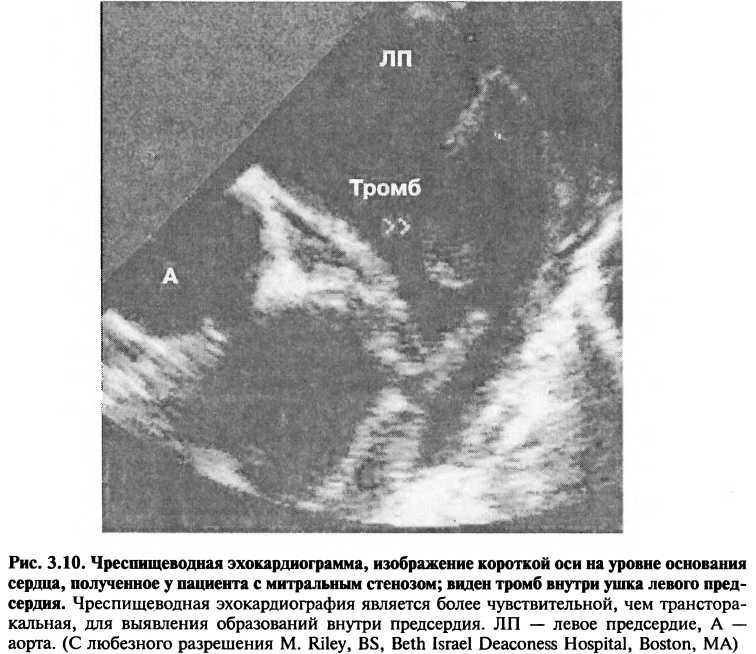
При чреспищеводной эхокардиографии используется миниатюрный датчик, который выдает и принимает ультразвук и расположен на конце модифицированного эндоскопа. Датчик, находясь в пищеводе, выдает при этом очень четкие изображения структур сердца и большей части грудного отдела (рис. 3.9). Благодаря технологическому прогрессу, сейчас создаются малые датчики, позволяющие делать двумерные и многомерные изображения, а также проводить доплеровское сканирование. Чреспищеводная эхокардиография особенно полезна при оценке аномалий предсердия и аорты, а также в тех условиях, когда трансторакальная эхокардиография дает нечеткие изображения. Например, чреспищеводная эхокардиография (ЧПЭ) — более чувствительный метод диагностики тромбов внутри ушка левого предсердия, чем трансторакальная эхокардиография (рис. 3.10). Близость пищевода к сердцу делает ЧПЭ-изобра-жения особенно необходимыми в том случае, когда трансторакальная эхокардиограмма является неудовлетворительной (например, у больных хронической обструктивной болезнью легких).
ЧПЭ также успешно применяется при обследовании больных с протезами сердечных клапанов. При стандартном трансторакальном сканировании искусственные механические клапаны отражают большие порции ультразвуковых волн, скрывая расположенные за ними части сердца. ЧПЭ помогает визуализировать расположенные за клапанами структуры и поэтому служит наиболее чувствительным методом диагностики око-локлапанной регуртации. ЧПЭ также используют при обследовании больных. с церебральной ишемией неясной этиологии, поскольку этот
Рис. 3.9. Позиции чреспищеводной эхокардиографии. ЛП — левое предсердие, ПП — правое предсердие, ЛЖ — левый желудочек, ПЖ — правый желудочек, НПВ — нижняя полая вена, А — аорта. (С любезного разрешения Jane Freedman, MD, Boston Universiti Medical Center, Boston, MA)
метод обладает высокой чувствительностью при выявлении источников эмболов в сердце и сосудах. Такими источниками могут служить внутрисердечные тромбы или опухоли, атеросклеротические бляшки в аорте и вегетации на клапанах сердца. ЧПЭ также является специфичным и чувствительным методом диагностики расслаивающей аневризмы аорты.
ЧПЭ часто используется в операционной. Во время операций она позволяет осуществлять мониторинг при восстановлении врожденных и клапанных повреждений. Вдобавок изображения движения стенок могут дать информацию о периодах ишемии миокарда при хирургических вмешательствах высокой степени риска.
Контрастная эхокардиография часто используется для оценки врожденных пороков сердца, так как является чувствительной при определении аномальных внутрисердечных шунтов. При применении этого метода в периферическую вену (обычно используется плечевая) быстро впрыскивается эхокардиографический контрастирующий раствор. Далее, при использовании обычных эхокардиографических методов, этот контрастирующий раствор визуализируется во время своего прохождения через сердечные ка-
меры. В норме наблюдается быстрое контрастирование правых камер, так как контрастирующий раствор вымывается из крови в легких и не достигает левых камер. При наличии внутрисердечного или внутрилегочного шунта контрастирующий раствор попадает в левые камеры сердца.
В настоящее время для исследования коронарных артерий и камер сердца используется внутрисосудистая эхокардиография. Достижения в данной области в сочетании с ангиопластикой улучшили понимание анатомии и патологии коронарных сосудов.
Эхокардиография способна обнаружить и дать количественную оценку степени тяжести пороков клапанов, осложнений при заболеваниях коронарных артерий, дефектов перегородок, внутрисердечных образований, кардиомиопатии, гипертрофии желудочка, заболеваний перикардия, заболеваний аорты и врожденных заболеваний сердца. Эхокардиографическая оценка включает определение размеров камер сердца, толщину его стенок и оценку характера их движения, функции клапанов, а также оценку параметров кровотока и внутрисердечной гемодинамики. Некоторые из этих понятий будут рассмотрены ниже.
Исследование желудочков
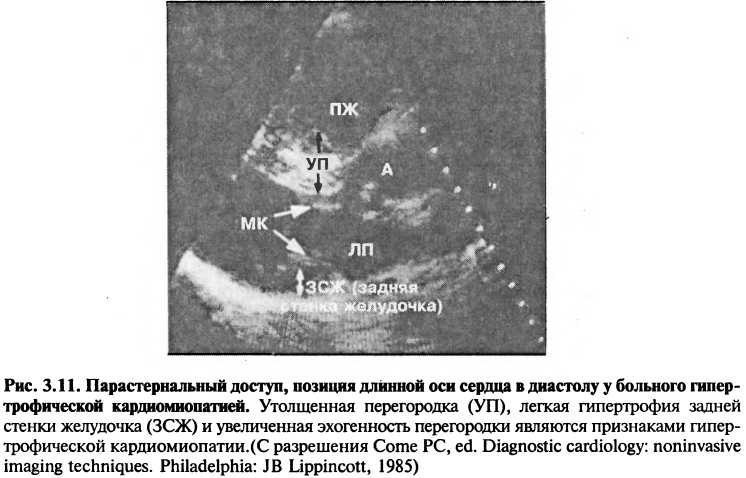
Двумерная эхокардиография оценивает систолическую функцию левого желудочка путем вычисления фракций выброса по величине конечно-диастолического и конечно-систолического размеров. Для оценки сократительной функции можно измерять ширину, площадь или объем левого желудочка. Двумерная эхокардиография может также отслеживать региональные аномалии движения стенок желудочка. Именно эти аномалии являются основными признаками ИБС. Функция правого желудочка обычно оценивается лишь качественно, так как правый желудочек имеет сложную геометрию, в отличие от левого желудочка. Двумерная эхокардиография также удобна для оценки массы и толщины стенок желудочка, что является важным фактором при обследовании больных с артериальной гипертензией, аортальным стенозом или гипертрофической кардиомиопатией (рис. 3.11).
Клапанные пороки
Эхокардиография приносит значительную пользу при оценке степени тяжести клапанных пороков сердца. С ее помощью могут быть обнаружены и оценены причины и степень тяжести определенных пороков (например, аортальный и митральный стенозы). Например, градиенты давления кровотока через стенозированные клапаны могут быть рассчитаны с помощью упрощенного уравнения Бернулли по величине максимальной скорости кровотока:
Градиент давления = 4 х v2
Так, если измеренное максимальное значение скорости равно 4 м/с, то максимальное значение градиента будет равно 64 мм рт. ст. Другие вычисления, выходящие за рамки рассмотрения данной книги, обеспечивают довольно точную оценку площадей аортального, митрального и трехстворчатого клапанов.
Ишемическая болезнь сердца (ИБС)
Двумерная эхокардиография может визуализировать аномалии во время движения стенок желудочка, которые ассоциируются с инфарктом или преходящей ишемией миокарда. Учитывая выраженность нарушений систолического сокращения и уменьшение систолической толщины стенок в систолу, можно оценить степень распространения инфаркта и выявить инфаркг-связанную коронарную артерию. Размеры инфаркта, полученные с помощью двумерной эхокардиографии, хорошо коррелируют с результатами других исследований, например сцинтиграфией миокарда с изотопом таллия, максимальной активностью креатинфосфокиназы в сыворотке и патологоанатомическими данными.
Эхокардиография также используется для обнаружения осложнений острого инфаркта миокарда, включающих в себя образование внутрижелудочковых тромбов, разрывы папиллярных мышц, дисфункции клапанов, разрыв межжелудочковой перегородки, образование аневризм и выпот в полости перикарда. Хотя эхокардиография и может выявить все эти последствия заболевания коронарной артерии, ее разрешающей способности нехватает для визуализации самих артерий.
Стресс-эхокардиография может быть использована для непрямой оценки степени тяжести ишемической болезни сердца даже при отсутствии инфаркта. Эта методика позволяет оценить региональные нарушения движений стенок левого желудочка, возникающие в результате физической нагрузки или введения специальных препаратов, таких как добута-мин и дипиридамол (см. главу 6). Обратимую ишемию миокарда можно распознать по развитию во время стресса аномалии движения стенок в области уменьшенного коронарного кровотока.
Кардиомиопатии
Кардиомиопатии — это заболевания миокарда, которые бывают трех типов: дилатационная, гипертрофическая и рестриктивная. Часто с помощью эхокардиографии удается различить эти три вида, а также оценить степень тяжести дисфункции миокарда. Например, на рис. 3.11 изображены утолщенные стенки желудочка, типичные для гипертрофической кардиомиопатии.
Заболевания перикарда
Двумерная эхокардиография позволяет обнаружить аномальные структуры в полости перикарда (например, увеличение нормального количества перикардиальной жидкости, нити фибрина, опухоли, сгустки). Тампонада и констриктивный перикардит, как основные функциональные последствия заболеваний перикарда, имеют характерные эхокардиографические признаки. При тампонаде увеличенное перикардиальное давление сдавливает камеры сердца, что приводит к циклическому «коллапсу» правого предсердия, правого желудочка и, иногда, левого предсердия (рис. 3.12).
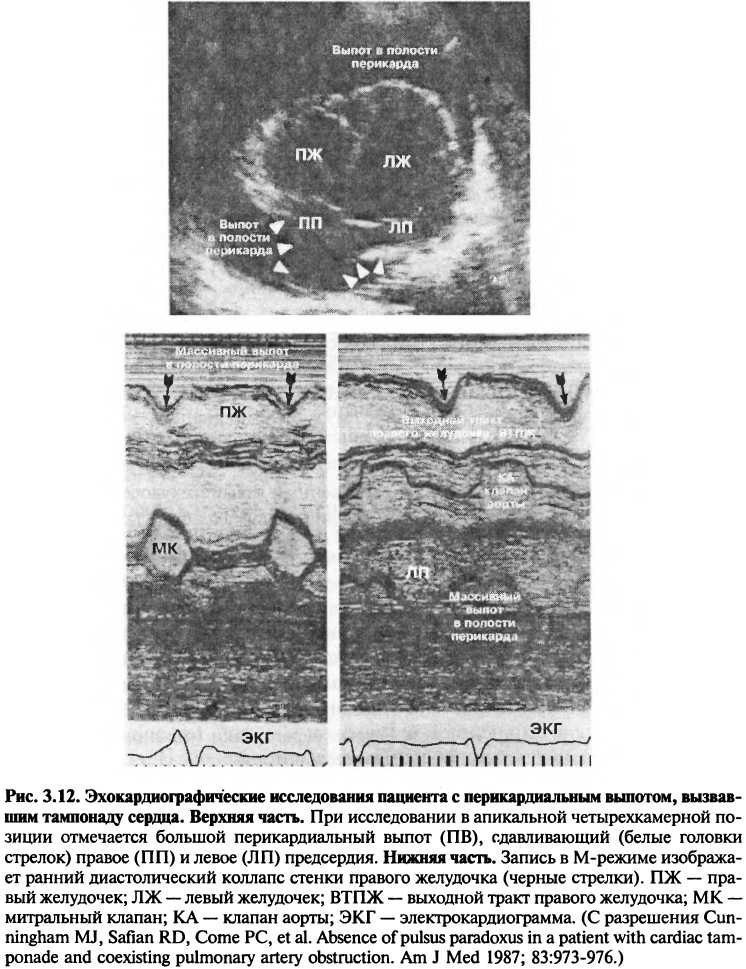
Констриктивный перикардит распознается по увеличенной толщине перикарда или по его увеличенной эхоконтрасности, а также по наличию аномалий в движении стенок левого желудочка в диастолу.
Таблица 3.2 подводит итог основным эхокардиографическим признакам распространенных сердечных заболеваний.

КАТЕТЕРИЗАЦИЯ СЕРДЦА
Внутрисосудистые катетеры используются в диагностике многих сердечно-сосудистых заболеваний для измерения давления в сердечных камерах, определения сердечного выброса и сопротивления сосудов, а также для введения рентгеноконтрастных материалов, необходимых для исследования структур сердца и параметров кровотока. В 1929 году Вернер Форссман провел на себе первую катетеризацию сердца и открыл эру инвазивной кардиологии. Многое из того, что на настоящий момент известно о патофизиологии пороков сердца, застойной сердечной недостаточности, пришло к нам после десятилетий гемодинамических исследований в лабораториях, занимающихся катетеризацией сердца.
Измерение давления
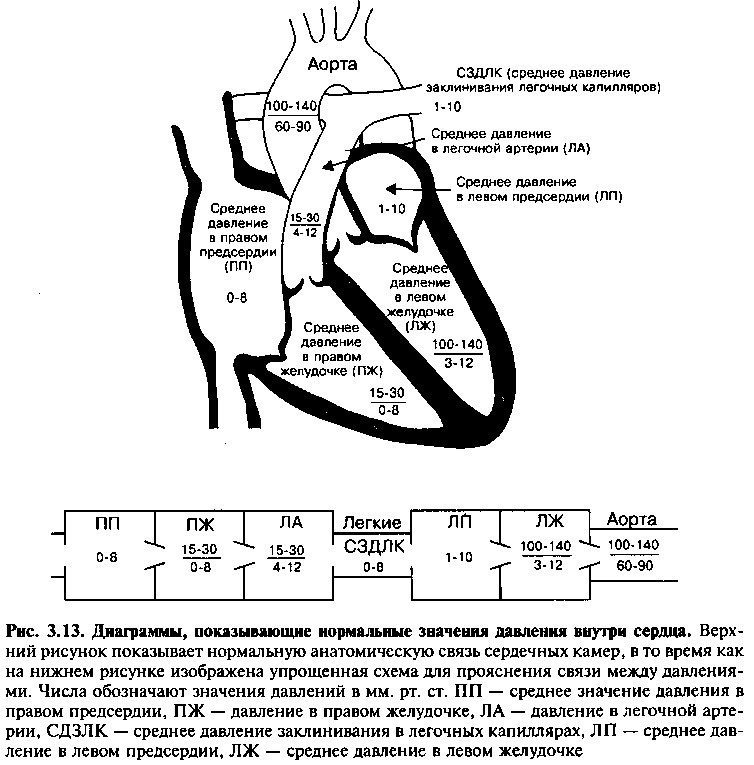
Перед вводом катетера в артерию или вену пациенту дают легкие седативные препараты и производят локальную анестезию места введения катетера. Катетер, присоединенный к датчику давления, который находится вне тела больного, вводится в соответствующий кровеносный сосуд. Для измерения давления в правом предсердии и желудочке, а также в легочной артерии, катетер обычно вводится в бедренную, плечевую или яремную вену. Давление в аорте и левом желудочке измеряется с помощью катетеров, введенных в плечевую или бедренную артерию. После введения в сосуд катетер направляется к месту измерения давления под рентгеновским контролем. Рис. 3.13 показывает нормальные значения давления внутри сердца. Измерение давления в правой части сердца обычно производится с помощью специализированного катетера с баллончиком в конце, который продвигается в правые камеры сердца током крови. Обычно катетер вводится с помощью пункции или венесекции периферической вены и затем направляется в сторону груди. Когда катетер достигает вены подходящего размера (нижней или верхней полой вен), баллон на кончике катетера раздувается, что делает возможным проникновение катетера в правую сторону сердца или легочную артерию.

ДАВЛЕНИЕ В ПРАВОМ ПРЕДСЕРДИИ
Давление в правом предсердии совпадает с центральным венозным давлением (которое оценивают по уровню давления в яремной вене при физическом обследовании пациента) из-за отсутствия клапанов, которые препятствовали бы возвращению крови в правое предсердие. В норме в дйастолу давление в правом предсердии равно давлению в правом желудочке, так как правая сторона сердца функционирует как общая камера, когда открыт трехстворчатый клапан. Среднее значение давления в правом предсердии понижается при уменьшении внутрисосудистого объема. Оно повышается при недостаточности правого желудочка, правосторонних клапанных пороках и сердечной тампонаде (при которой сердечные камеры окружены перикардиальной жидкостью под высоким давлением (см. главу 14).
Некоторые аномалии вызывают характерные изменения в отдельных компонентах давления в правом предсердии (и, как следствие, в яремных венах) (табл. 3.3).
Например, две основных причины выраженной волны «а» — это стеноз трехстворчатого клапана и гипертрофия правого желудочка. В этих условиях при сокращении правого предсердия ему приходится преодолевать сопротивление как со стороны стенозированного трехстворчатого клапана, так и жесткого правого желудочка. В результате образуется выраженная волна «а». Выраженная волна «V» наблюдается при недостаточности трехстворчатого клапана, так как нормальное наполнение правого предсердия нарушается обратным кровотоком.

ДАВЛЕНИЕ В ПРАВОМ ЖЕЛУДОЧКЕ
Систолическое давление в правом желудочке увеличивается при стенозе легочного клапана или при легочной гипертонии. Диастолическое давление в правом желудочке увеличивается, когда правый желудочек подвергается перегрузке давлением или объемом. Подобное увеличение давления может быть признаком правожелудочковой недостаточности.
ДАВЛЕНИЕ В ЛЕГОЧНОЙ АРТЕРИИ
Рост систолического и диастолического давления в легочной артерии происходит по трем основным причинам: 1) при левожелудочковой сердечной недостаточности, 2) при паренхиматозных заболеваниях легких (например, при хроническом бронхите или тяжелой эмфиземе) и 3) при заболеваниях легочных сосудов (например, при эмболии легочной артерии, первичной легочной гипертензии). В нормальных условиях диастолическое давление в легочной артерии совпадает с давлением в левом предсердии из-за малого сопротивления системы легочных сосудов, которые их разделяют. Если повышается давление в левом предсердии, например, из-за левожелудочковой сердечной недостаточности, то обязательно возрастает систолическое и диастолическое давление в легочной артерии для поддержания легочного кровотока. Такая ситуация приводит к «пассивной» легочной гипертонии.
Тем не менее, при некоторых условиях, системное сопротивление легочных сосудов становится ненормально большим, что проявляется в увеличенном диастолическом давлении в легочной артерии по сравнению с давлением в левом предсердии. В таком случае говорят об «активной» легочной гипертензии. Когда обструктивное заболевание легочных сосудов развивается как осложнение хронического сердечного шунта (например, дефекта межпредсердной или межжелудочковой перегородки), то такое заболевание называют синдромом Эйзенменгера.
ДАВЛЕНИЕ ЗАКЛИНИВАНИЯ В ЛЕГОЧНОЙ АРТЕРИИ
Если катетер направляется в правую или левую легочную артерию, его кончик в конечном счете достигает одной из малых ветвей легочной артерии и временно перекроет поток крови за ней. В течение этого времени образуется застойный столбик крови между кончиком катетера и частями капиллярной системы, а также отдаленными сегментами легочной венозной системы (рис. 3.14). Этот столбик крови действует как бы «продолжая» действие катетера, и давление, которое записывается через катетер, отражает давление внутри камеры — левом предсердии (ЛП). Это давление называется «давление заклинивания легочной артерии» или «давление заклинивания легочных капилляров (ДЗЛК)» и оно точно отражает
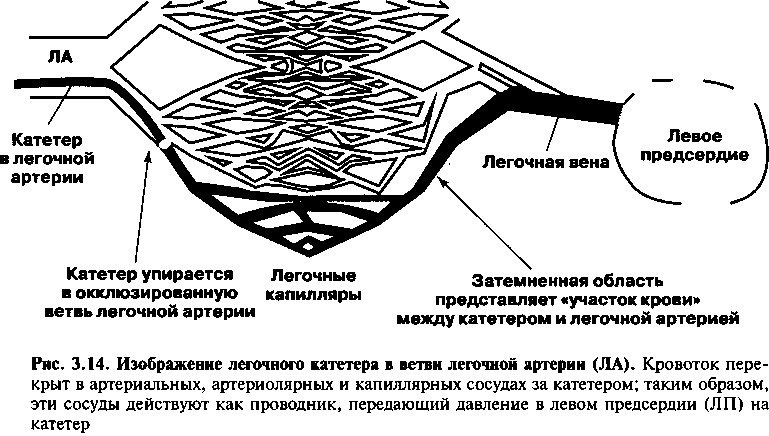
давление в левом предсердии у большого числа людей (следовательно, такое измерение давления эквивалентно измерению давления в левом предсердии, как это представлено на рис. 2.1). Кроме того, пока митральный клапан открыт во время диастолы, легочные вены, левое предсердие и левый желудочек имеют одинаковое давление. Таким образом, давление заклинивания легочных капилляров (ДЗЛК) используется также для оценки диастолического давления левого желудочка и для измерения преднагрузки желудочка (см. главу 9). Поэтому измерение ДЗЛК с использованием правосердечного катетера является ключевым моментом при мониторировании критически тяжелых больных в отделениях интенсивной терапии.
Оценка кровотока
Сердечный выброс обычно измеряется либо термодилюционным методом, либо методом Фика. Термодилюционный метод заключается в том, что физиологический раствор с известной температурой быстро вводят в правую сторону сердца через боковой катетер, причем расстояние от отверстия до кончика катетера составляет 30 см. Термистор, расположенный на кончике катетера, регистрирует температуру в легочной
артерии, которая временно изменяется из-за введенного раствора. Сердечный выброс рассчитывается автоматически, по кривой изменения температуры.
Часто используемый метод Фика основывается на том принципе, что количество потребленного тканями кислорода зависит от поглощения О2 при прохождении крови через капиллярное русло:
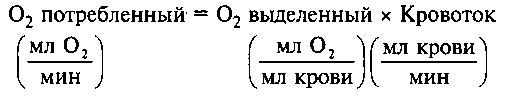

Или, иначе:
О2 потребленный = Артериовенозная разница О2 х Сердечный выброс, где артериовенозная разница О2 определяется как разность содержания кислорода в артериях и венах. Общее количество кислорода, потребляемого организмом (которое в нормальных условиях равно 125 + 25 мл О2/мин/м2), может быть определено по количеству выдыхаемого воздуха, а содержание кислорода в артериях и венах — из непосредственных анализов образцов крови. Исходя из этого, можно рассчитать сердечный выброс:
Например, если артериальная кровь у нормального взрослого человека содержит 190 мл О2/л, а венозная — 150 мл О2/л, то артериовенозная разница равна 40 мл О2/л. Если измеренное количество поглощенного кислорода для этого пациента составляет 200 мл/мин, то сердечный выброс составляет 5 л/мин. При многих сердечных заболеваниях сердечный выброс может падать ниже нормального уровня. В этой ситуации общее количество кислорода, потребляемого организмом, сильно не меняется; тем не менее из-за уменьшенного перфузионного давления ткани потребляют более высокий процент О2 на единицу объема циркулирующей крови. Это приводит к более низкому, чем в норме, венозному содержанию О2 и, следовательно, к увеличению артериовенозной разницы. В приведенном ранее примере, если венозная кровь содержит лишь 100 мл О2/л, то артериовенозная разница уменьшается до 90 мл О2/л, и рассчитанный сердечный выброс падает до 2,2 л/мин.
Измерение сосудистого сопротивления
После определения давления и сердечного выброса, легочное и системное сосудистое сопротивление могут быть рассчитаны по следующим формулам.
1) Сопротивление легочных сосудов:
где:
СЛС — сопротивление легочных сосудов (дин-с-см’5), СДЛА — среднее давление в легочной артерии (мм. рт. ст.), СДЛП — среднее давление в левом предсердии (мм рт. ст.), СВ — сердечный выброс (л/мин).
2) Системное сосудистое сопротивление:
где:
ССС — системное сосудистое сопротивление (дин-с-см’5), САД — среднее артериальное давление (мм рт. ст.), СДПП — среднее давление в правом предсердии (мм рт. ст.), СВ — сердечный выброс (л/мин).
Контрастная ангиография
Этот метод основан на введении при катетеризации контрастного материала для визуализации различных областей сердечно-сосудистой системы. Катетер вводится в соответствующий сосуд и продвигается под рентгеновским контролем к тому месту, куда будет впрыснут контраст. После введения контрастного вещества производится рентгенография. Один снймок дает одно изображение, а серия последовательных снимков обеспечивает «движущуюся картину», которая называется синеангиог-рамма.
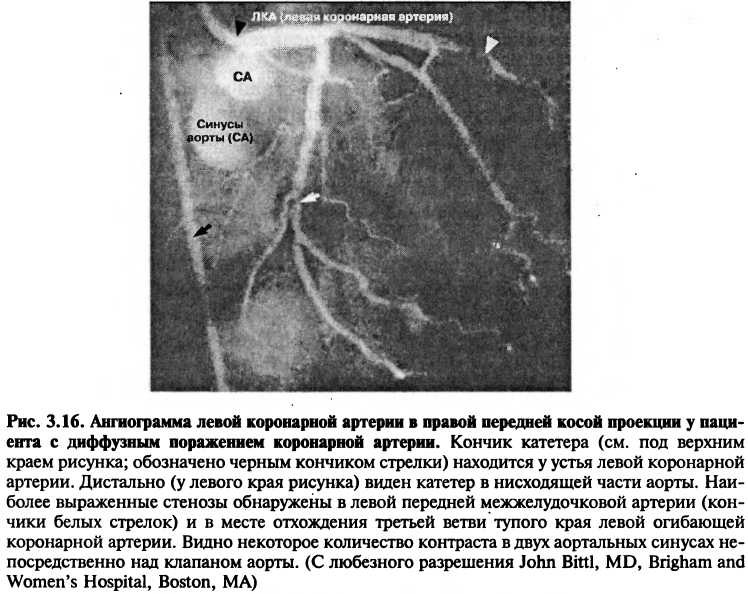
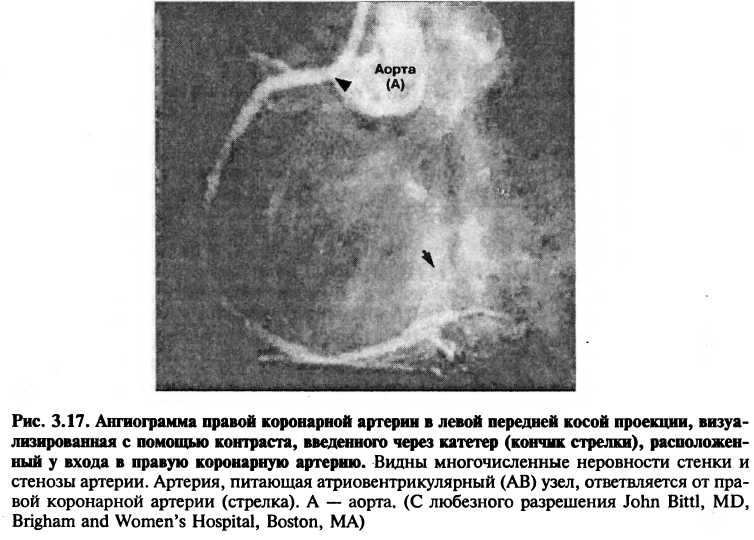
Селективное введение контрастного вещества в сердечные камеры используется для идентификации клапанной недостаточности, изучения толщины стенок, внутрисердечных шунтов, внутрисердечных тромбов, врожденных пороков, а также для измерения сократительной функции желудочка. Для изображения правых камер сердца контраст вводится через катетер, введенный в нижнюю или верхнюю полые вены, в правое предсердие или в правый желудочек. Для изображения левых отделов сердца контрастное вещество вводится через катетер, находящийся в левом желудочке (рис. 3.15). Введение контрастного вещества в коронарные артерии используется для исследования локализации и степени тяжести коронарного атеросклероза (рис. 3.16, рис. 3.17).
Для обеспечения четкого изображения при меньшем количестве контрастного вещества был разработан специальный вид контрастной ангиографии, называемый цифровой субтракционной ангиографией (ЦСАГ). При использовании этого метода компьютер обрабатывает цифровые рентгеновские снимки, исключая фон, создаваемый костями и мягкими тканями. Это увеличивает четкость изображения исследуемого сосуда или сердечной камеры, в которые был введен контраст. ЦСАГ имеет определенные преимущества перед традиционной ангиографией: она позволяет делать контрастные методы исследования менее инвазивными, что дает возможность использовать более мелкие катетеры, чем те, кото-
ССС = ( САД СДПП1 х 80
I СВ )

Использование катетеризации и контрастной ангиографии сопряжено с некоторым риском. Осложнения встречаются редко, однако они включают в себя перфорацию миокарда катетером, провокацию аритмий и нарушений проводимости, повреждение стенок сосудов, смещение атеросклеротических бляшек и возможное инфицирование больных. Контрастное вещество может вызывать анафилактические реакции или токсические почечные эффекты.
Таблица 3.4 суммирует данные о наиболее распространенных сердечных аномалиях, диагностируемых с помощью катетеризации. Терапевтические интервенционные методы, такие как чрескожная транслюминальная коронарная ангиопластика, обсуждаются в главе 6.
Таблица 3.4. Катетеризация сердца и ангиография при сердечных расстройствах
| Заболевания коронарных артерий | • Идентификация атеросклеротических повреждений |
| Митральная недостаточность | • Большая систолическая волна «V» при мониторировании давления в левом предсердии |
| Митральный стеноз | • Аномально высокий градиент давления между левым предсердием и желудочком во время диастолы |
| Недостаточность трехстворчатого клапана | • Большая систолическая волна «V» при мониторировании давления в правом предсердии |
| Аортальный стеноз | • Систолический градиент давления между левым желудочком и аортой |
| Застойная сердечная недостаточность |
|
ИЗОТОПНЫЕ ИССЛЕДОВАНИЯ
Функция сердца может быть оценена с использованием радиоактивных изотопов и детекторов гамма-излучения. Полученные изображения отображают распределение меченых атомов внутри сердечно-сосудистой системы. Изотопные методы используются для оценки перфузии миокарда, отображения прохождения потока крови через сердце и магистральные сосуды, для определения локализации и величины инфаркта и ишемии миокарда и для оценки метаболизма миокарда.
Оценка перфузии миокарда
При ишемической болезни сердца ишемия и инфаркт миокарда могут быть обнаружены с помощью двух изотопов, отображающих перфузию миокарда: с помощью таллия-201 (Т1-201) или сестамиби (синтетический изонитриловый комплекс, который носит аббревиатуру MIBI), меченного технецием 99т (Тс-99т). Эти реагенты одинаково чувствительны при выявления зон ишемизированного или рубцово-измененного миокарда. Однако каждый из них обладает определенными преимуществами. MIBI, например, дает более высокое качество изображения и является наилучшим для проведения детализованной ОФЭКТ (однофотонной эмиссионной компьютерной томографии). С другой стороны, определение степени жизнеспособности клеток миокарда лучше проводить с помощью Tl-201.
Для получения изображений с помощью таллия-201 радиоактивный изотоп вводится внутривенно, во время выполнения пациентом нагрузочной пробы на тредмиле или велоэргометре. Так как таллий является аналогом калия, то он включается в нормальные миоциты. Считают, что этот процесс управляется натриево-калиевым АТФ-зависимым насосом мембраны клетки. Внутриклеточная концентрация таллия, оцененная по плотности изображения, зависит от сосудистой проходимости (перфузии) и функции мембраны (жизнеспособности ткани). При нормальном сердце радионуклидное сканирование показывает гомогенное распределение таллия в тканях миокарда. И, наоборот, в отличие от нормальных тканей, области миокарда с рубцами (от предыдущих инфарктов) или с транзиторным снижением перфузии во время физических упражнений (ишемия миокарда) не накапливают в себе таллия. Следовательно, эти области будут выглядеть на экране как светлые или «холодные» пятна.
При оценке ишемии миокарда первичный цикл изображений производится сразу после нагрузки и инъекции таллия. Повторные снимки делаются несколько часов спустя, так как накопление таллия в миоцитах не постоянно. Напротив, наблюдается постоянное перераспределение изотопа через клеточную мембрану. После 3-х или 4-х часов перераспределения, когда получают добавочные снимки, все жизнеспособные миоциты должны обладать одинаковой концентрацией таллия. Следовательно, все дефекты, которые получаются из-за ишемии миокарда на первичных снимках, не сохраняются на отсроченных (вследствие этого они носят название «обратимые» дефекты). В то же время снимки инфарктного или рубцового миокарда останутся и на повторных снимках как «холодные» пятна.
Следует заметить, что некоторые сегменты миокарда, в которых постоянно наблюдаются Т1-201 дефекты как при первичных, так и при повторных снимках, иногда могут быть ложным образом охарактеризованы как нежизнеспособные, рубцовые ткани. Иногда эти области представляют собой ишемические, несокращающиеся, но метаболически активные области, у которых есть возможность вернуться к нормальной деятельности при восстановлении кровотока. Например, речь может идти о «спящем» миокарде, с пониженной сократительной функцией из-за хронического дефицита кровотока через коронарную артерию. Такие жизнеспособные зоны могут быть отдифференцированы от необратимо измененных областей миокарда путем повторного получения изображения после введения дополнительной дозы таллия-201 пациенту в состоянии покоя. В этом случае доля поглощаемого жизнеспособными тканями таллия-201 увеличивается (рис. 3.18).
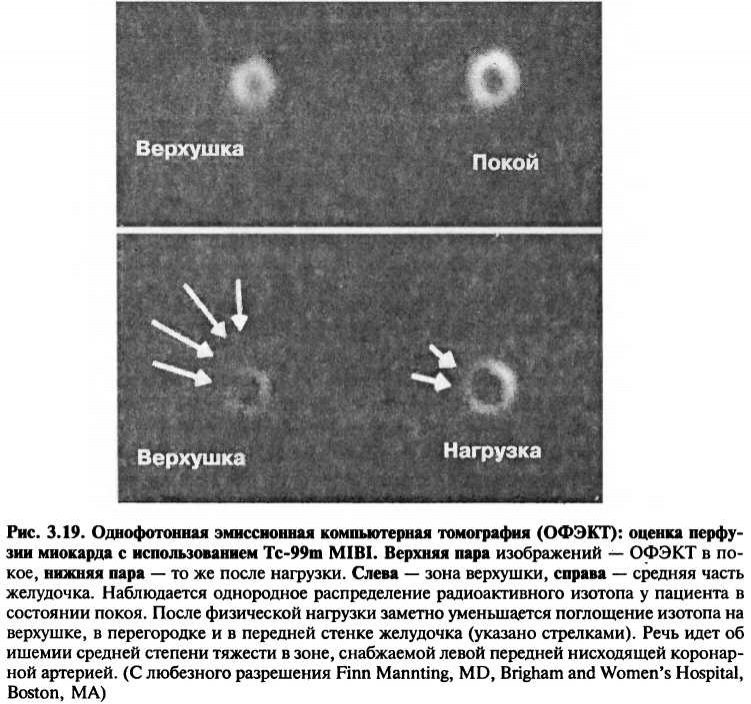
MIBI, меченный Тс-99т, представляет собой крупную липофильную молекулу, которая, как и таллий, абсорбируется миокардом пропорционально величине кровотока. Механизм поглощения отличается тем, что поглощаемый комплекс проходит сквозь мембрану миоцита пассивно, под воздействием отрицательного потенциала мембраны. Попав внутрь клетки, он накапливается в митохондриях под влиянием еще более отрицательного потенциала мембран митохондрий. Распределение MIBI в миокарде отображает перфузию в момент инъекции и, в отличие от таллия, это распределение остается постоянным внутри клеток. Следовательно, получение изображений с помощью MIBI может оказаться более удобным: между получением изображения при нагрузке и повторным снимком могут пройти сутки. Возможно также использование однодневного протокола, при котором введение MIBI и регистрация изображения проводят в покое после введения небольшой дозы радиоактивного вещества, а через два часа больному вводят большую дозу MIBI и проводят исследование с физической нагрузкой (рис. 3.19). Исследования при фи-
зических нагрузках как с использованием таллия-201, так и Тс-99ш, обладают более высокой чувствительностью и специфичностью (но являются более дорогостоящими), чем стандартные электрокардиографические пробы с нагрузкой для обнаружения транзиторной ишемии миокарда, обусловленной ишемической болезнью сердца. Таким образом, радионуклидные нагрузочные исследования оставляют на тот случай, когда результаты нагрузочной ЭКГ-пробы являются сомнительными или не подлежащими интерпретации из-за предшествующих ЭКГ аномалий.
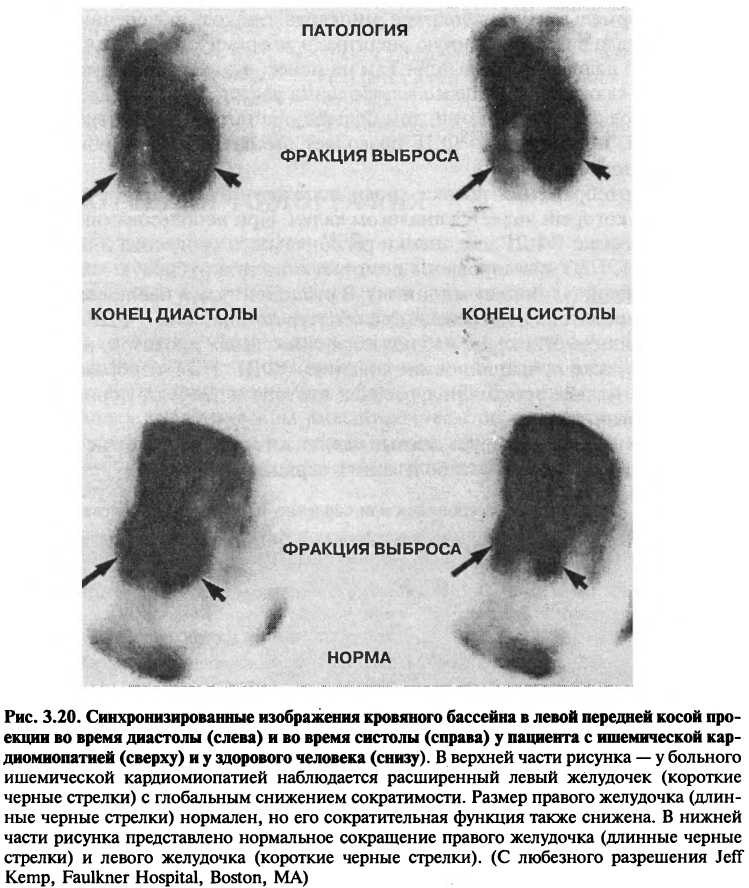
Изображение кровяного бассейна
Технеций-99т используется для получения изображения кровотока. Для того чтобы изотоп не выходил за пределы сосудистой системы, он фиксируется на эритроцитах или на альбумине сыворотки человека. После болюсного введения препарата технеция через определенные промежутки регистрируют его распределение по мере прохождения через сердце и магистральные сосуды. Для получения динамической картины кровотока используют последовательные изображения.
Изображение кровяного бассейна необходимо для исследования сократительной функции правого и левого желудочков (рис. 3.20). Для определения фракции выброса учитывают разность в радиоактивности в конце диастолы и систолы. Отсюда следует, что измерения в целом не зависят от геометрии желудочка. Вдобавок, изображения при первичном прохождении и синхронизация изображения при помощи электрокардиограммы позволяют идентифицировать аномальные шунты в сердце и сосудах.
Оценка степени повреждения тканей после острого инфаркта миокарда
Изотопы технеция-99т, присоединенные к пирофосфату, предпочтительным образом связываются с поврежденными или погибшими клетками миокарда и, вследствие этого, дают возможность выявлять зону недавнего инфаркта миокарда в виде ярких или «горячих» пятен. Такое исследование лучше всего проводить в течение 24—72 часов после инфаркта, так как за это время кальций, который связывается с пирофосфатом, оседает в необратимо поврежденных клетках. Через 4—5 дней, по мере образования рубца, кальций реабсорбируется и связывание технеция становится невозможным. Этот метод весьма полезен в случаях, когда обычные методы выявления острого инфаркта миокарда (ЭКГ и сердечные ферменты, как они описаны в главе 7), окажутся неубедительными.
Оценка метаболизма миокарда
Позитронная эмиссионная томография (ПЭТ) — это метод, который используется для изучения клеточного метаболизма и регионального
кровотока in vivo. Этот метод основан на использовании метаболитов, меченных испускающими позитроны изотопами (кислорода-15, углерода-11, азота-13 или фтора-18), и чувствительной позитронной камеры для обнаружения меченного изотопом объекта. Для изучения потребления глюкозы тканями миокарда используется фтор-18; он замещает водород в 2-деоксиглюкозе, образуя фтор-18-деоксиглюкозу, известную как 18ФДГ. Эта субстанция конкурирует с глюкозой в процессе транспортировки к миоцитам и последующего фосфорилирования. В отличие от глюкозы, 18ФДГ не подвергается дальнейшему расщеплению и остается в клетке. При нормальном метаболизме миокарда глюкоза обеспечивает только 20% вклада в произведенную энергию, в то время как свободные жирные кислоты дают остальные 80%. Тем не менее, в условиях ишемии миокарда доля глюкозы в процессе метаболизма растет, и чем более ткань миокарда подвержена ишемии, тем больше она потребляет глюкозы. Таким образом, поглощение 18ФДГ позволяет выявить ишемизированную, но жизнеспособную ткань.
Для отображения потока крови используют аммиак, меченный азотом-13, который является аналогом калия. При использовании этого изотопа вместе с 18ФДГ для оценки регионального кровотока и поглощения глюкозы, ПЭТ-сканирование помогает отличить рубцовую ткань от жизнеспособной («спящие» миоциты). В рубцовой ткани наблюдается уменьшение кровотока в поврежденной области поглощения 18ФДГ. Напротив, при «спящем» миокарде .наблюдается сниженный кровоток, но нормальное или даже повышенное поглощение 18ФДГ. ПЭТ-изображения ограничены малым сроком полураспада изотопа и требуют дорогостоящего оборудования.
Таблица 3.5 суммирует данные радиоизотопных методов исследования при распространенных заболеваниях сердца.

КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ
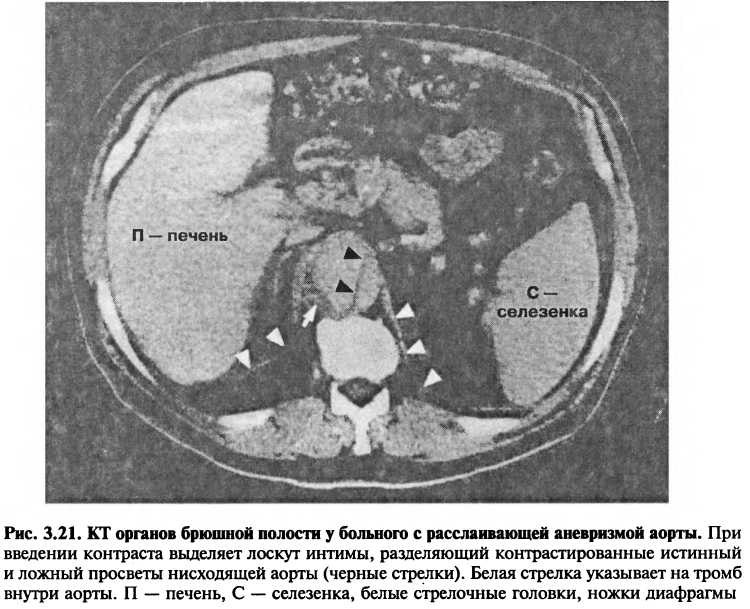
Компьютерная томография (КТ) использует рентгеновские лучи для получения изображения сердца в различных плоскостях. Стандартные методы КТ особенно удобны для оценки заболеваний перикарда и аорты (рис. 3.21). КТ позволяет выявить осумкованную жидкость в полости перикарда, не всегда обнаруживаемую при эхокардиографии. Этот метод исследования удобен при диагностике аневризм аорты и ее расслоения; он может быть использован для обследования больных, которые ранее подвергались хирургическим вмешательствам по поводу этих заболеваний. С помощью новейших модификаций КТ делаются попытки преодолеть влияние движения сердца на четкость изображения отдельных сердечных структур.

МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ (МРТ)
В основе метода лежит использование мощного магнитного поля для получения детальных изображений внутренних структур. МРТ предоставляет возможность чрезвычайно четкого изображения мягких тканей, в том числе сосудов и сердечных камер (рис. 3.22). Поэтому она может использоваться при множестве сердечно-сосудистых заболеваний. Так как МРТ позволяет получать томографические снимки в любой плоскости без ионизированных радиоактивных изотопов, область применения
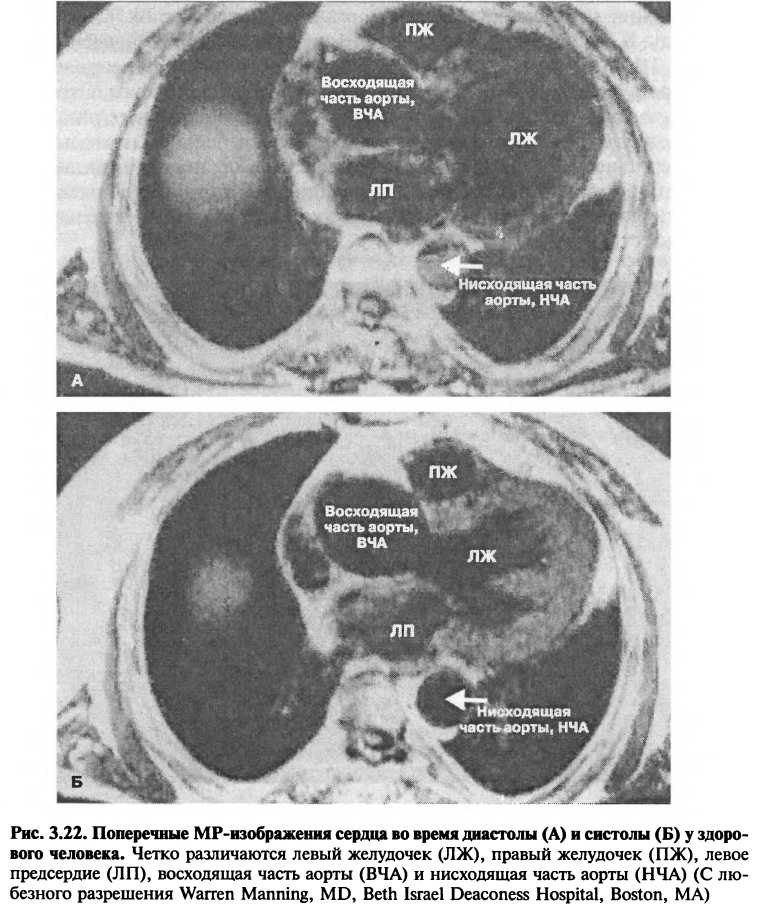
этого неинвазивного метода быстро расширяется. МРТ уже заняла достойное место в диагностике врожденных пороков сердца и заболеваний аорты, включая аневризмы и расслоения. Этот метод также используется для диагностики внутрисосудистых тромбов, опухолей, а также заболеваний перикарда. Последние разработки в области MPT-изображений позволяют проводить измерение потока крови, а также объема сердечных камер и массы желудочков. Клиническая роль этого метода визуализации сердечно-сосудистой системы определена далеко еще не полностью.
ЗАКЛЮЧЕНИЕ
В данной главе представлен обзор методов катетеризации и визуализации, которые в настоящее время используются для оценки структуры и функции сердца. Многие из этих методов являются дорогостоящими, хотя не превосходят другие методы по информативности. Тем не менее, их адекватное применение облегчает диагностику и лечение сердечно-сосудистых заболеваний. В таблицах 3.1—3.5 приведены наиболее распространенные показания к применению и результаты этих методов.