Основы строения и функции сердца (Патофизиология заболеваний сердечно-сосудистой системы - Лилли. Л.)
Знание нормальной структуры и функции сердца является основой для понимания заболеваний сердца. В этой главе представлен обзор основ анатомии и электрофизиологии сердца, а также механизмов, приводящих к сокращению сердца.
АНАТОМИЯ И ГИСТОЛОГИЯ СЕРДЦА
Хотя строение сердца изучается с древнейших времен, интерес к этой теме в наши дни возрастает. Развитие современных методов визуализации сердца, таких как коронарная ангиография, электрокардиография, компьютерная томография, магниторезонансная томография, дают сведения о пространственном расположении структур сердца. Такая информация важна для понимания патофизиологии заболеваний сердца. Особое внимание в этой главе уделяется аспектам анатомии сердца, имеющим значение для клиницистов, то есть «функциональной анатомии».
Перикард
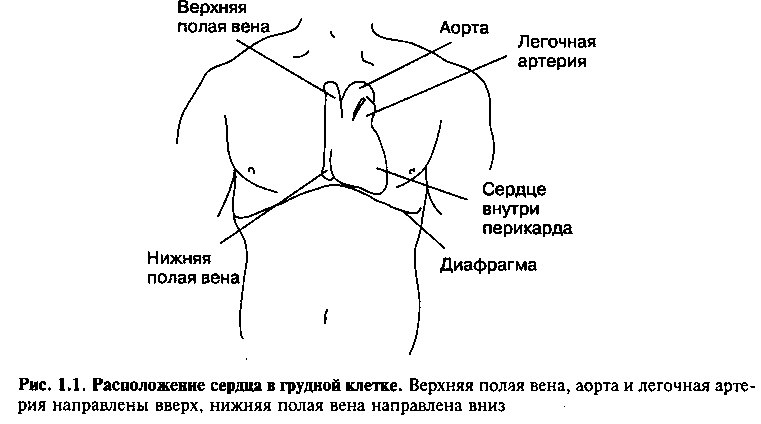
Сердце и корни больших сосудов сердца расположены в фиброзно-серозном мешке — перикарде (рис. 1.1). Перикард состоит из двух слоев: плотного наружного фиброзного слоя и внутреннего серозного слоя. Внутренний серозный слой покрывает наружную стенку сердца и называется висцеральным перикардом. Другой стороной он обращен к внутренней поверхности наружного фиброзного слоя, образуя париетальный перикард. Пространство между висцеральным и париетальным слоями содержит тонкую пленку перикардиальной жидкости, которая позволяет биться сердцу в условиях минимального трения.
Перикард прикрепляется с одной стороны — к грудине, с другой стороны — к правой и левой медиастинальной плевре. Связь перикарда с окружающими структурами способствует его прочной фиксации в грудной клетке и, таким образом, обеспечивает нормальную позицию сердца.
Выходящими из верхней части перикарда являются аорта, легочная артерия и верхняя полая вена (рис. 1.1). Внутренняя полая вена выходит из перикарда книзу.
Анатомия поверхности сердца
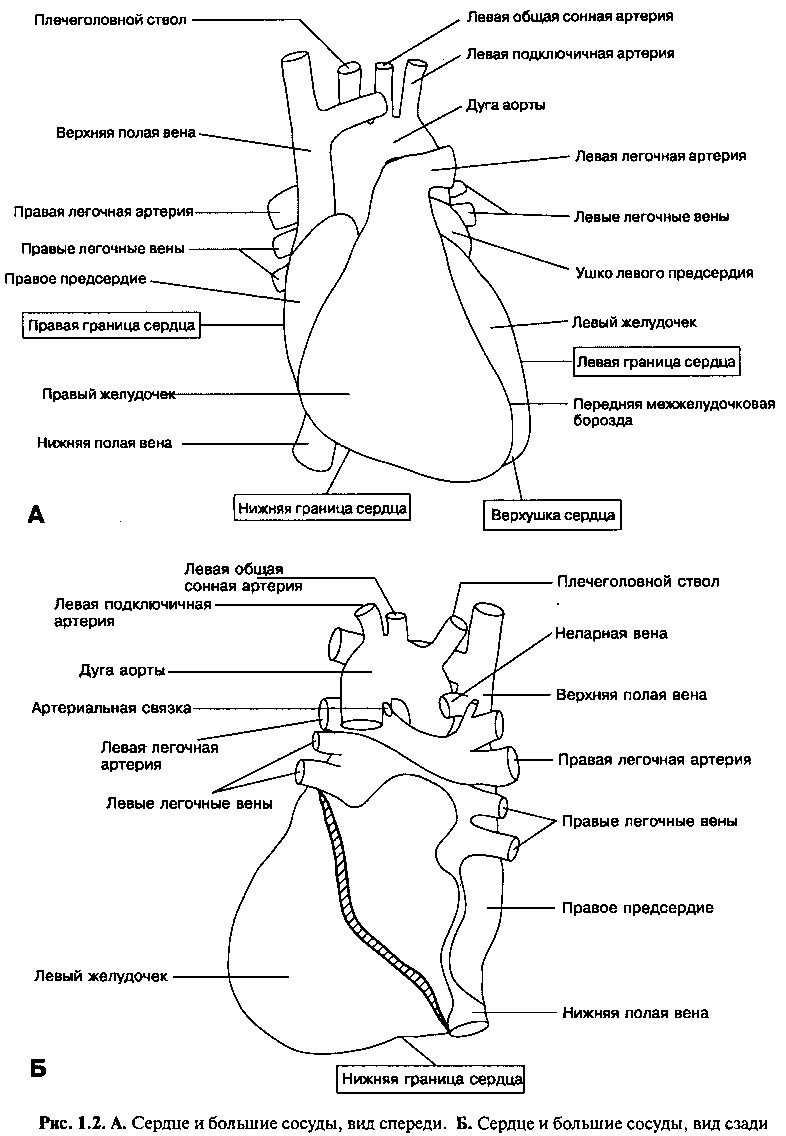
Сердце имеет форму конуса и состоит из четырех камер. Правый и левый желудочки сердца являются основными насосными камерами. Имеющие более тонкий мышечный слой правое и левое предсердия направляют кровь в соответствующие желудочки.
Для описания поверхности и тела сердца используют следующие термины (рис. 1.2). Верхушка формируется концом левого желудочка и направлена вниз, вперед и влево, а основание или задняя поверхность — предсердиями, главным образом левым, и расположено между воротами легких. Передняя поверхность сердца образована правыми предсердием и
желудочком. Так как левые предсердие и желудочек расположены больше кзади, они формируют только узкую полоску передней поверхности сердца. Нижняя поверхность сердца образована обоими желудочками, преимущественно левым. Эта часть сердца прилежит к диафрагме, поэтому ее считают «диафрагмальной» поверхностью.
При исследовании грудной клетки в переднезаднем виде (рентгенография грудной клетки) распознают четыре видимые границы сердца. Правая граница образована правым предсердием, и она всегда находится на линии верхней и нижней полой вены. Нижняя граница почти горизонтальная, она образована в основном правым желудочком и только вблизи верхушки — левым желудочком. Левый желудочек и часть левого предсердия образуют левую границу сердца, в то время как верхняя граница образована обоими предсердиями. Существуют два основных «правила» нормальной анатомии сердца: 1) правосторонние отделы сердца расположены в основном кпереди по отношению к левосторонним отделам и 2) камеры предсердий располагаются в основном справа от соответствующих им желудочков.
Внутреннее строение сердца
Внутри сердца имеются четыре основных клапана, которые обеспечивают движение крови вперед и предупреждают обратный ток крови. Предсердно-желудочковые клапаны (трехстворчатый и митральный) отделяют предсердия от желудочков, в то время как полулунные (легочный и аортальный) отделяют желудочки от крупных артерий. Все четыре клапана сердца прикрепляются к фиброзному скелету сердца (рис. 1.3). Остов сердца состоит из плотной соединительной ткани, служащей опорой для клапанов и мышц желудочков и предсердий.
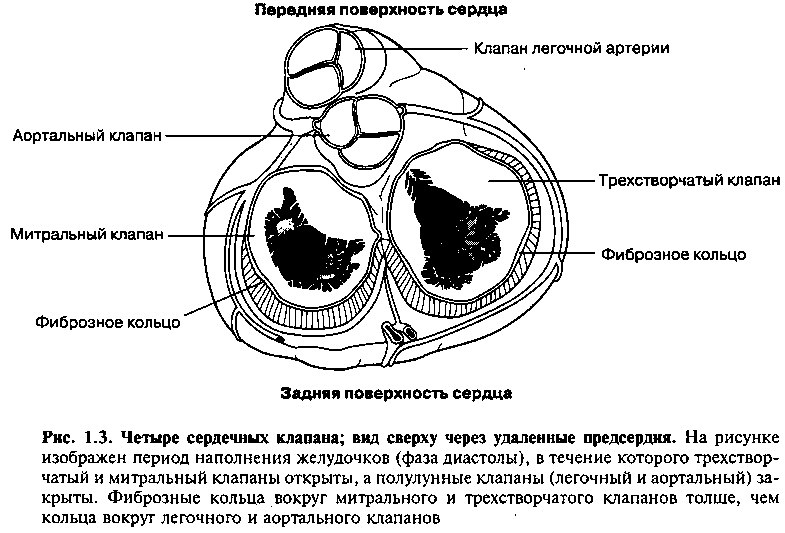
Поверхность клапанов и внутренняя поверхность камер сердца выстланы одним слоем эндотелиальных клеток, который называется эндокардом. Субэндокардиальная ткань содержит фибробласты, эластичные и коллагеновые волокна, вены, нервы, волокна проводящей системы, и продолжается соединительной тканью в мышечный слой сердца — миокард. Миокард — наиболее толстый слой сердца, который состоит из клеток мышцы сердца, гистология которых будет описана позже. Снаружи от миокарда находится слой соединительной и жировой ткани, покрывающий крупные сосуды сердца и нервы, которые проходят к мышечному слою сердца. Эпикард — наружный слой сердца — это другое название описанного ранее висцерального перикарда.
ПРАВОЕ ПРЕДСЕРДИЕ И ЖЕЛУДОЧЕК
Верхняя и нижняя полые вены, коронарный синус впадают в правое предсердие (рис. 1.4). Полые вены возвращают венозную кровь из системных вен в правое предсердие, а коронарный синус возвращает туда же кровь из коронарных артерий. Межпредсердная перегородка формирует заднюю стенку правого предсердия и отделяет его от левого предсердия. Трехстворчатый клапан расположен на дне предсердия и открывается в полость правого желудочка. Правый желудочек (рис. 1.4) имеет треугольную форму, и его верхняя часть образует конусообразный выходной тракт, продолжением которого является легочная артерия. Несмотря на то, что внутренняя поверхность выходного тракта гладкая, остальная часть желудочка
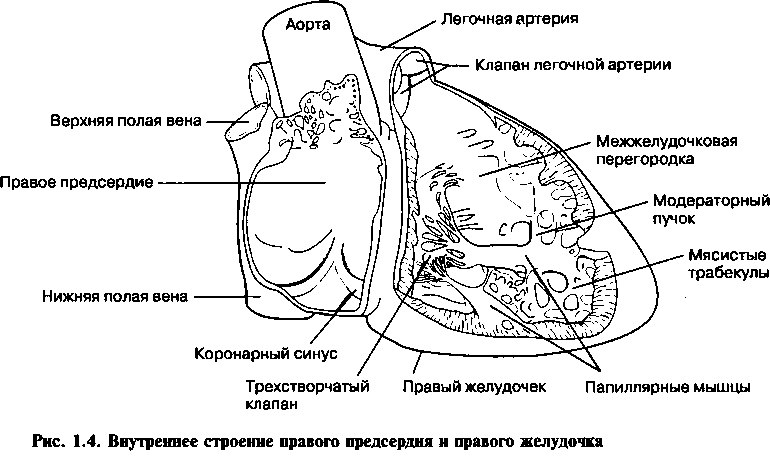
покрыта сетью беспорядочно расположенных мышечных пучков (называемых трабекулами), которые образуют губчатую поверхность стенки правого желудочка. Большая трабекула, проходящая через полость желудочка, называется модераторным пучком и содержит компоненты, проводящие возбуждение из правой ножки пучка Гиса к мышце желудочка.
Правый желудочек имеет три папиллярные мышцы, которые направлены внутрь его полости и с помощью тонких, нитевидных сухожильных нитей прикрепляются к краю створок трехстворчатого клапана. Створки клапана, в свою очередь, прикрепляются к фиброзному кольцу, удерживающему клапан между правым предсердием и желудочком. Сокращение желудочка начинается с сокращения папиллярных мышц, при этом сухожилия папиллярных мышц натягиваются, и створки трехстворчатого клапана смыкаются. При сокращении желудочка это предупреждает обратный ток крови из желудочка в правое предсердие.
На выходе из правого желудочка расположен легочный клапан, через который кровь попадает в легочную артерию. Этот клапан состоит из трех створок, которые прикрепляются к фиброзному кольцу. Во время расслабления желудочка эластическая тяга легочных артерий направляет кровь обратно к сердцу, что вызывает движение створок клапана по направлению друг к другу. Это приводит к закрытию клапана легочной артерии и предупреждает обратный ток крови в правый желудочек.
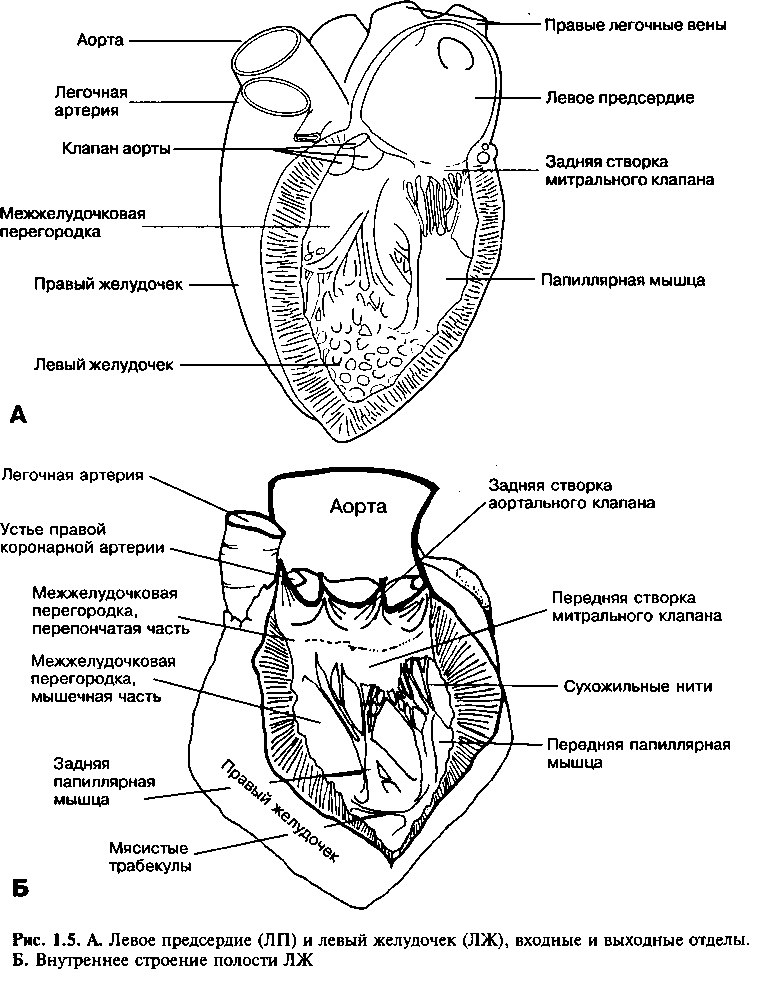
ЛЕВОЕ ПРЕДСЕРДИЕ И ЛЕВЫЙ ЖЕЛУДОЧЕК
В заднюю половину левого предсердия впадают четыре легочные вены (рис. 1.5А). Толщина стенки левого предсердия составляет около 2 мм, и она немного толще, чем стенка правого предсердия. Митральный клапан открывается внутрь левого желудочка непосредственно из нижней части стенки левого предсердия.
Полость левого желудочка приближается к конусообразной форме и несколько длиннее, чем полость правого желудочка. Толщина стенки левого желудочка у взрослых здоровых людей составляет 9—11 мм, почти в 3 раза толще стенки правого желудочка. Преддверием аорты является гладкостенная часть полости левого желудочка, которая располагается непосредственно под клапаном аорты. Ниже этого места большая часть желудочка покрыта трабекулами, более мелкими и многочисленными, чем в правом желудочке.
Полость левого желудочка (рис. 1.5Б) имеет две большие папиллярные мышцы. Они больше аналогичных мышц правого желудочка, их сухожильные нити более толстые, хотя их число меньше, чем в правом желудочке. Сухожильные нити каждой папиллярной мышцы распределены между двумя створками митрального клапана. Так же как и при сокращении мышцы правого желудочка, натяжение сухожилий во время сокращения левого желудочка помогает створкам митрального клапана плотно примыкать друг другу и тем самым предупреждать обратный ток крови.
Аортальный клапан отделяет левый желудочек от аорты. Вокруг клапана аорты — фиброзное кольцо, к которому прикреплены три створки клапана. Непосредственно над правой и левой створками клапанов аорты в стенке аорты берут начало правая и левая коронарные артерии (рис. 1.5Б).
МЕЖЖЕЛУДОЧКОВАЯ ПЕРЕГОРОДКА
Межжелудочковая перегородка — толстая стенка между правым и левым желудочками. Она состоит из мышечной и мембранозной части (рис. 1.5Б). На наружной поверхности сердца местам прикрепления межжелудочковой перегородки соответствуют передняя и задняя межжелудочковые борозды. Вследствие более высокого гидростатического давления в левом желудочке, мышечная часть перегородки выпячивается в полость правого желудочка. Маленькая, овальной формы мембранозная часть перегородки — тонка и расположена непосредственно под створками клапана аорты.
Для того чтобы обобщить функционально-анатомические данные, представленные в этом разделе, проведем обзор тока крови через сердце. Венозная кровь попадает в сердце через нижнюю и верхнюю полые вены, впадающие в правое предсердие. Затем кровь через трехстворчатый клапан попадает в правый желудочек. При сокращении правого желудочка кровь через клапан легочной артерии попадает в легочную артерию и легкие, где происходит газообмен; кровь теряет углекислый газ и насыщается кислородом. Обогащенная кислородом кровь возвращается в сердце через легочные вены в левое предсердие и затем, проходя через митральный клапан, попадает в левый желудочек. При сокращении левого желудочка, обогащенная кислородом кровь через аортальный клапан попадает в аорту, затем она доставляется ко всем другим органам и тканям организма.
Проводящая система сердца
Проводящая система сердца (рис. 1.6) состоит из специализированных клеток, которые инициируют сердцебиение и координируют сокращение камер сердца. Синоатриальный (СА) узел — это небольшая масса
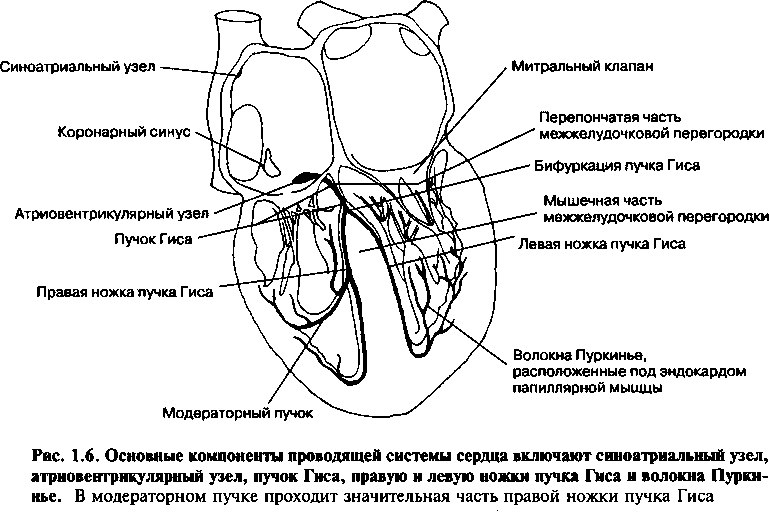
специализированных мышечных волокон сердца, которая находится в стенке правого предсердия. Она расположена справа от места впадения верхней полой вены и, в норме, вырабатывает электрический импульс для сокращения. Атриовентрикулярный (АВ) узел находится под эндокардом в нижнезадней части межпредсердной перегородки. От АВ узла отходит пучок Гиса, который проходит через межжелудочковую перегородку кзади. Внутри перегородки пучок Гиса разделяется на широкую сеть волокон, которые проходят по левой части перегородки — левую ножку пучка Гиса, и на компактную часть, в виде провода, идущего по правой стороне — правую ножку пучка Гиса.
Правая ножка пучка Гиса — толстая, глубоко проникает в мышечную часть межжелудочковой перегородки и продолжается до верхушки сердца. Недалеко от места соединения межжелудочковой перегородки и передней стенки правого желудочка правая ножка пучка Гиса располагается под эндокардом и делится на две ветви. Одна ветвь проходит через полость правого желудочка в составе модераторного пучка, тогда как другая продолжается до конца желудочка. Эти ветви в конце разветвляются на тонкую сеть, богатую анастомозами, охватывающую весь правый желудочек.
Функционально, левый пучок Гиса разделен на переднюю и заднюю ветви и на небольшую ветвь, идущую к перегородке. Передняя ветвь проходит кпереди, к верхушке, образуя при этом субъэндокардиальное сплетение в области передней папиллярной мышцы. Задняя ветвь, достигнув задней папиллярной мышцы, разветвляется, образуя субъэндокардиальное сплетение, после чего простирается по оставшейся части левого желудочка.
От субъэднокардиальных сплетений обоих желудочков отходят волокна Пуркинье, которые проникают в мышцу желудочков. Импульсы, которые образуются в системе Пуркинье-Гиса, сначала передаются к папиллярным мышцам, а затем — к стенкам желудочков. Благодаря такой последовательности, папиллярные мышцы сокращаются первыми, после чего начинается сокращение желудочков. Как уже объяснялось ранее, такая координация последовательности сокращения предупреждает обратный ток крови через предсердно-желудочковые клапаны.
Иннервация сердца
Нервная система сердца представлена симпатическими и парасимпатическими афферентными и эфферентными нервными волокнами. Преганглионарные симпатические нервные волокна расположены между верхними 5-м и 6-м грудными сегментами спинного мозга и соединяются с нейронами второго порядка шейных симпатических узлов. В составе сердечных нервов эти волокна оканчиваются в сердце и крупных сосудах. Преганглионарные парасимпатические волокна начинаются в задних двигательных ядрах мозжечка и в составе ветвей блуждающего нерва достигают сердца и крупных сосудов. Здесь волокна образуют синапсы с нейронами второго порядка, расположенными в ганглиях внутри этих же образований. Богатое снабжение афферентными волокнами блуждающего нерва передней и задней поверхности желудочков обусловливает формирование важных сердечных рефлексов, в то время как обилие эфферентных волокон блуждающего нерва, направленных к СА и АВ узлам, позволяет регулировать выработку и проведение электрического импульса.
Сосуды сердца
Сосуды сердца представлены артериями, венами и лимфатическими сосудами. Главные составляющие этих систем заключены в рыхлую соединительную ткань жирового слоя эпикарда.
АРТЕРИИ СЕРДЦА
Сердечная мышца снабжается кислородом и питательными веществами из правой и левой коронарных артерий, которые отходят от ворот аорты, непосредственно над створками клапана аорты (рис. 1.5Б, 1.7). После своего начала эти сосуды проходят вперед, охватывая обе стороны легочной артерии (рис. 1.7).
Крупный ствол левой коронарной артерии проходит между левым предсердием и легочным стволом и достигает предсердно-желудочковой борозды. Здесь происходит его деление на переднюю межжелудочковую артерию (ПМЖА) и огибающую артерию. ПМЖА проходит в передней
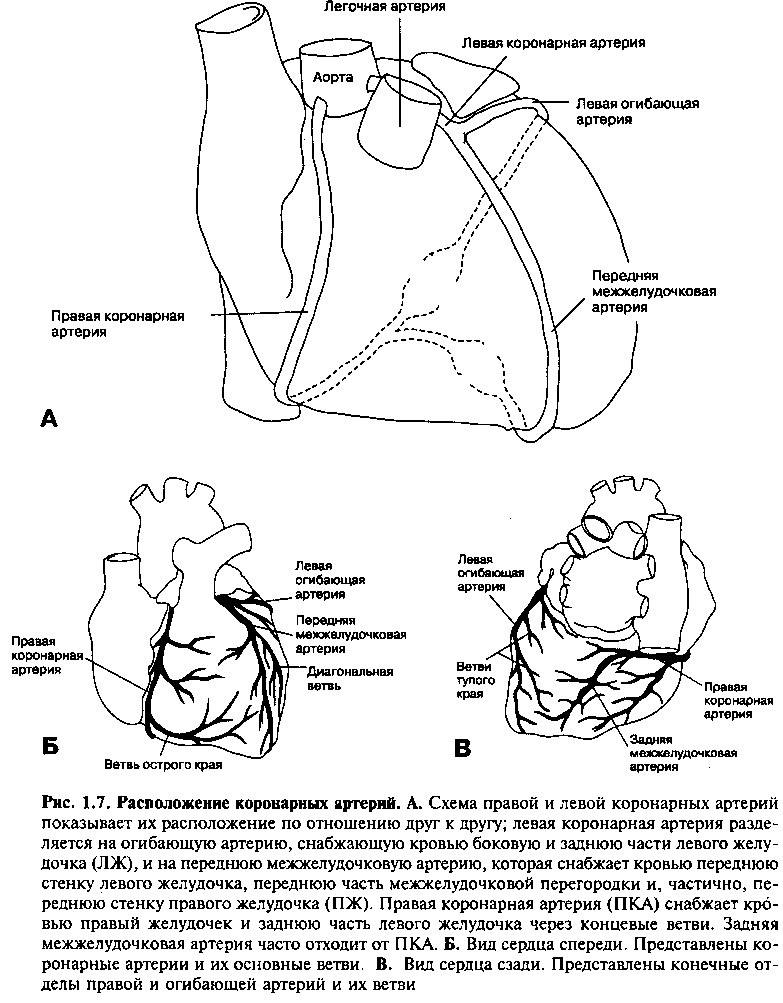
межжелудочковой борозде по направлению к верхушке сердца. В процессе прохождения по передней поверхности ПМЖА дает ветви, снабжающие кровью передние две трети межжелудочковой перегородки и верхушечную часть передней папиллярной мышцы. ПМЖА также дает диагональные ветви, которые снабжают кровью переднюю поверхность левого желудочка. Огибающая артерия проходит в левой предсердно-желудочковой борозде и, огибая левую границу сердца, достигает ее задней поверхности. По ходу она разветвляется на множество краевых ветвей, которые снабжают кровью боковую и заднюю части стенки левого желудочка.
Правая коронарная артерия (ПКА) проходит спереди назад в правой предсердно-желудочковой борозде, между правым предсердием и желудочком. Она снабжает кровью правый желудочек посредством ветвей острого края. У большинства людей от конечной части ПКА отходит большая ветвь — задняя межжелудочковая артерия (рис. 1.7В). Эта артерия проходит по нижнезадней поверхности, достигая верхушки сердца; она снабжает кровью нижнюю и заднюю стенки желудочков и заднюю треть межжелудочковой перегородки. До того, как от ПКА отходит задняя межжелудочковая ветвь, отходит другая ветвь — артерия АВ узла.
У 85% людей задняя межжелудочковая артерия и артерия АВ узла отходят от правой коронарной артерии. Приблизительно у 8% людей задняя межжелудочковая артерия отходит от огибающей артерии. У остальных людей кровь для задней поверхности сердца доставляется ветвями, отходящими как от правой коронарной, так и огибающей артерий.
Синоатриальный узел большей частью снабжается кровью из правой коронарной артерии (в 70%). Однако в 25% случаев у здоровых людей артерия СА-узла отходит от огибающей артерии, а в 5% случаев — одновременно от ПКА и огибающей артерий.
Выходя из эпикарда, ветви коронарных артерий проникают в мышцы желудочков, образуя при этом богатую сеть анастомозирующих между собой мелких сосудов в стенках всех камер сердца. От них отходит огромное количество капилляров, образующих сеть вокруг каждого мышечного волокна сердца. Мышечные волокна, расположенные непосредственно под эндокардом, в основном, в области папиллярных мышц и толстой стенки левого желудочка, снабжаются кровью одновременно из конечных ветвей коронарных артерий и из полости желудочка через тонкие сосуды, называемые тебезиевыми венами.
Между коронарными артериями на субартериолярном уровне имеются коллатеральные соединения диаметром обычно менее 200 нм. В здоровом сердце можно видеть небольшое число таких коллатеральных сосудов. Однако при атеросклеротическом поражении коронарной артерии они могут увеличиваться в размерах и обеспечивать кровью сосуды, расположенные ниже места обструкции.
ВЕНЫ СЕРДЦА
Коронарные вены следуют по ходу больших коронарных артерий. Эти сосуды возвращают кровь из капилляров миокарда в правое предсердие, в основном, проходя через коронарный синус. Крупные вены располагаются поверх коронарных артерий в эпикардиальной жировой ткани. Тебезиевые вены, упоминавшиеся раннее, обеспечивают дополнительный возможный путь для прямого возврата небольшой порции крови в камеры сердца.
ЛИМФАТИЧЕСКИЕ СОСУДЫ СЕРДЦА
Лимфатическая система — это обширное сплетение сосудов, снабженных клапанами, которые расположены в субэндокардиальной соединительной ткани всех четырех камер сердца. Лимфа собирается в эпикардиальное сплетение лимфатических сосудов, расположенное в интерстициальной соединительной ткани. Соединяясь, эти маленькие сосуды образуют несколько больших лимфатических сосудов, которые следуют по ходу коронарных артерий и вен. Эти крупные сосуды сливаются в предсердно-желудочковой борозде, образуя большой лимфатический сосуд, который выходит из сердца и впадает в лимфатическое сплетение средостения, а затем в грудной лимфатический проток.
Гистология клеток миокарда желудочков
Зрелая клетка миокарда (она также называется кардиомиоцитом) имеет размер до 25 нм в диаметре и 100 нм в длину. Клетка имеет поперечно-полосатую исчерченность подобно клетке скелетной мышцы. Однако, в противоположность многоядерным скелетным миофибрилам, кардиомиоциты имеют одно или два ядра, расположенных в центре клетки. Вокруг каждого кардиомиоцита присутствует соединительная ткань, богатая сетью капилляров.
Каждая миокардиальная клетка содержит некоторое количество миофибрилл, которые представляют собой длинные цепи индивидуальных саркомеров — основных сократительных единиц клетки (рис. 1.8). Каждый саркомер состоит из двух групп частично перекрывающихся филаментов (нитевидные структуры, различимые при больших увеличениях микроскопа), образованных сократительными белками. Биохимическое и биофизическое взаимодействие между миофиламентами приводит к мышечному сокращению. Структура и функции филаментов будут описаны в этой главе позже.
Внутри каждой миокардиальной клетки соседние саркомеры расположены последовательно, это обеспечивает характерную поперечно-полосатую исчерченность при световой микроскопии. Относительная плотность поперечных полос определяет локализацию сократительных белков, расположенных внутри саркомера. В обычном физиологическом состоянии общая длина саркомера (расстояние между Z и Z) во время сердечного цикла варьирует между 2,2 и 1,5 нм. Наибольший размер отражает степень растяжения волокна при заполнении желудочков, в то время как наименьший размер отражает степень укорочения волокна во время сокращения.
Мембрана миокардиальных клеток называется сарколеммой. Особый участок мембраны представлен вставочным диском — это отличительная характеристика ткани сердечной мышцы. Вставочные диски через обычный микроскоп видны как темно окрашенные поперечные линии, которые через неравномерные промежутки пересекают цепочки сердечных
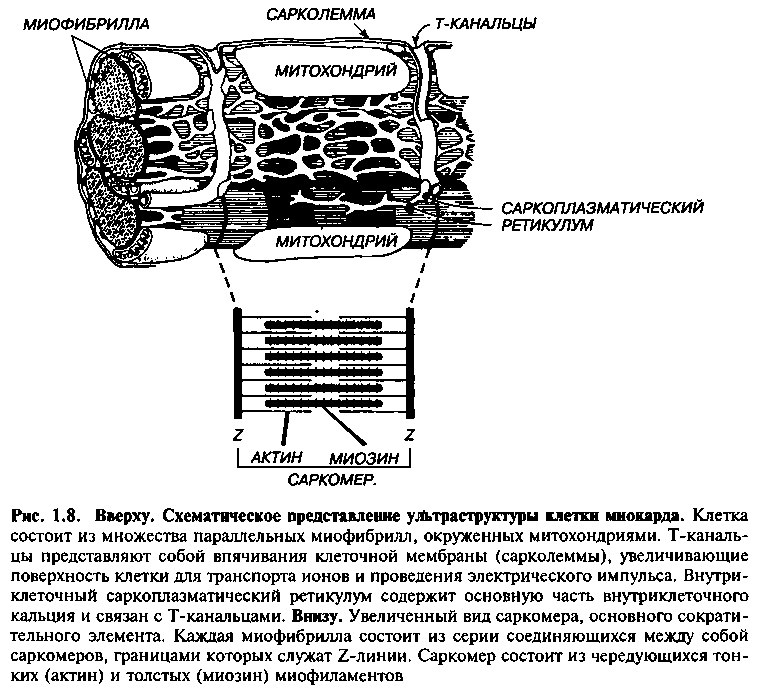
клеток. Диски представляют сложные мостики, соединяющие соседние волокна сердца, образуя структурную и электрическую непрерывную связь между клетками миокарда.
Другой функциональной особенностью мембраны клеток является система поперечных канальцев (или Т-канальцы). Это сложная система, которая характеризуется глубокими, пальцевидными впячиваниями сарколеммы (рис. 1.8, 1.9). Подобно вставочным дискам, мембраны поперечных канальцев образуют пути быстрой передачи импульсов электрического возбуждения, которые инициируют сокращение. Система Т-канальцев увеличивает область поверхности сарколеммы для контакта с внеклеточной средой, обеспечивая быстрый и синхронный трансмембранный транспорт ионов в процессе возбуждения и сокращения.
Саркоплазматический ретикулум представляет собой обширную внутриклеточную сеть мембранных канальцев, которая структурно и функционально объединена с Т-канальцевой системой. Боковые мешочки саркоплазматического ретикулума (называемые терминальными цистернами) под прямым углом присоединяются к Т-канальцам (рис. 1.9). Эти
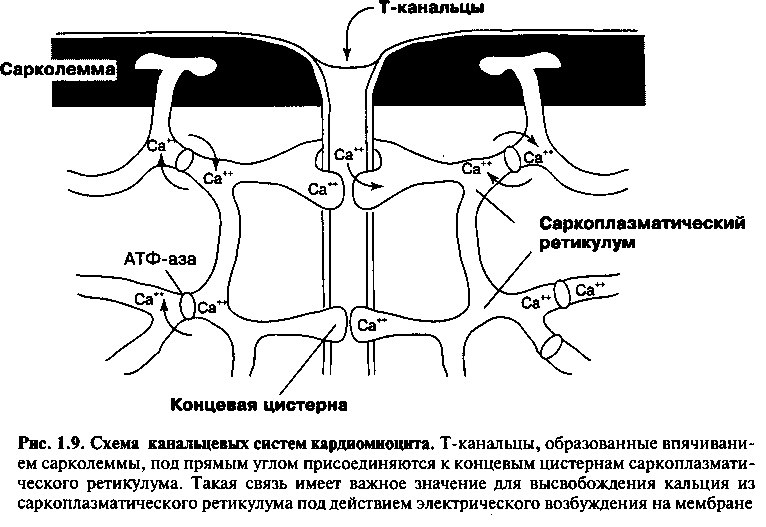
мешочки содержат большую часть внутриклеточного кальция, высвобождение которого является важным звеном передачи возбуждения через мембрану и начала сокращения мышечного аппарата. Боковые мешочки также примыкают к вставочным дискам и сарколемме, формируя полную систему сопряжения процессов возбуждения и сокращения.
Для обслуживания огромных метаболических потребностей сердца и обеспечения высокоэнергетическими фосфатами, миокардиальные клетки снабжены изобилием митохондрий. Эти органеллы расположены между отдельными миофибриллами и занимают приблизительно 35% объема клетки (рис. 1.8).
ОСНОВЫ ЭЛЕКТРОФИЗИОЛОГИИ
Ритмическое сокращение сердца обеспечивается последовательным прохождением электрического импульса по проводящей системе. Признаком электрической стимуляции является потенциал возбуждения, который образуется за счет ионных токов через специальные канальцы сарколеммы. Для того чтобы понять, как электрические импульсы приводят к сокращению сердца, проанализируем процесс клеточной деполяризации и реполяризации. Эти материалы послужат важным фундаментом для глав по электрокардиографии и аритмиям сердца.
Сердечные клетки, ответственные за электрическое возбуждение, разделены на 3 типа в соответствии с электрофизиологическими свойствами, изученными благодаря внутриклеточному введению микроэлектродов и методу patch-clamp:
Клетки пейсмекера — водителя ритма (например, в СА-узле и в АВ-узле).
Специализированная быстро проводящая ткань (например, волокна Пуркинье).
Мышечные клетки желудочков и предсердий.
Сарколемма сердечных клеток каждого типа представлена бислоем фосфолипидов, который в основном непроницаем для ионов. В мембранах клеток есть участки, состоящие из специализированных белков, которые служат ионными каналами, активными и пассивными переносчиками (рис. 1.10). Эти переносчики помогают поддерживать градиенты концентрации ионов и разность потенциалов между внутренней средой и наруж-
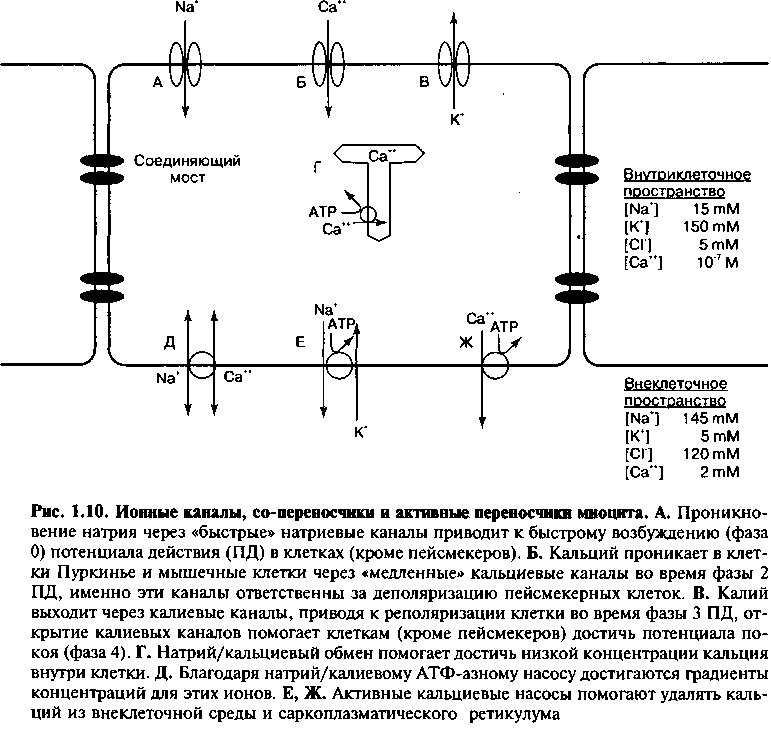
ной поверхностью клеток. В норме концентрация ионов натрия (Na+) и кальция (Са++) гораздо больше снаружи клетки, а концентрация ионов калия (К+) гораздо больше внутри клетки.
Ионные каналы
Ионные каналы представляют собой специализированные белки, расположенные в клеточной мембране, через гидрофильные поры которых может происходить обмен определенными атомами. Существует несколько типов сердечных ионных каналов, которые отличаются по двум свойствам: избирательности и проницаемости.
Каждый тип каналов избирателен (селективен) для определенного иона и имеет для этого соответствующие размеры и строение пор. Например, в сердечных клетках некоторые каналы могут пропускать ионы натрия, другие специализированы для прохождения ионов калия, остальные — для ионов кальция.
Ион может проникать через специальный канал только в определенное время. Ионный канал — это ворота: в каждый данный момент они находятся или в открытом или в закрытом состоянии. Если канал находится в открытом состоянии длительное время, то через него проходит большое количество ионов и поэтому больше трансмембранный ток. Для сердечных ионных каналов, генерирующих потенциал действия, открытие и закрытие ворот определяется трансмембранным потенциалом. Иначе, ворота каждого канала являются потенциалчувствительными. Изменение мембранного потенциала в процессе деполяризации и реполяризации клетки приводит к открытию и закрытию определенных каналов с изменением ионных токов через сарколемму.
Примером потенциалчувствительных каналов могут служить быстрые сердечные натриевые каналы. Трансмембранные белки, которые образуют эти каналы, имеют различные конфигурации в зависимости от потенциала клеточной мембраны (рис. 1.11). При значении потенциала —90 мВ (типичный «потенциал покоя» для клеток миокарда желудочков) большинство каналов в закрытом виде, в состоянии покоя, так что для ионов Na+ проход закрыт. Однако из этого состояния каналы способны перейти в открытое состояние.
Быстрая волна деполяризации (когда мембранный потенциал становится менее отрицательным), «активизирует» покоящиеся каналы для их открытия. В это время ионы Na+ быстро проникают в клетку — последовательный ток Na+ внутрь. В то же время активированные каналы остаются открытыми только на короткое время, несколько тысячных долей секунды, и затем спонтанно закрываются, переходя в неактивное состояние, которое отличается от закрытого «состояния покоя» (рис. 1.11В). В неактивном состоянии ионные каналы не могут перейти непосредственно в открытое состояние, так как ворота белкового канала заблокированы в результате процесса инактивации.
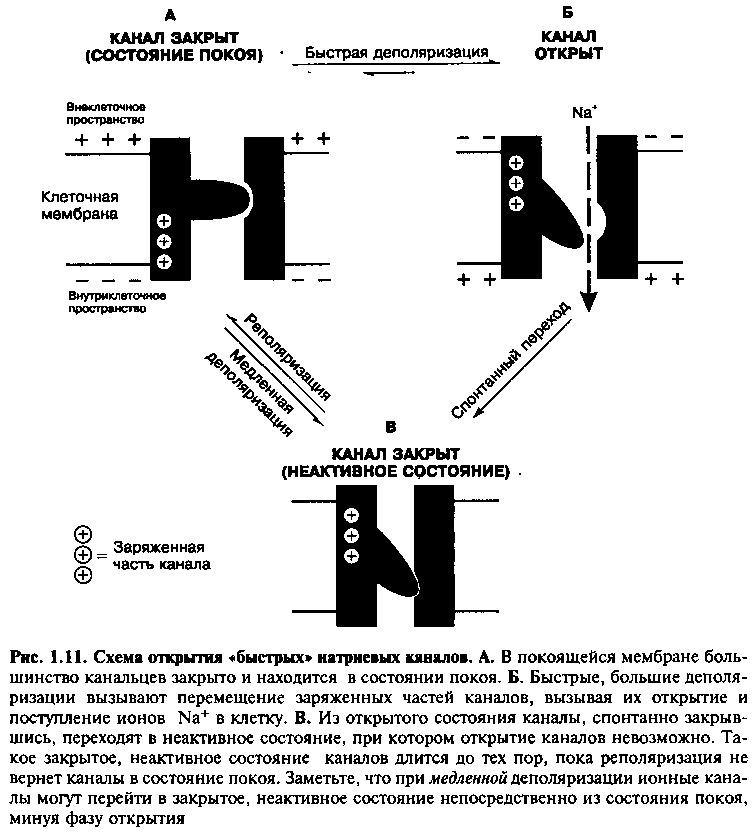
Неактивное состояние сохраняется до тех пор, пока потенциал мембраны не реполяризуется обратно до исходного уровня покоя. Пока происходит реполяризация, неактивные каналы предотвращают любое прохождение натриевых ионов. Поэтому при нормальной клеточной деполяризации потенциалзависимое быстрое прохождение ионов натрия через каналы происходит за короткий промежуток времени, затем каналы закрываются и находятся в таком состоянии до тех пор, пока не произойдет почти полная реполяризация клеточной мембраны.
Необходимо отметить другое важное свойство быстрых натриевых каналов. Если трансмембранный потенциал сердечной клетки претерпевает медленную деполяризацию и поддерживается хронически на уровне менее отрицательном, чем обычный потенциал покоя, инактивация каналов происходит без их предварительного открытия (рис. 1.11). Более того, длительное сохранение менее отрицательного потенциала может привести к тому, что закрытые, неактивные каналы никогда не вернутся в состояние покоя, и быстрые натриевые каналы такой клетки, следовательно, не будут в состоянии проводить ионы Na+. Это и происходит в клетках пейсмекера (водителя ритма) (например, клеток СА- и АВ-узлов), у которых мембранный потенциал превышает —70 мВ в течение всего сердечного цикла. Как результат этого, быстрые натриевые каналы клеток водителей ритма всегда неактивны, и они не играют никакой роли в генерации потенциала действия в этих клетках.
Кальциевые и калиевые каналы сердечных клеток также являются потенциалчувствительными, но их поведение отличается от поведения натриевых каналов, что будет описано в последующих разделах.
Потенциал покоя
В кардиомиоцитах во время покоя, предшествующего возбуждению, разность между электрическими зарядами внутри и вне клетки называют потенциалом покоя. Значение потенциала покоя зависит от двух основных характеристик клетки: 1) от градиента концентрации ионов внутри и снаружи клетки и 2) от того, какие ионные каналы открыты в покое.
Подобно другим тканям, таким как нервные клетки или скелетные мышцы, концентрация калия внутри сердечных клеток гораздо больше, чем снаружи. Это определяет участников транспорта клеточных мембран, важным из них является АТФ-зависимый Na+/K+ насос, который производит обмен ионов Na+ в направлении из клетки и ионов К+ — внутрь клетки.
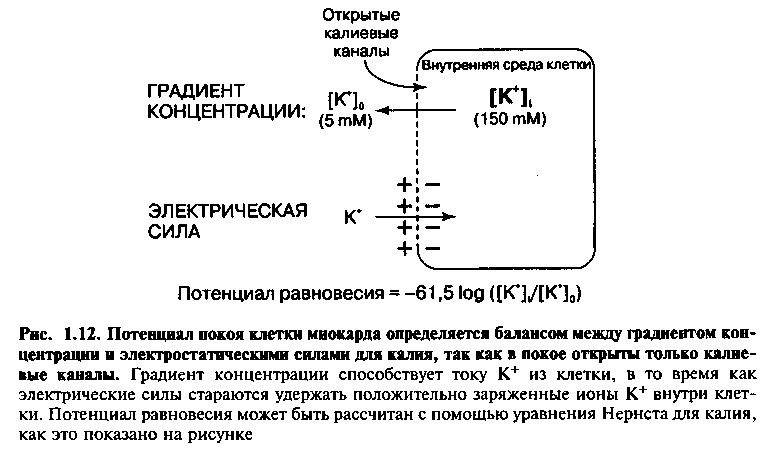
Калиевые каналы кардиомиоцитов открыты в состоянии покоя, в то время как другие ионные каналы (натриевые и кальциевые) закрыты. Поэтому, мембраны покоящихся клеток проницаемы в большей степени для ионов калия, чем для других ионов. В покоящемся состоянии К+ направляется наружу, уменьшая градиент концентрации и положительный заряд внутри клетки. Антагонистами ионов К+ внутри клетки являются крупные отрицательно заряженные белки, неспособные к выходу из клетки вместе с К+. Поэтому, даже когда ионы калия покидают клетку, анионы, оставшиеся в клетках, делают их внутреннюю среду электрически отрицательной по отношению к поверхности клетки.
В то время как внутренняя среда клеток становится все более отрицательно заряженной по отношению к поверхности из-за тока ионов калия наружу, положительно заряженные ионы калия привлекаются внутрь клетки, так что в сумме потери внутриклеточного калия становятся менее выраженными. Таким образом, в состоянии покоя существуют две противоположные силы, регулирующие ток ионов калия через открытые каналы клеточных мембран (рис. 1.12): 1) градиент концентрации способствует выходу калия из клетки, 2) электростатические силы притягивают калий обратно внутрь клетки. В состоянии равновесия баланс между этими химическими и электрическими силами определяет величину потенциала покоя, который в клетках миокарда желудочков приблизительно равен —90 мВ. Электрический потенциал покоя для калия может быть рассчитан с помощью уравнения Нернста, как это показано на рисунке.
В состоянии покоя проницаемость мембран клеток миокарда для натрия минимальна потому, что натриевые каналы в основном закрыты. Однако существует небольшой ток ионов натрия через соответствующие каналы внутрь клетки. Этот слабый ток положительно заряженных ионов натрия внутрь клетки объясняет, почему реальный потенциал покоя менее отрицателен, чем он мог бы быть, если бы клеточные мембраны были проницаемы только для ионов калия.
Натриевые ионы, которые медленно проникают внутрь миоцитов, находящихся в состоянии покоя (а еще большее количество проникает в клетку во время потенциала действия, как это будет описано позже), непрерывно удаляются из клетки и возвращаются во внеклеточную среду. Это происходит благодаря АТФ-зависимому Na+/K+ насосу, который вытесняет натрий из клетки в обмен на калий. В этом процессе на каждые три иона Na+, выходящие из клетки, внутрь клетки проникают два иона К+, создавая направленный наружу ток положительных зарядов. Такой направленный наружу ток катионов также приводит к более отрицательному заряду внутри клетки, по отношению к ее наружной поверхности.
Потенциал действия
Изменение мембранного потенциала клетки приводит к изменению проницаемости мембраны для определенных ионов. Изменение проницаемости ионных каналов отражает потенциал-зависимость каналов. Каждый тип ионных каналов имеет специфические особенности активации и инактивации, которые и определяют прохождение электрического сигнала. Разбор этой ситуации лучше начать после ознакомления с рис. 1.13, где представлена схема развития потенциалов действия в типичном кардиомиоците. Уникальные характеристики потенциала действия в клетках водителей ритма сердца будут описаны позже.
КЛЕТКИ МИОКАРДА
При отсутствии внешнего воздействия потенциал покоя клетки миокарда остается постоянным, приблизительно —90 мВ. Такое состояние покоя до периода деполяризации известно как фаза 4 потенциала действия. За ней следуют 4 фазы, охватывающие периоды деполяризации и реполяризации клеток (рис. 1.13):
Фаза 0. При потенциале покоя мембраны натриевые и кальциевые каналы закрыты. Любое действие, которое делает заряд мембраны менее отрицательным, чем уровень потенциала покоя, приводит к открытию отдельных натриевых каналов. После открытия Na+ каналов, ионы натрия быстро проникают в клетку, снижая тем самым градиент концентрации (концентрация натрия больше снаружи клетки), так как эти положительно заряженные ионы притягиваются к отрицательно заряженным внутриклеточным ионам. Приток ионов Na+ внутрь клетки меняет транс-

мембранный потенциал, делая его еще более отрицательным, способствуя тем самым открытию большего числа натриевых каналов и дальнейшему проникновению ионов натрия внутрь клетки. Когда заряд мембраны достигает уровня порогового потенциала (приблизительно —70 мВ в кардиомиоцитах), создаются условия для открытия быстрых Na+ каналов и генерации самоподдерживающегося внутреннего натриевого тока. Поступление в клетку положительно заряженных ионов Na+, обусловленное градиентом их концентрации, нейтрализует мембранный потенциал до нуля и далее достигает положительных значений.
Этот мощный ток натриевых ионов обусловливает быстрый подъем или фазу 0 потенциала действия. В то же время, Na+ каналы остаются открытыми только в течение тысячных долей секунды, и затем они быстро инактивируются, предотвращая дальнейший ток натрия внутрь клетки (рис. 1.13). Таким образом, во время активации этих быстрых Na+ каналов происходит быстрая ранняя деполяризация клетки; быстрая инактивация обусловливает малую продолжительность потенциала действия.
Фаза 1. После быстрой фазы 0 деполяризации кратковременный ток реполяризации возвращает мембранный потенциал приблизительно к 0 мВ. Возникновение этого тока обусловлено выходом К+ наружу через определенный тип временно активированных калиевых каналов.
Фаза 2. Это относительно длинная фаза потенциала действия, во время которой достигается равновесие между продолжающимся током ионов К+ из клетки и противоположно направленным током ионов Са++ через кальциевые каналы (так называемые кальциевые каналы «L-типа»). Кальциевые каналы начинают открываться уже во время фазы 0, когда заряд мембраны достигает уровня приблизительно —40 мВ. При открытых кальциевых каналах движение Са++ внутрь клетки приводит к тому, что градиент его концентрации внутри клетки падает. Ток Са++ внутрь продолжается более медленно, чем изначальный ток ионов натрия, так как активизация кальциевых каналов происходит медленно, и они остаются открытыми в течение более длительного времени, чем быстрые Na+ каналы (рис. 1.13). В течение этой фазы ток Са++ внутрь и относительно низкая проницаемость для выхода К+ наружу, обусловливают мембранный заряд приблизительно 0 мВ в течение длительного периода времени, известного как плато. Ионы кальция, которые проникают внутрь клетки в течение этой фазы, играют важную роль в стимуляции высвобождения дополнительного количества внутриклеточного кальция из саркоплазматического ретикулума («кальций-индуцируемое высвобождение кальция»), что весьма важно для сокращения миоцитов. Постепенная инактивация Са++ канальцев приводит к тому, что ток К+ наружу начинает превышать ток Са++ внутрь, начинается фаза 3.
Фаза 3. Это завершающий период реполяризации, в течение которого трансмембранный заряд возвращается к величине потенциала покоя, приблизительно —90 мВ. Выход наружу заряженных ионов калия и низкая проницаемость мембраны для других катионов приводят к быстрой реполяризации. Эта фаза завершает цикл потенциала действия и переходит в фазу 4 (покоя), за которой вновь последует деполяризации.
Для того чтобы сохранить нормальные трансмембранные градиенты ионных концентраций, натрий и кальций, которые проникают в клетки в период деполяризации, должны вернуться во внеклеточное пространство, а ионы калия — внутрь клетки. Обмен Na+ и К+ через клеточную мембрану осуществляется посредством АТФ-зависимого Na+/ К+ насоса. Избыток Са++ внутри клетки устраняется в основном благодаря обмену Na+/Ca++, и в меньшей степени за счет АТФ-зависимого кальциевого насоса.
СПЕЦИАЛИЗИРОВАННАЯ ПРОВОДЯЩАЯ СИСТЕМА
Предыдущие разделы были посвящены образованию потенциала действия в клетках миокарда. Клетки специализированной проводящей системы (например, волокна Пуркинье) ведут себя таким же образом, как и кардиомиоциты, однако их потенциал покоя немногим более отрицательный и подъем фазы 0 происходит еще быстрее.
КЛЕТКИ ПЕЙСМЕКЕРА (КЛЕТКИ ВОДИТЕЛЯ РИТМА)
Описанный в предыдущих разделах потенциал действия кардиомиоцитов в норме не развивается спонтанно. Напротив, когда волна деполяризации соседних клеток достигает кардиомиоцита, его мембранный потенциал становится менее отрицательным, что вызывает развитие потенциала действия.
Некоторые сердечные клетки не нуждаются во внешних стимулах для выработки в них потенциала действия. Скорее, они сами в состоянии инициировать ритмичную деполяризацию. Эти клетки называются водителями ритма или пейсмекерными клетками. Они обладают собственным автоматизмом, то есть способностью к спонтанной деполяризации во время 4-й фазы. Когда в клетках достигается пороговый заряд, развивается потенциал действия (рис. 1.14).

Свойствами водителей ритма обладают клетки синоатриального («естественные водители ритма» сердца) и атриовентрикулярного узлов. Несмотря на то, что клетки миокарда желудочков в норме не обладают автоматизмом, они могут приобретать эту способность при определенных заболеваниях, например, при ишемии миокарда.
Вид потенциала действия в пейсмекерных клетках отличается от такового клеток миокарда желудочков тремя особенностями:
- Максимальный отрицательный заряд в пейсмекерных клетках приблизительно равен —60 мВ. Он в значительной степени менее отрицательный, чем потенциал покоя клеток миокарда желудочков (—90 мВ). Существенно более низкий отрицательный заряд мембраны пейсмекерных клеток является причиной того, что быстрые натриевые каналы внутри этих клеток остаются неактивными.
- В отличие от клеток миокарда, фаза 4 потенциала действия пейсмекерных клеток не горизонтальна, она имеет косо восходящий вид, что отражает постепенную, спонтанную деполяризацию. Эта спонтанная деполяризация происходит вследствие тока ионов, называемого пейсмекерным током. Показано, что пейсмекерный ток переносится преимущественно ионами Na+. Ионные каналы, через которые проходит пейсмекерный ток, отличаются от быстрых натриевых каналов, ответственных за фазу 0 деполяризации клеток миокарда. Так, пейсмекерные каналы открываются в период реполяризации клетки, когда мембранный потенциал достигает своего самого низкого уровня. Проникновение внутрь положительно заряженных ионов Na+ через пейсмекерные каналы способствует тому, что мембранный потенциал во время фазы 4 становится все менее отрицательным, пока не достигает порогового потенциала (рис. 1.14). При этом происходит постепенная деактивация пейсмекерных каналов.
- Фаза 0 возбуждения потенциала действия пейсмекерных клеток гораздо менее быстрая и достигает более низкой амплитуды, чем у клеток миокарда. Это происходит потому, что быстрые натриевые канальцы пейсмекерных клеток неактивны, а возбуждение потенциала действия обусловлено единственно токами Са++ внутрь через относительно медленные кальциевые канальцы.
Реполяризация пейсмекерных клеток происходит так же, как и в клетках миокарда желудочков. Она обусловлена: 1) инактивацией кальциевых каналов, и 2) повышенной активацией калиевых каналов и усиленным выходом К+ из клетки.
Рефрактерные периоды
В сравнении с электрическими импульсами, возникающими в нервах и скелетных мышцах, продолжительность сердечного потенциала действия значительно длиннее. Это обусловлено длительным рефрактерным периодом, во время которого мышцы невосприимчивы к повторным стимулам. Эти длительные периоды физиологически необходимы, так как в это время происходит выброс крови из желудочков и их последующее наполнение для очередного сокращения.
Как показано на рисунке 1.15, во время потенциала действия различают три уровня рефрактерности. Степень рефрактерности исходно отражает количество быстрых Na+ каналов, которые вышли из своего неактивного состояния и способны открыться. В течение фазы 3 потенциала действия увеличивается число Na+ каналов, вышедших из неактивного состояния и способных отвечать на деполяризацию. Это, в свою очередь, повышает вероятность того, что стимулы вызовут развитие потенциала действия и приведут к его распространению.
Абсолютный рефрактерный период — это период, в течение которого клетки полностью нечувствительны к новым стимулам. Эффективный рефрактерный период состоит из абсолютного рефрактерного периода, но, продолжаясь за его пределы, включает еще и короткий интервал фазы 3, в течение которого раздражитель возбуждает локальный потенциал действия, который недостаточно силен, чтобы распространиться дальше. Относительный рефрактерный период — это интервал, в течение которого раздражители возбуждают потенциал действия, который может распространяться, но характеризуется меньшей скоростью развития, бо-
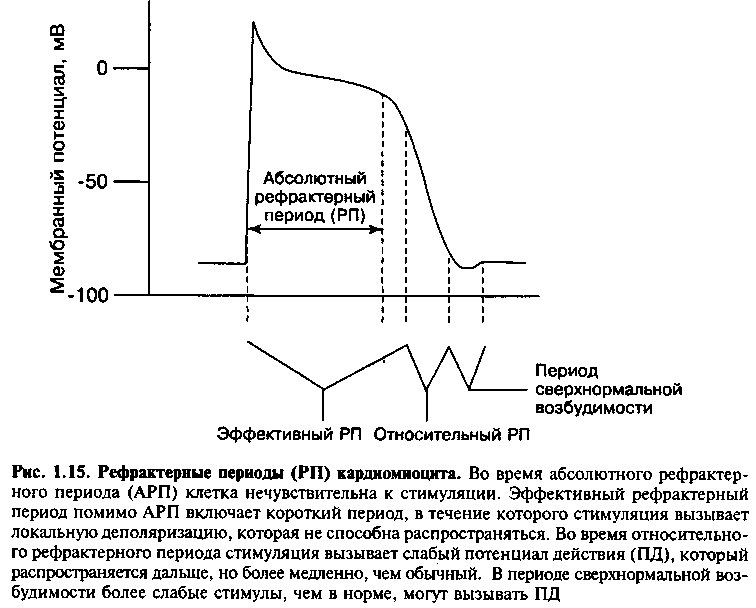
лее низкой амплитудой и меньшей скоростью проведения из-за того, что в момент стимуляции клетка имела менее отрицательный потенциал, чем потенциал покоя. (См. далее раздел «Проведение импульса».) После относительного рефрактерного периода выделяют короткий период «сверхнормальной возбудимости», в котором раздражители, сила которых ниже нормальной, могут вызывать потенциал действия.
Рефрактерный период клеток предсердия короче, чем клеток миокарда желудочков, поэтому ритм предсердий может значительно превышать ритм желудочков при тахиаритмиях.
Проведение импульса
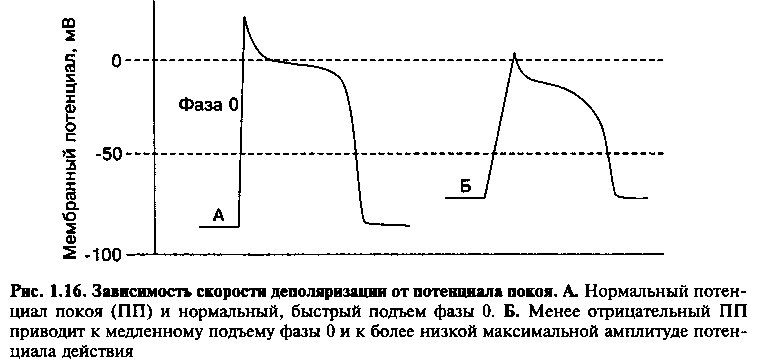
Во время деполяризации электрический импульс распространяется по кардиомиоцитам, быстро переходя на соседние клетки, благодаря тому, что каждый кардиомиоцит соединяется с соседними клетками через контактные мостики с низким сопротивлением. Скорость деполяризации ткани (фаза 0) и скорость проведения по клетке зависит от числа натриевых каналов и величины потенциала покоя. Ткани с высокой концентрацией Na+ каналов, такие как волокна Пуркинье, имеют большой быстрый входящий ток, который быстро распространяется внутри и между клетками и обеспечивает быстрое проведение импульса. В противоположность этому, скорость проведения возбуждения будет значительно ниже в клетках с менее отрицательным потенциалом покоя и большим количеством неактивных быстрых натриевых-каналов (рис. 1.16). Таким образом, величина потенциала покоя сильно влияет на скорость развития и проведения потенциала действия.
Нормальная последовательность сердечной деполяризации
В норме электрический импульс, вызывающий сердечное сокращение, вырабатывается в синоатриальном узле (рис. 1.6).
Импульс распространяется в мышцы предсердий через межклеточные контактные мостики, которые обеспечивают непрерывность распространения импульса между клетками. Обычные мышечные волокна предсердий участвуют в распространении электрического импульса от СА- к АВ-узлу; в отдельных местах более плотное расположение волокон облегчает проведение импульса.
В связи с тем, что предсердно-желудочковые клапаны окружает фиброзная ткань, прохождение электрического импульса от предсердий к желудочкам возможно только через АВ-узел. Как только электрический импульс достигает атриовентрикулярного узла, происходит задержка его дальнейшего проведения (приблизительно в 0,1 секунды). Причиной задержки служит медленное проведение импульса волокнами малого диаметра в узле, а также «медленный» пейсмекерный тип потенциала действия этих волокон (необходимо помнить, что в пейсмекерной ткани быстрые натриевые канальцы постоянно неактивны, и скорость возбуждения обусловлена медленными кальциевыми канальцами). Пауза в проведении импульса в месте атриовентрикулярного узла полезна, так как она дает предсердиям время для их сокращения и полного освобождения от содержимого до начала возбуждения желудочков. В добавление к этому, такая задержка позволяет атриовентрикулярному узлу выполнять функцию привратника, препятствуя проведению слишком частых стимулов от предсердий к желудочкам при предсердных тахикардиях.
Выйдя из атриовентрикулярного узла, сердечный потенциал действия распространяется по быстро проводящим пучкам Гиса и волокнам Пуркинье к основной массе клеток миокарда желудочков. Это обеспечивает координированное сокращение кардиомиоцитов желудочков.
СОПРЯЖЕНИЕ ВОЗБУЖДЕНИЯ И СОКРАЩЕНИЯ
Рассмотрим процесс трансформации потенциала действия в сокращение кардиомиоцитов или процесс сопряжения возбуждения и сокращения. В его основе лежит переход химической энергии в виде макроэргических фосфатов в механическую энергию сокращений кардиомиоцитов.
Существует несколько белков, ответственных за сокращение клеток миокарда (рис. 1.17). Два из них — актин и миозин — являются главными сократительными элементами. Два других — тропомиозин и тропонин — выполняют регуляторную функцию.
Миозин образован толстыми филаментами, каждый филамент состоит примерно из 300 продольно расположенных молекул. Филамент миозина имеет шаровидные головки, которые равномерно распределены по его длине и содержат миозиновую АТФ-азу — фермент, необходимый для сокращения. Актин, более мелкая молекула, представлена тонкими филаментами, образующими альфа-спираль, две цепи которой расположены между толстыми филаментами миозина (рис. 1.8). Титин (также называется коннектин), недавно обнаруженный белок, способствует прикреплению миозина к Z-линии саркомера, а также влияет на эластичность сокращения.
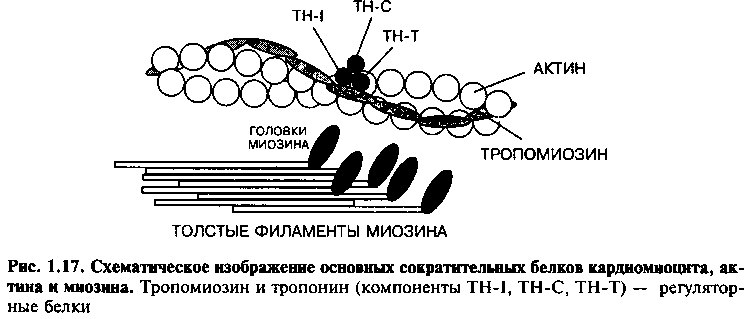
Тропомиозин — двойная спираль, которая лежит в углублении между филаментами актина и в состоянии покоя препятствует взаимодействию между миозиновыми головками и актином, предупреждая тем самым сокращение. Тропонин равномерно распределен вдоль актиновых нитей и состоит из трех субъединиц. Субъединица тропонин С (ТН-С) ответственна за связывание ионов кальция и тем самым — за процесс сокращения. Тропонин I (ТН-1) — субъединица, тормозящая активность АТФ-азы, осуществляющую связь актин-миозин. Тропонин Т (ТН-Т) — субъединица, связывающая тропониновый комплекс с актином и молекулами тропомиозина.
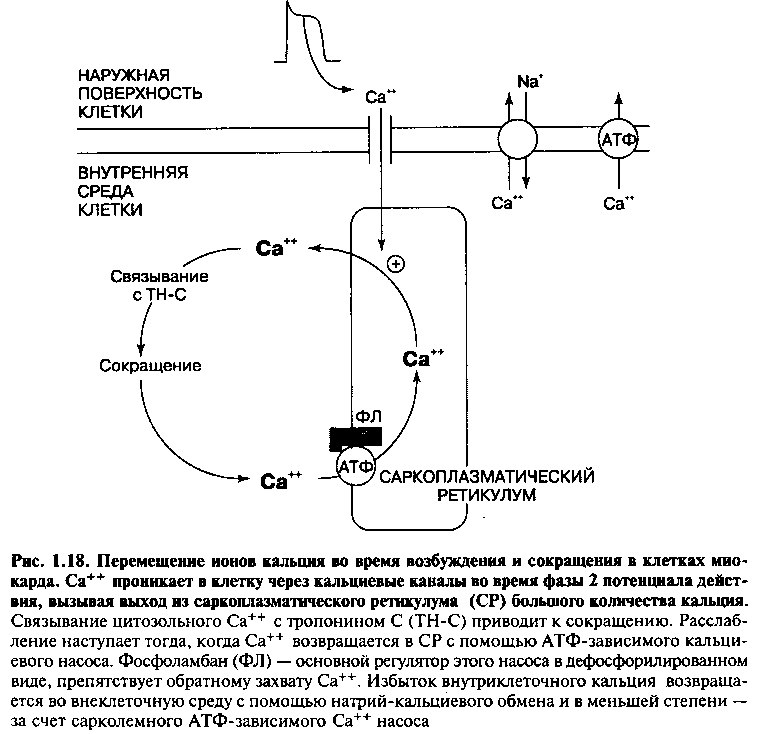
Во время фазы 2 потенциала действия, Са++ проникает в миоциты через кальциевые каналы сарколеммы и Т-каналы. Относительно малое количество кальция, поступившего в клетку, не способно вызвать сокращение миофибрилл, однако оно стимулирует массивный выход Са++ из саркоплазматического ретикулума (рис. 1.18). В результате этого концентрация кальция в клетке увеличивается в 10 раз.
Когда ионы кальция связаны с ТН-С, тормозится активность ТН-Т; это обусловливает изменение строения тропомиозина. В результате становится возможным взаимодействие между актином и миозином, приводящее к сокращению.
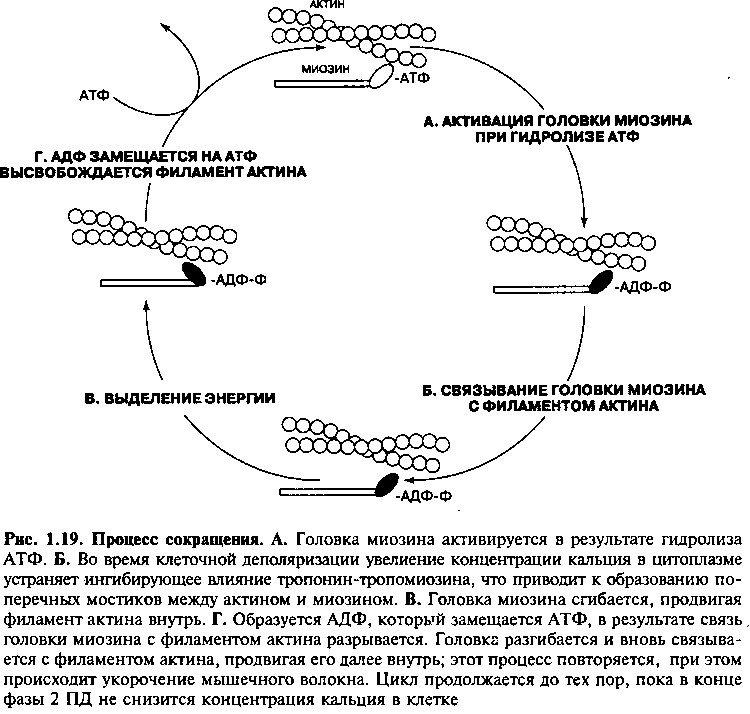
Мышечное сокращение развивается вследствие связывания головок миозина с актиновыми филаментами и «сгибания» головок. В результате этого тонкие и толстые филаменты движутся друг вдоль друга за счет энергии АТФ (рис. 1.19). Первым этапом в этом процессе является активация головки миозина при гидролизе АТФ, после чего головка миозина связывается с актином, образуя поперечный мостик. Взаимодействие головки миозина с актином приводит к структурным изменениям в головке, вызывающим ее «сгибание» Это сгибательное движение вызывает смещение актинового филамента вдоль миозинового.
Пока головка миозина все еще связана с актином, дополнительная молекула АТФ связывается с головкой миозина и вытесняет АДФ, образовавшийся при предшествующем гидролизе АТФ. Связывание нового
АТФ с головкой миозина приводит к высвобождению филамента актина, а гидролиз АТФ возвращает головку миозина в разогнутое состояние, подготавливая ее к следующему циклу. Образование и разрыв связей актина и миозина приводит к укорочению мышечного волокна за счет увеличения степени перекрывания толстых и тонких филаментов внутри каждого саркомера. В присутствии АТФ этот процесс может продолжаться до тех пор, пока концентрация кальция будет достаточной, чтобы препятствовать блокирующему действию комплекса тропонин-тропомиозин.
В завершение фазы 2 потенциала действия, Са++ каналы закрываются, кальций перестает поступать в саркоплазму. В это время кальций удаляется в саркоплазматический ретикулум или выходит из клетки (рис. 1.18). Разрыв связи ионов кальция с тропонином С приводит к тому, что тропомиозин блокирует связь актина с миозином, приводя к расслаблению клеток. С началом следующего потенциала действия цикл сокращения и расслабления может вновь повториться.
Доказано, что концентрация Са++ внутри клетки является главным фактором, определяющим силу сердечного сокращения. Механизмы, которые способствуют повышению концентрации внутриклеточного кальция, увеличивают силу сокращения, в то время как факторы, снижающие концентрацию кальция — уменьшают силу сокращения.
Бета-адренергическая стимуляция и клеточная сигнализация
Бета-адренергическая стимуляция — один из механизмов увеличения тока кальция в миоциты и увеличения силы сокращения желудочков (рис. 1.20). При связывании катехоламинов (например, норадреналина) с -адренергическими рецепторами кардиомиоцита происходит стимуляция мембранной аденилатциклазы под действием трансмембранной гуаниновой регуляторной белковой системы (G-белка). Аденилатциклаза увеличивает продукцию циклического АМФ (цАМФ). Циклический АМФ
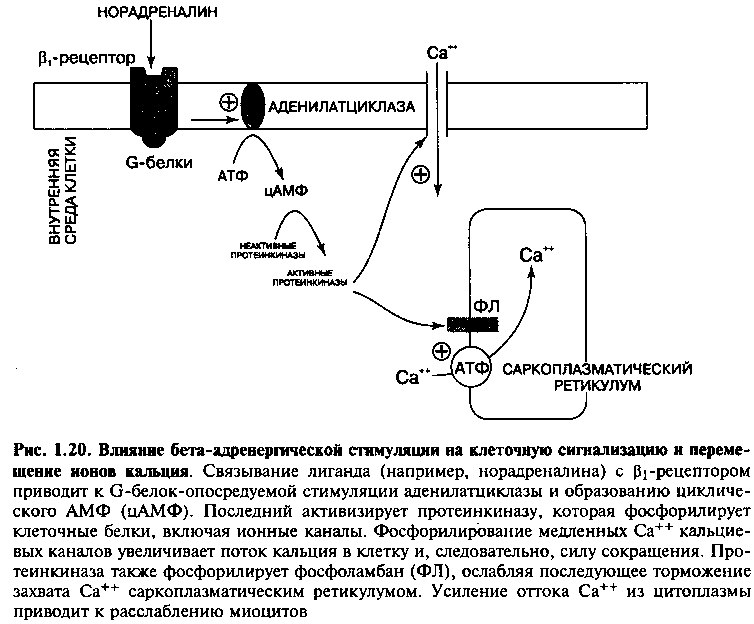
активизирует внутриклеточные протеинкиназы, которые фосфорилируют клеточные белки, включая мембранные кальциевые каналы L-типа. Фосфорилирование кальциевых каналов увеличивает ток Са++ внутрь клетки, повышая высвобождение Са++ из саркоплазматического ретикулума, и увеличивает силу сокращения. Бета-адренергическая стимуляция кардиомиоцитов также способствует их расслаблению. Обратный захват Са++ из цитозоля саркоплазматическим ретикулумом (СР) регулируется фосфоламбаном (ФЛ), белком низкой молекулярной массы, расположенном в мембране СР. Дефосфорилированный фосфоламбан препятствует захвату Са++ саркоплазматическим кальциевым АТФ-азным насосом (рис. 1.18). Однако бета-адренергическая активация протеинкиназ (рис. 1.20), приводит к фосфорилированию фосфоламбана, приостанавливая тормозящие эффекты последнего. Последующее увеличение захвата ионов кальция СР ускоряет удаление Са++ из цитоплазмы, способствуя расслаблению миоцита. Усиление активности цАМФ также приводит к фосфорилированию TH-L Это препятствует образованию связи актин-миозин и, следовательно, приводит к дальнейшему расслаблению клеток.
Таким образом, физиологическая или фармакологическая стимуляция адренергических р,-рецепторов кардиомиоцитов катехоламинами усиливает как сокращение, так и расслабление клеток. В последующих главах мы будем возвращаться к этим важным свойствам кардиомиоцитов.
ЗАКЛЮЧЕНИЕ
Анатомия, клеточный состав и проводящие пути сердца лежат в основе его упорядоченной, ритмичной деятельности. В течение человеческой жизни сердце способно вырабатывать миллиарды импульсов. С каждым циклом сокращения сердце получает и выбрасывает кровь в кровяное русло, обеспечивая ткани организма питательными веществами и удаляя из них продукты распада. В последующих главах мы изучим те нарушения, которые могут происходить в этой чрезвычайно важной системе.