Характеристика клеток сердца
Электрическая активность сердца
Во всех клетках поперечнополосатой мускулатуры сокращение инициируется быстрым изменением вольтажа на клеточной мембране, который называется потенциалом действия. Потенциалы действия клеток мышцы сердца существенно отличаются от соответствующей характеристики клеток скелетной мускулатуры по трем важным параметрам, которые обеспечивают синхронное ритмичное возбуждение сердца: (1) они способны к самозарождению, (2) они могут проводиться непосредственно от клетки к клетке и (3) для них характерен длительный период существования, что предотвращает слияние отдельных мышечных сокращений Для того, чтобы понять эти особые электрические свойства сердечной мышцы, и то, каким образом сердечная деятельность зависит от них, нам необходимо сперва рассмотреть основные электрические особенности возбудимых мембран клеток.
Мембранные потенциалы
У всех клеток по обе стороны их мембран существуют электрические потенциалы (напряжение). Существование мембранных по те нциаловобу словлено тем, что концентрации ионов в цитоплазме существенно отличаются <^мковыхии»нтерстициаль-ной жидкости и ионы, движущиеся против градиента концентрации путем диффузии на полупроницаемых мембранах, способствуют возникновению разности потенциалов. Нам необходимо учитывать три наиболее важных иона, которыми являются натрий (Na+) и кальций (Са2+), которые имеют более высокую концентрацию в интерстициальной жидкости, чем внутри клеток, и калий (К+), распределение которого противоположно. Диффузия ионов сквозь мембрану клетки происходит через каналы, которые (1) построены из белковых молекул, перекрывающих поверхность мембраны (2) специфичны для определенных ионов (например, Na+ каналы) и (3) существуют в различных формах: могут быть закрыты, открыты или инактивированы (не способны к открытию) Проницаемость мембраны для отдельных ионов непосредственно зависит от количества каналов для данного иона, открытых в конкретный промежуток времени.
На рис 3-1 показано, как различия концентрации ионов могут создавать электрический потенциал на клеточной мембране. Представим сперва, как показано в верхней части рисунка, клетку, где (1) концентрация К+ внутри клетки существенно больше, чем снаружи, (2) которая проницаема только по отношению к К+(т. е. открыты только калиевые каналы) и (3) отсутствует первоначальный трансмембранный потенциал.
Из-за наличия градиента концентрации ионы калия (заряженные положительно) будут диффундировать из клетки. Между тем, отрицательно заряженные частицы, такие как анионы белка, не могут покинуть клетку, поскольку для них мембраны не проницаемы
Таким образом, утечка ионов калия приведет к тому, что внутри клетки создастся отрицательный заряд (дефицит положительно заряженных ионов), в то время как более высокий положительный заряд создастся в интерстициальной жидкости (большее количество положительно заряженных ионов). Теперь ион калия, обладая положительным зарядом, притягивается в зоны, заряженные отрицательно. Таким образом, когда ион калия диффундирует из клетки, он создает на поверхности мембраны электрический потенциал, который притягивает его обратно в клетку.
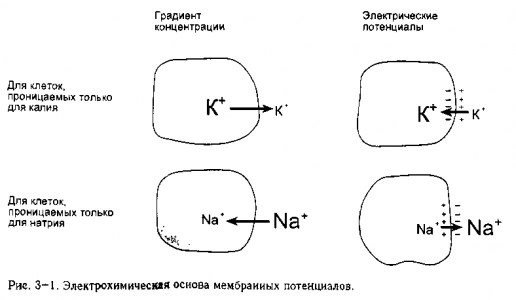
Существует разновидность мембранного потенциала, который называется потенциал равновесия калия, при котором электрические силы, притягивающие К+ в клетку, равны влияниям концентрации, вытягивающим К+ из клетки. Когда у мембранного потенциала имеется такое значение, то результирующего движения иона калия через мембрану не происходит.
При нормальных значениях концентрации около 145 ммоль К+внутри клетки И
4 ммоль К+ во внеклеточной жидкости, потенциал равновесия калия составляет приблизительно -90 мВ (внутри клетки он более отрицательный, чем снаружи на девять сотых вольта)1. Мембрана, проницаемая только для иона калия, обладает способностью быстро (практически мгновенно) создавать потенциал равновесия калия. Кроме того, изменения в величине мембранного потенциала подразумевают перемещение столь небольшого количества ионов, что в ходе данного процесса градиенты концентрации существенно не меняются.
Как изображено в нижней половине рис. 3~ 1, сходные рассуждения показывают, как мембрана, проницаемая только для нона натрия, обладает потенциалом равновесия натрия. Потенциал равновесия натрия составляет примерно +60 мВ, при нормальной внеклеточной концентрации иона натрия — 140 ммоль и внутриклеточной —
5 ммоль. В реальности клеточные мембраны, тем не менее, никогда не бывают проницаемы только для Na+ или только для К+. Когда мембрана проницаема для обоих этих ионов, величина мембранного потенциала будет находиться где-то между потенциалом равновесия натрня и потенциалом равновесия калия. Какую величину будет составлять потенциал равновесия в каждый данный момент, зависит от относительной проницаемости мембраны для Na+ и К+. Если мембрана более проницаема для К+, чем для Na+ величина мембранного потенциала будет ближе к цифре -90 мВ.
Соответственно, наоборот, когда проницаемость для На+выше, чем для К+, мембранный потенциал будет ближе к величине +60 мВ2. Из-за низкой проницаемости или концентрации или неизменности их содержания, влияния на величину мембранного потенциала прочих ионов, помимо Na+ и К+, обычно не великн, и ими можно пренебречь. Однако, как мы увидим позже, ионы кальция, Са2+, участвуют в создании потенциала действия сердечной мышцы. Как и Na+, Са2+ содержится в более высокой концентрации вне клетки, чем в клетке. Потенциал равновесия для Са2+ равен приблизительно + 100 мВ, и по мере того, как проницаемость мембраны для Са2+ возрастает, отмечается тенденция к увеличению положительного заряда на внутренней стороне мембраны.
J Потенциал равновесия (Ej для любого иона (X1) определяется его внутриклеточной и внеклеточной концентрацией в соответствии с уравнением Нернста
- Количественная характеристика того, каким образом концентрации К+ и Na+ и относительная проницаемость Рк) мембраны для данных ионов влияют на мембранный потенциал (Ет) приведена в следующем уравнении:
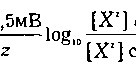
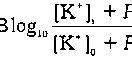
В состоянии покоя у большинства клеток сердечной мышцы величина мембранного потенциала близка к потенциалу равновесия калия. Таким образом, как электрические, так и концентрационные градиенты способствуют проникновению Na* в покоящуюся клетку. В то же время очень низкая проницаемость покоящейся мембраны для Na* в сочетании с потребляющим энергию натриевым насосом, который выводит Na+ из клетки, препятствуют постоянному накоплению натрия внутри покоящейся клетки3.
Потенциалы действия сердечной клетки
Потенциалы действия клеток в.различных участках сердца не одинаковы, а имеют различные характеристики, что является важным фактором в общем процессе возбуждения тканей сердца.
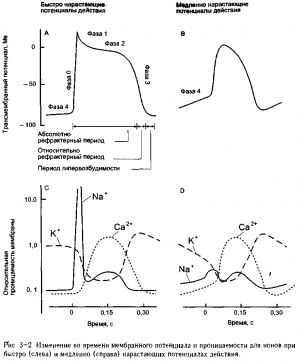
Некоторые клетки, входящие в специализированную проводящую систему, обладают способностью функционировать как водители ритма и спонтанно инициировать возникновение потенциала действия, в то время как обычные клеткн мускулатуры сердца этой способностью не обладают (за исключением ряда необычных ситуаций). Основные электрические характеристики мембранного потенциала обычной клетки сердечной мускулатуры и клетки водителя ритма сердца представлены на рис. 3-2. Потенциалы действия этих типов клеток называются «быстро нарастающими» или «медленно нарастающими» потенциалами действия, соответственно.
Как показано в части А данного рисунка для быстро нарастающих потенциалов действия характерна быстрая деполяризация (фаза 0) со значительным всплеском (overshoot — положительный заряд на внутренней мембране), быстрое снижение высокого потенциала (фаза 1), длинное плато (фаза 2) и реполяризация (фаза 3) до стабильного, высокого (например, значительного отрицательного) мембранного потенциала покоя (фаза 4).
По сравнению со сказанным, медленно нарастающие потенциалы действия, как показано в части В рисунка, характеризуются медленной первоначальной фазой деполяризации, низкоамплитудным всплеско/я, более короткой и менее стабильной фазой плато и последующей реполяризацией до нестабильного медленно деполяризующегося потенциала «покоя». Нестабильный потенциал покоя, отмечающийся в клетках водителя ритма с медленно нарастающими потенциалами действия, обозначаются по-разному: как фаза 4 деполяризации, диастолическая деполяризация или потенциал водителя ритма.
Как указано в нижней части рис. 3-2, А, на протяжении большего времени развертывания потенциала действия, клетки находятся в абсолютно рефрактерном состоянии, т. е. на этом этапе их невозможно стимулировать для образования нового потенциала действия. Ближе к концу потенциала действия мембрана становится относительно рефрактерной и может быть заново возбуждена стимулом более сильным, чем в норме. Непосредственно вслед за потенциалом действия мембрана постепенно становится гипервозбудимой и, как говорят, переходит в «уязвимый», «супернормальный» период. Сходные изменения в возбудимости мембраны, возможно, имеют
место во время медленно нарастающих потенциалов действия, но они в настоящее время не достаточно полно описаны
Напомним, что мембранный потенциал любой клетки в конкретный момент зависит от относительной проницаемости мембраны клетки для конкретных ионов в данный момент времени. Как и во всех возбудимых клетках, потенциалы действия кардиальных клеток являются результатом изменений проницаемости клеточной мембраны для ионов, которые вызываются первоначальной деполяризацией. Схемы С и D на рис. 3~2 показывают изменения в проницаемости мембраны для К+, Na+ и Са2+, что ведет к возникновению различных фаз быстро и медленно нарастающих потенциалов действия.
Обратите внимание, что на протяжении фазы покоя мембраны обоих типов клеток более проницаемы для К+, чем для Na+ и Са2+. Поэтому мембранные потенциалы близки к величине потенциала равновесия калия (-90 мВ) на протяжении этого периода. В клетках водителей ритма считается, что, по крайней мере, три механизма вносят свой вклад в медленную деполяризацию мембраны, которая происходит в период диастолы. Во-первых, отмечается постоянное снижение проницаемости мембраны для К+ во время фазы покоя и, во-вторых, слегка возрастает проницаемость для Na+ Постепенное увеличение отношения величин проницаемости Na+/K+ приводит к медленному сдвигу мембранного потенциала от значения потенциала равновесия калия (-90мВ) в направлении величины потенциала равновесия натрия. В третьих, имеет место увеличение проницаемости мембраны для ионов кальция, что ведет к перемещению внутрь клетки положительно заряженных ионов и также вносит вклад в диастолическую деполяризацию4.
Когда деполяризация мембранного потенциала достигает определенного порогового потенциала в клетке любого типа, запускаются значительные быстрые изменения проницаемости мембраны для конкретных ионов. Уже начавшись, указанные изменения проницаемости не могут остановиться, и они продолжаются до завершения процесса.
Характерная быстрая фаза подъема быстро нарастающего потенциала действия является следствием внезапного увеличения проницаемости мембраны для Na+. Это ведет к явлению, которое называется быстрым потоком внутрь клетки иона натрия и заставляет быстро сдвинуться величину мембранного потенциала к цифре, характерной для потенциала равновесия натрия.
Как указано на участке С рис. 3-2, этот период очень высокой проницаемости для натрия кратковременен. Вслед за ним следует более медленно развивающееся увеличение проницаемости мембраны для Са2+ и снижение проницаемости для К+ Также существует второе медленно развивающееся увеличение проницаемости для Na+, которое, как считается, вызвано механизмом, отличным от того, который участвует в первоначальном быстром изменении проницаемости для Na+.
Эти более устойчйвые изменения проницаемости (которые ведут к процессу, называемому медленным потоком в клетку) пролонгируют этап деполяризации мембраны с образованием плато (фаза 2) сердечного потенциала действия Первоначальный быстрый поток ионов в клетку не велик (или даже отсутствует) в тех клетках, которые обладают медленно нарастающим потенциалом действия. Поэтому медленная фаза подъема данных потенциалов действия, прежде всего, является результатом перемещения в клетку ионов кальция
В обоих типах клеток мембрана реполяризуется (фаза 3) до уровня первоначального потенциала покоя, по мере того как проницаемость для К+увеличивается, а проницаемость для Са2+ и Na+ возвращается к их низким значениям покоя Эти поздние изменения проницаемости приводят к процессу, называемому отсроченным потоком из клетки
В целом плавно нарастающие изменения проницаемости, которые ведут к образованию потенциала действия, являются суммарным результатом изменений, происходящих в каждом из многих отдельных ионных каналов плазматической мембраны одной клетки. Экспериментальная методика, имевшая успех, под названием «селективной блокады» дала возможность изучить работу отдельных ионных каналов.
В соответствии с полученными результатами по этой методике теперь четко известно, что отдельный ионный канал в конкретный момент времени или закрыт, или открыт; не существует переходной ступени частичного открытия. Градации возможны лишь процента времени, в течение которого канал остается открытым, т.е. вероятности того, что он будет открыт. В то время как канал может быть закрыт, в течение длительного промежутка времени, он редко бывает открыт дольше, чем на несколько миллисекунд однократно.
Таким образом, вероятность того, что канал будет открыт, зависит, как от частоты, с которой он открывается, и от того, как долго он остается открытым после каждого такого акта. У величение вероятности того, что ионный канал будет открыт («активация» канала), ведет к возрастанию общего времени открытия и увеличению общей проницаемости мембраны для данного иона.
Определенные виды каналов носят название электроуправляемых каналов (или управляемые напряжением каналы), поскольку вероятность того, будут ли они открыты, определяется величиной мембранного потенциала. Другие разновидности каналов, называемыехемоуправляемыми (или каналы, управляемые рецепторами), активируются определенными нейротрансмиттерами или другими специфическими молекулами, способными передавать информацию. В табл. 3-1 перечислены некоторые из главных ионных потоков и типов каналов, участвующих в электрической активности сердечной клетки.
Некоторые из электроуправляемых каналов реагируют на внезапное появление, устойчивое изменение мембранного потенциала только коротким периодом активации. В то же время изменения мембранного потенциала, протекающие медленно, хотя и той же величины, могут оказаться вовсе неспособными активировать данные каналы. Для объяснения этого явления выдвинуто предположение, что данные каналы обладают двумя независимо работающими «воротами» — воротами активации и воротами инактивации — оба варианта ворот должны быть открыты, чтобы канал в целом был открыт. Оба этих типа ворот реагируют на изменение мембранного потенциала, но временные характеристики и их чувствительность к величине электрического напряжения у них различны.
Данные концепции представлены на рис. 3-3. В состоянии покоя при поляризации мембраны до примерно -80 мВ активация быстрого Na+ канала отсутствует (или т-ворота закрыты), а инактивация имеетместо (или h-ворота открыты) (рис. 3-3, А). При быстрой деполяризации мембраны до порогового уровня натриевые каналы значительно активируются, обеспечивая быстрый вход внутрь клетки положительно заряженных ионов натрия, что приводит к дальнейшей деполяризации мембраны, и тем самым, запускает «быстро нарастающий» потенциал действия, как показано на рис. 3-3, В. Это происходит, поскольку m-ворота реагируют на деполяризацию мембраны более быстрым открытием, чем h-ворота реагируют своим закрытием. Поэтому за быстрой деполяризацией до порогового уровня следует короткий, но резкий период активации натриевого канала, когда т-ворота открыты, а h-ворота уже закрыты. Фактически фаза 0 быстро нарастающего сердечного потенциала действия свидетельствует о том, насколько быстро m-ворота могут открываться, в то время как фаза 1 может частично свидетельствовать о периоде закрытия h-ворот.
Первоначальная деполяризация мембраны также вызывает активацию d-ворот с медленным открытием кальциевого канала. Это обеспечивает медленное поступление Са2+ внутрь клетки, что позволяет поддерживать деполяризацию в течение фазы плато потенциала действия (рис. 3-3, С). В конечном итоге происходит реполяризация вслед-


ствие отсроченной инактивации кальциевого канала (путем закрытия f-ворот) и открытия калиевых каналов, которые не показаны на рис. 3-3. Факторы, регулирующие работу калиевых каналов (которые могут быть селективно заблокированы ионами тетраэтиламмония), остаются не до конца исследованными. Высокая внутриклеточная концентрация Са2+ может обусловливать активацию калиевых каналов во время реполяризации. h-Ворота остаются закрытыми в течение всего остального периода потенциала действия, с успехом инактивируя натриевый канал и обеспечивая длительный рефрактерный период сердечных клеток, который продолжается до конца фазы 3. При реполяризации оба вида ворот натриевого канала возвращаются к своему исходному состоянию и с этого момента канал готов к реактивации с последующей деполяризацией.
Медленно нарастающий потенциал действия, показанный в правой половине рис. 3-3, отличается от быстро нарастающего потенциала действия, прежде всего, отсутствием в начале его выраженной активации быстрого натриевого канала. Это является прямым следствием медленной деполяризации до порогового потенциала. Медленная деполяризация предоставляет инактивационным h-воротам время для закрытия, даже если активационные m-ворота открываются (рис. 3-3, D). Таким образом, при медленно нарастающем потенциале действия не сущ ествует первоначального периода когда преимущественно все натриевые каналы клетки одновременно открыты Деполяризация за пределы порогового уровня происходт медленно и вызвана, прежде всего, вхождением Са2+ через медленные каналы (рис. 3-3, Е)
В то время как в клетках определенных зон сердца в качестве типичного варианта отмечаются быстрый тип потенциала действия, а в клетках других областей в норме мы видим медленный тип потенциала действия, важно знать, что все сердечные клетки теоретически способны обладать любым типом потенциала действия, который зависит от того, с какой быстротой они деполяризируются до порогового потенциала. Как мы увидим, быстрая деполяризация до порогового потенциала обычно происходит в клетке при возникновении потенциала действия на соседней клетке. Медленная деполяризация до порогового уровня происходит, когда сама клетка спонтанно и постепенно утрачивает свою поляризацию покоя, что в норме возникает только в синоатриальном (SA) узле. Хроническая умеренно выраженная деполяризация покоящейся мембраны (вызванная, например, высокой внеклеточной концентрацией К+) может инактивировать быстрые каналы (путем закрытия h-ворот) без инактивации медленных кальциевых каналов. При этих условиях все сердечные клетки будут обладать потенциалом действия медленного типа. Выраженная и длительная деполяризация в то же время может вызвать инактивацию как быстрых, так и медленных каналов и тем самым сделать клетки сердечной мышцы неспособными к возбуждению.
Проведение потенциалов действия по тканям сердца
Потенциалы действия проводятся по поверхности отдельных клеток, поскольку активная деполяризация в любом участке мембраны ведет к возникновению локальных потоков внутриклеточной и внеклеточной жидкости, в результате чего происходит пассивная деполяризация непосредственно соседствующих зон мембраны до их порогового напряжения для возникновения активной деполяризации.
Потенциалы действия распространяются в сердце от клетки к клетке, так как соседние клетки сердечной мышцы имеют участки тесного соприкосновения мембран, которые называются вставочными дисками (нексусами), через которые может легко
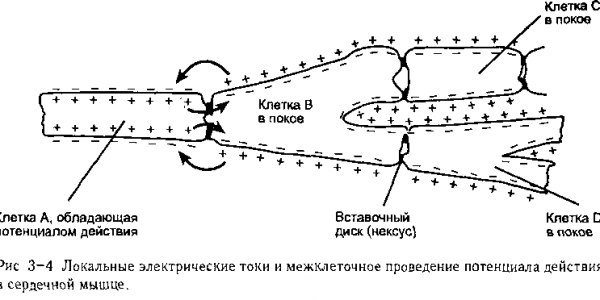
проходить внутренний локальный электрический ток. Специализированные каналы, построенные из белковых соединений, расположены на концах клеток и соединяются конец в конец с образованием межклеточного канала, который позволяет ионам перемещаться из клетки в клетку. На рис. 3~4 схематически показано, каким образом эти вставочные диски способствуют передвижению потенциала действия от клетки к клетке
Клетки В, С, D представлены в состоянии покоя, при этом на их внутренней поверхности отрицательный заряд больше, чем на наружной Клетка А показана в фазе плато потенциала действия и ее положительный заряд на внутренней поверхности мембраны выше, чем на наружной. Из-за наличия вставочных дисков электростатическое притяжение может вызвать локальный поток (перемещение ионов) между деполяризированной мембраной активной клетки А и поляризированной мембраной покоящейся клетки В, как указано стрелками на рисунке. Вследствие этого перемещения ионов уменьшается разность потенциалов на покоящейся мембране, т. е. происходит деполяризация мембраны клетки В. Поскольку локальные потоки ионов из активной клетки А деполяризуют мембрану клетки В возле вставочных дисков до порогового уровня, то в данной области инициируется потенциал действия и переносится на клетку В Отсюда по ветвям клетки В (обычная морфологическая характеристика волокон сердечной мышцы) потенциал действия вызовет появление потенциала действия на клетках Си D. Этот процесс распространяется по всему миокарду.
Скорость, с которой потенциал действия распространяется через участок сердечной ткани, называется скоростью проведения. Скорость проведения существенно варьирует в различных отделах сердца. Эта скорость непосредственно зависит от диаметра вовлеченных в процесс мышечных волокон Таким образом, проведение через клетки малого диаметра в атриовентрикулярном (AV) узле происходит гораздо медленнее, чем проведение через клетки большого диаметра в вентрикулярной системе волокон Пуркинье. Скорость проведения также напрямую зависит от интенсивности локального деполяризирующего тока ионов, которые в свою очередь непосредственно зависят от интенсивности повышения потенциала действия. Быстрая деполяризация способствует быстрому проведению. Различия емкости и (или) сопротивления клеточных мембран, вставочных дисков и цитоплазмы также являются факторами, которые обусловливают различие величин скорости проведения потенциала действия через определенные области сердца.
Специфические электрические свойства различных клеток сердца отражаются в характерной форме потенциалов действия, показанных в правой части рис. 3-5. Обратите внимание, что потенциалы действия, представленные на рис. 3—5, изображены таким образом, чтобы обозначить время, в течение которого электрический импульс, образующийся в SA узле, достигает других зон сердца. Клетки SA узла служат нормальным водителем ритма сердца и определяют частоту сердечных сокращений. Так происходит потому, что спонтанная деполяризация мембраны в покое наиболее быстро происходит в клетках SA узла и они достигают своего порогового потенциала прежде, чем все другие клетки.
Потенциал действия, возникший в клетках SA узла, последовательно распространяется через стенку предсердия На рис. 3-5 показаны потенциалы действия клеток из двух различных участков предсердия: один расположен непосредственно рядом с SA узлом, другой несколько более отдаленно от данного образования Обе клетки имеют сходную форму потенциала действия, но их смещение по времени отражает тот факт, что требуется некоторое время для того, чтобы импульс распространился по предсердию.
Как показано на рис. 3-5, потенциалы действия клеток AV узла по форме похожи на соответствующие кривые клеток SA узла. Обратите также внимание, что у клеток
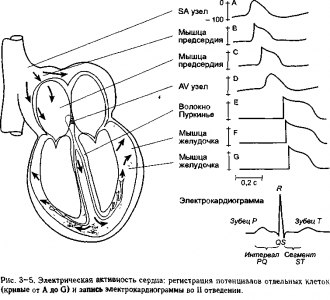
AV узла отмечается более быстрая спонтанная деполяризация покоя, чем у других клеток сердца, за исключением клеток SA узла. AV узел иногда называется латентным водителем ритма и во многих патологических ситуациях он в большей степени, чем S А узел, определяет ритм сердца. Из-за небольшого размера клеток узла и медленной скорости подъема их потенциала действия кардиальный импульс проходит очень медленночерез ткань AV узла.
Поскольку AV узел несколько замедляет передачу кардиального импульса от предсердия к желудочкам, то желудочки сокращаются несколько позже предсердий в каждом сердечном цикле. Из-за быстрого повышения потенциалов действия и других факторов, таких как большой размер клеток, электрическое проведение в волокнах Пуркинье осуществляется чрезвычайно быстро. Это обстоятельство позволяет системе волокон Пуркинье передавать импульс клеткам во многие участки желудочков практически одновременно.
На рис. 3-5 показаны потенциалы действия от мышечных клеток в двух зонах желудочков. Из-за высокой скорости проведения в тканях желудочков в точке начала процесса отмечается лишь небольшое отличие. Обратите внимание (рис. 3-5), что клетки желудочков, которые деполяризуются последними, обладают более короткими потенциалами действия и поэтому первыми начинают процесс реполяризации.
Электрокардиограмма
Электрическое поле, вызванное электрической активностью сердца, пронизывает ткани организма и может быть измерено с помощью электродов, помещенных на поверхность тела. Метод скалярной электрокардиографии позволяет зарегистрировать, как напряжение между двумя точками на поверхности тела меняется с течением времени в результате электрических процессов, происходящих во время сердечного цикла. В каждое мгновение сердечного цикла электрокардиограмма регистрирует результирующее электрическое поле, которое является суммой многих слабых электрических полей, порождаемых изменением разности потенциалов, происходящим на отдельных клетках сердца в данный момент. Когда одновременно в большой массе клеток сердца осуществляется процесс деполяризции или реполяризации, на электрокардиограмме наблюдается значительный вольтаж. Поскольку электрический импульс распространяется через ткань сердца стереотипно, то временная характеристика изменения напряжения, регистрируемая между двумя точками на поверхности тела, тоже является стереотипной и будет копировать саму себя во время каждого сердечного цикла.
■ В нижней части рис. 3-5 представлена типичная запись изменения напряжения, которая в норме измеряется между правой рукой и левой ногой по мере того, как в сердце происходит один цикл электрического возбуждения; такая регистрация называется II стандартным отведением электрокардиограммы и будет детально обсуждена в главе 5. Основными характеристиками электрокардиограммы являются зубец Р, комплекс QRS и зубец Т. Зубец Р отражает деполяризацию предсердий, комплекс QRS — деполяризацию желудочков, а зубец Т — реполяризацию желудочков.
Регуляция частоты сердечных сокращений
Нормальные ритмичные сокращения сердца происходят вследствие спонтанной активности клеток водителя ритма, расположенного в S А узле. Промежуток времени между сокращениями сердца (и таким образом частота сердечных сокращений) определяется тем временем, которое требуется мембранам клеток водителя ритма для достижения порогового уровня за счет спонтанной деполяризации. Сокращения сердца происходят со спонтанной или автономной частотой 100 ударов в минуту) при отсутствии каких-либо внешних воздействий. Внешние воздействия, однако, необходимы для того, чтобы увеличить или уменьшить частоту сердечных сокращений по сравнению с указанной автономной частотой.
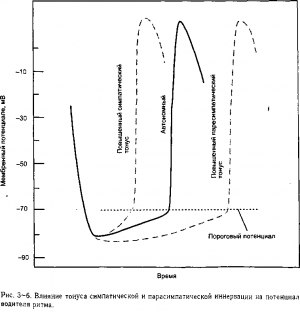
Два наиболее важных внешних воздействия на сердечный ритм происходят со стороны вегетативной нервной системы. Волокна как симпатического, таки парасимпатического отделов вегетативной нервной системы оканчиваются на клетках SA узла и указанные волокна могут влиять на автономную частоту сердечных сокращений. Активация симпатических нервов сердца (повышение симпатического тонуса сердца) увеличивает частоту сердечных сокращений. Повышение парасимпатического тонуса сердца замедляет частоту сердечных сокращений. Как показано на рис. 3-6, парасимпатические и симпатические нервы влияют на частоту сердечных сокращений за счет изменения процесса спонтанной деполяризации потенциала покоя в клетках водителя ритма SA.
Парасимпатические волокна, которые подходят к сердцу в составе ветвей блуждающего нерва, выделяют медиатор, ацетилхолин, на клетках SA узла. Ацетилхолин увеличивает проницаемость мембраны в покое для К+ и снижает диастолическую проницаемость для Na+5. Как показано на рис. 3-6, эти изменения проницаемости оказывают два эффекта на потенциал покоя клеток водите ля ритма сердца: (1) они вызывают первоначальную гиперполяризацию мембранного потенциала покоя путем приближения его значения к потенциалу равновесия калия и (2) они замедляют скорость спонтанной деполяризации мембраны в покое.
Оба эти эффекта увеличивают промежуток времени между сокращениями сердца путем удлинения периода, который необходим для деполяризации покоящейся мембраны до порогового уровня. Так как в норме существует определенная постоянная тоническая активность кардиальных парасимпатических нервов, нормальная частота сердечных сокращений в покое составляет около 70 ударов в минуту.
Из симпатических нервов на сердечные клетки освобождается медиатор норадреналин. Помимо прочих эффектов, которые будут обсуждены позже, норадреналин увеличивает потоки Na+ (i,) и Са2+, направленные внутрь клетки, во время диастолы5 6 Эти изменения увеличивают частоту сердечных сокращений за счет возрастания скорости диастолической деполяризации, как показано на рис. 3-6
Помимо симпатических и парасимпатических нервов существует много (обычно менее важных) факторов, которые могут изменять частоту сердечных сокращений Они включают ряд ионов и циркулирующих гормонов, а также такие физические воздействия, как температура и растяжение стенки предсердия. Все они воздействуют, определенным образом изменяя время, необходимое для деполяризации покоящейся мембраны др порогового потенциала. Ненормально высокая концентрация^* во внеклеточной жидкости, например, вызывает уменьшение частоты сердечных сокращений за счет сдвига порогового потенциала.
Факторы, которые увеличивают частоту сердечных сокращений, оказывают положительный хронотропный эффект. Те факторы, которые уменьшают частоту сердечных сокращений, оказывают отрицательный хронотропный эффект.
Помимо влияния на частоту сердечных сокращений, вегетативные нервные волокна также влияют на скорость проведения потенциалов действия через ткани сердца. Усиление симпатических влияний увеличивает скорость проведения (оказывает положительный дромотропный эффект), в то время как усиление парасимпатических влияний снижает скорость проведения (имеет отрицательный дромотропный эффект). Эти воздействия наиболее значимы в AV узле и могут влиять на длительность интервала PQ.
Механическая деятельность сердца
Сокращение сердечной мышцы
Сокращение клетки сердечной мышцы инициируется воздействием информационного сигнала потенциала действия на внутриклеточные органеллы, в результате чего происходит развитие напряжения и (или) укорочение клетки. В данном разделе мы опишем (1) субклеточные процессы, участвующие в сопряжении возбуждения и сокращения клетки (электромеханическое сопряжение) и (2) механические свойства сердечных клеток.
Основные гистологические характеристики клеток сердечной мышцы весьма сходны с соответствующими чертами клеток скелетной мускулатуры и включают в себя: (1) обширную миофибриллярную структуру, состоящую из параллельных переплетенных тонких и толстых нитей, которые расположены группами по несколько штук и носят название саркомеров — они ответственны за механические процессы развития укорочения и напряжения7; (2) внутреннее разделение цитоплазмы перегородками системы внутриклеточных мембран, называемой саркоплазматическим ретикулумом (SR), где секвестрируется кальций во время диастолического интервала с помощью накапливающего кальций белка — кальсеквестрина, (3) регулярно расположенные глубокие впячивания клеточной мембраны (сарколеммы), называемые Т-тубулами, которые связаны с определенными отделами саркоплазматического ретикулума («соединительный» SR) посредством плотных тяжей («ножек») и которые передают информационный сигнал потенциала действия во внутренние части клетки, и (4) большое количество митохондрий, которые обеспечивают осуществление процессов окислительного фосфорилирования, что необходимо для выработки нужного количества АТФ для удовлетворения высоких метаболических потребностей сердечной мышцы. Студентам рекомендуется просмотреть учебную литературу по гистологии, для уточнения специальных деталей, касающихся морфологического строения клетки.
Сопряжение процессов возбуждения и сокращения
Потенциалы действия мышцы инициируют механическое сокращение посредством процесса, называемого сопряжение возбуждения и сокращения, который представлен на рис. 3-7. Основным звеном сопряжения процессов возбуждения и сокращения является резкое увеличение внутриклеточной концентрации свободного Са2+. Концентрация «покоя» внутриклеточного свободного Са2+ составляет менее 0,1 мкм. В противоположность этому во время максимальной активации сократительного аппарата, внутриклеточная концентрация свободного Са2+достигает почти 100 мкм. Когда волна деполяризации распространяется по мембране мышечной клетки и вниз по Т-тубулам, Са2+ освобождается из саркоплазматического ретикулума во внутриклеточную жидкость.
Как показано на левой стороне рис. 3-7, инициатором запуска данного механизма является вход кальция в клетку через кальциевые каналы L-типа и увеличение концентрации Са2+ в зоне непосредственно под сарколеммой на поверхности клетки и на протяжении всей t-канальцевой системы. В отличие от скелетной мышцы, данное исключительно локальное увеличение содержания кальция является важным фактором для инициирования значительного освобождения кальция из SR. Это инициированное кальцием освобождение кальция является результатом открытия каналов в SR, чувствительных к освобождению кальция8. Хотя количество Са2+, которое проникает в клетку во время единичного потенциала действия невелико по сравнению с тем количеством, которое выделяется из SR, но оно не только достаточно для инициирования освобождения SR кальция, но и для поддержания адекватных уровней Са2+ в конечном итоге во внутриклеточной жидкости организма.
При высокой внутриклеточной концентрации Са2+ (>1мкм) в мышце между двумя типами нитей образуются связи, которые называются поперечными мостиками. Единицы саркомера, как представлено в нижней части рис. 3-7, соединяются конец в конец по Z линиям с образованием миофибрилл, которые простираются по всей длине мышечной клетки. Во время сокращения тонкие и толстые нити скользят друг задругой, в результате чего сокращается каждый саркомер и тем самым мышца в целом. Мостики образуются, когда регулярно расположенные головки миозина толстых нитей прикрепляются к регулярно расположенным зонам молекул актина тонких нитей. Последующая деформация мостиков приводит к втягиванию молекул актина по направлению к центру саркомера
Такое соединение молекул актина и миозина нуждается в энергии из аденозинтри-фоефата (АТФ). В мышцах в состоянии покоя прикрепление миозина к зонам актина ингибируется тропонином и тропомиозином. Кальций вызывает сокращение мышцы посредством взаимодействия с тропонином С, изменяющего конфигурацию, что устраняет ингибицию зон актина тонких нитей Поскольку единичный поперечный мостик является очень короткоживущим образованием, массивное сокращение мышцы подразумевает повторное образование поперечных мостиков, возникновение прогрессирующего передвижения миофиламентов, их разъединение, образование вновь в новой зоне актина и так опять и опять в виде циклического процесса.
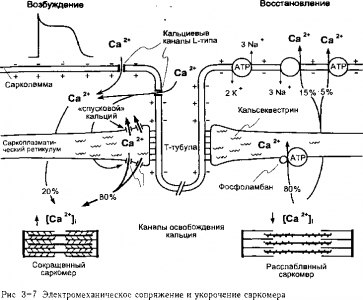
Существует несколько процессов, которые участвуют в уменьшении количества внутриклеточного Са2+, что прекращает сокращение. Эти процессы изображены на правой половине рис. 3-7. Примерно 80% кальция активно извлекается обратно в SR за счет работы Са2+-АТФазных насосов, расположенных в сетчатой зоне SR9. Примерно 20% кальция вытесняется из клетки вб внеклеточную жидкость или за счет Na+-Са2+ обменника, расположенного в сарколемме10, или посредством Са2+-АТФазных насосов в сарколемме.
Сопряжение процессов возбуждения и сокращения в сердечной мышце отличается от соответствующего процесса в скелетной мышце тем, что первый может модулироваться, от одиночного потенциала действия, инициированного в сердечной мышце, может воз-
никнуть взаимодействие между актином и миозином (сокращение) различной интенсивности. Считается, что механизм этого явления зависит от различий в том количестве Са2+, которое достигает миофиламентов и, следовательно, от числа поперечных мостиков, активированных во время сокращения. Эта способность сердечной мышцы варьировать силу своего сокращения — т. е. менять свою сократительную способность — Является чрезвычайно важным фактором для функции сердца, как это будет показано в последующих отделах данной главы.
Длительность сокращения клетки сердечной мышцы приблизительно такая же, как и продолжительность потенциала действия. Поэтому электрический рефрактерный период клетки сердечной мышцы не заканчивается, пока не завершается механическая реакция. Как следствие этого клетки мышцы сердца не могут активироваться достаточно быстро, чтобы возник слитный (тетанический) вариант длительного сокращения. Это важно, поскольку попеременное сокращение и расслабление является необходимым условием для деятельности сердца как насоса.
Процессы, протекающие в мышечной клетке сердца
Образование поперечных мостиков, которое происходит после активации мышцы в качестве подготовки к сокращению, дает мышце возможность для развития силы и (или) укорочения. Произойдет ли первое или второе, или некая комбинация обоих явлений зависит, прежде всего, от того, что допустимо при условии внешних сил, приложенных к мышце во время сокращения. Например, активация мышцы, чьи концы жестко фиксированы, заставляет ее развить напряжение, но она не может укорачиваться. Это явление носит название изометрического («с фиксированной Длиной») сокращения. Сила, которую развивает мышца во время изометрического сокращения, указывает на ее максимальную способность к развитию напряжения. В противоположном случае активация нефиксированной мышцы заставляет ее сокращаться без развития силы, поскольку нет объекта, против которого данная сила могла бы быть приложена. Такой тип сокращения носит название изотонического («с фиксированным напряжением»), В данных условиях мышца укорачивается с максимально возможной для нее скоростью (называемой V ), которая определяется максимально возможной скоростью протекания цикла образования поперечных мостиков. Если к мышце добавить нагрузку, то это снизит скорость и степень ее укорочения. Таким образом, процесс сокращения мышцы зависит как от внутренних свойств мышцы, так и от внешних сил, приложенных к мышце в процессе сокращения. Мышечные клетки стенки желудочка функционируют при действии различных сил во время различных фаз каждого сердечного цикла. Чтобы понять функцию желудочков, мы должны, прежде всего, исследовать, как сердечная мышца ведет себя, когда на нее воздействуют различные силы.
Изометрическое сокращение: взаимоотношения длины и напряжения. Влияние длины мышцы на поведение сердечной мышцы во время изометрического сокращения представлено на рис. 3-8. В верхней части показана экспериментальная установка для измерения силы мышцы в покое и во время сокращения при трех различных вариантах ее длины. В средней части рисунка представлены временные характеристики мышечного напряжения при каждом варианте первоначальной ее длины и на нижней части рисунка показан график результатов исследования напряжения мышцы в зависимости от ее длины.
Первый важный факт, который виден на рис. 3-8, заключается в том, что необходима сила для того, чтобы покоящуюся мышцу растянуть до различной длины. Эта сила носит название напряжения покоя. Нижняя кривая на графике на рис. 3-8 показывает напряжение покоя, измеренное при различной длине мышцы, она называется кривой зависимости напряжения от длины в покое. Когда мышца стимулируется с целью вызвать ее сокращение, в то время как ее длина остается постоянной, данная мышца демонстрирует дополнительный компонент напряжения, называемый активным напряжением. Общее напряжение, развиваемое мышцей во время сокращения, является суммой напряжения покоя и активного напряжения.
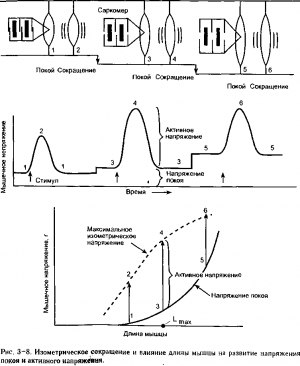
Второй важный факт, представленный на рис. 3-8, заключается в том, что активное напряжение, развиваемое сердечной мышцей во время процесса изометрического сокращения, в значительной степени, зависит от длины мышцы, при которой происходит сокращение. Активное напряжение достигает своего максимума при некой промежуточной длине, обозначаемой как Ггмх. Небольшое активное напряжение возникает при очень небольшой или при очень значительной длине мышцы. В норме сердечная мышца работает при длине, существенно меньшей, чем LmaV так что увеличение длины мышцы приводит к увеличению напряжения, развиваемого во время изометрического сокращения
Существуют три отдельных механизма, которые предложены для объяснения взаимоотношений между длиной мышцы и развиваемым ею напряжением. Первый механизм предполагает, что данная взаимосвязь зависит от степени нахлеста толстой и тонкой нитей саркомера в покое. Гистологические исследования показывают, что изменения в длине покоя целой мышцы связаны с пропорциональными изменениями в отдельных саркомерах. Максимальное напряжение возникает в саркомере длиной от 2,2 до 2,3 мкм. При длине саркомера менее = 2 мкм противостоящие тонкие волоконца могут пойти внахлест или изогнуться и поэтому помешать развитию активного напряжения, как показано в верхней части рис 3-8. При больших значениях длины саркомера перехлест может быть не достаточен для оптимального образования поперечных мостиков.
Второй (и, возможно, самый важный) механизм основан на зависящем от длины изменении чувствительности миофиламентов к кальцию. При малой длине, по-видимому, активируется только часть потенциальных поперечных мостиков при данном повышении концентрации кальция в клетке. При большей длине активируется большее количество поперечных мостиков, что ведет к повышению активного напряжения. Это изменение чувствительности к кальцию происходит мгновенно после изменения в длине без какой-либо временной отсрочки. «Датчик», ответственный за определяемою длиной активацию сердечной мышцы, представляется связанным с молекулой тропонина С, но механизм этого действия не до конца понятен.
Третий механизм базируется на наблюдении, что на протяжении нескольких минут после удлинения покоящейся сердечной мышцы, отмечается возрастание количества кальция, которое освобождается во время возбуждения, что сопряжено с дальнейшим увеличением силы сокращения Считается, что чувствительные к растяжению ионные каналы в клеточных мембранах могут быть ответственны за эту отсроченную реакцию
Не совсем ясно, в какой степени каждый из перечисленных механизмов вносит вклад в силу сокращения сердечной мышцы в каждый данный момент, но это и не очень важно для наших целей. В любом случае зависимость развития активного напряжения от длины мышцы является фундаментальным свойством сердечной мышцы, которое оказывает исключительно важное воздействие на функцию сердца
Изотоническое сокращение и сокращение с постнагрузкой. Во время сокращения, называемого изотоническим («с фиксированной нагрузкой»), мышца сокращается, преодолевая постоянную нагрузку Мышца сокращается изотонически при подъеме определенной массы, например, масса в 1 г, как показано на рис. 3-9 Данная масса в 1 г, помещенная на мышцу, приведет к определенному изменению ее длины в покое, что можно охарактеризовать кривой зависимости напряжения от длины мышцы в покое
Если бы мышца изометрически сокращалась при данной длине, то она была бы способна создать определенное напряжение, например, 4,5 г, как показано пунктирной линией на графике рис. 3-9.
Сократительное напряжение величиной в 4,5 г, очевидно, не может возникнуть при подъеме массы в 1 г. Когда мышца обладает сократительным потенциалом, превышающим то напряжение, которое она реально развивает, то мышца укорачивается. Таким образом, при изотоническом сокращении длина мышцы уменьшается при постоянном напряжении, как показано горизонтальной стрелкой из точки 1 в точку 3 на рис. 3-9.
По мере сокращения мышцы, между тем, ее сократительный потенциал уменьшается, как изображено нисходящей частью кривой максимального изометрического напряжения на рис. 3~9. Существует определенная небольшая длина, при которой
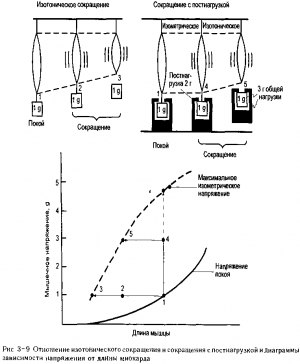
мышца способна создавать напряжение величиной только в 1 г, и когда данная длина достигнута, дальнейшее сокращение должно быть прекращено" . Таким образом, кривая диаграммы зависимости напряжения от длины сердечной мышцы, которая показывает, насколько большое изометрическое напряжение способна развить мышца при различных величинах длины, также указывает предел, до которого может происходить сокращение мышцы при различных нагрузках.
На рис. 3-9 также показан комплексный тип мышечного сокращения, называемого изотоническим сокращением с постнагрузкой, при котором нагрузка на покоящуюся мышцу, преднагрузка, и нагрузка на мышцу во время сокращения, общая нагрузка, различны На примере, изображенном на рис 3-9, преднагрузка равна 1 г и, поскольку дополнительная нагрузка в 2 г (постнагрузка) добавляется во время сокращения, то общая нагрузка составляет 3 г.
Так как преднагрузка определяет длину мышцы в покое, то оба варианта изотонического сокращения, которые показаны на рис 3-9, начинаются с одинаковой длины Из-за различных условий нагрузки, тем не менее, мышца с постнагрузкой должна увеличить общее напряжение до 3 г, прежде чем начнется укорочение Первоначальное напряжение будет развиваться изометрически и его можно представить, как происходящее из точки 1 в точку 4 на диаграмме зависимости напряжения от длины Поскольку мышца генерирует достаточное напряжение, чтобы уравнять общую нагрузку, ее выход напряжения фиксируется на величине в 3 г и теперь мышца будет сокращаться изотонически, поскольку ее сократительный потенциал все еще превышает ее выход по напряжению Это изотоническое сокращение представлено в виде горизонтального отрезка на диаграмме зависимости напряжения от длины вдоль линии из точки 4 в точку 5 Как при любом изотоническом сокращении, укорочение должно прекратиться, когда мышечный потенциал развити^ напряжения существенно уменьшается в результате изменения длины, которая должна быть эквивалентна нагрузке на мышцу
Обратите внимание, что мышца, испытывающая постнагрузку, укорачивается в меньшей степени, чем мышца, не испытывающая постнагрузки, даже в том случае, если обе мышцы начали сокращение при одинаковой первоначальной длине Факторы, которые воздействуют на степень сокращения сердечной мышцы в условиях постнагрузки, представляют для нас особый интерес, поскольку, как мы увидим, ударный объем определяется тем, насколько сильно сокращается сердечная мышца при этих условиях.
Сократительная способность сердечной мышцы. Целая группа факторов, помимо первоначальной длины мышцы, может воздействовать на потенциал образования напряжения сердечной мышцы Любое вмешательство, увеличивающее максимальное изометрическое напряжение, которое может развить мышца при фиксированной длине, считается, что увеличивает сократительную способность сердечной мышцы В этом случае говорят, что такой фактор обладает положительным инотропным эффектом на сердце
Наиболее важным физиологическим регулятором сократительной способности сердечной мышцы является норадреналин. Когда норадреналин освобождается на мембраны клеток сердечной мышцы из симпатических нервов, он оказывает не только хронотропный эффект на частоту сердечных сокращений, что обсуждалось ранее, но и выраженный положительный инотропный эффект, который заставляет клетки сердечной мышцы сокращаться быстрее и интенсивнее.
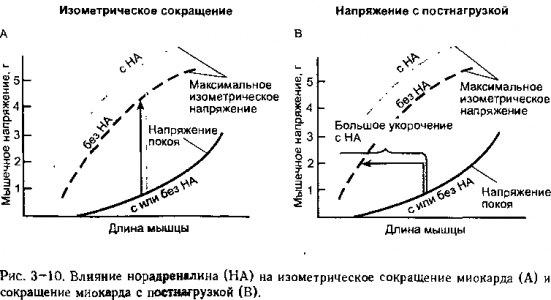
Положительное воздействие норадреналина на изометрический генерирующий напряжение потенциал представлен на рис 3-10, А Когда норадреналин содержится в растворе, омывающем сердечную мышцу, то последняя при любой длине развивает большее по величине изометрическое напряжение при условии стимуляции, чем это происходит при отсутствии норадреналина Кратко говоря, норадреналин увеличивает максимум кривой изометрического напряжения на графике зависимости напряжения от длины сердечной мышцы. Считается, что норадреналин увеличивает сократительную способность сердечной мышцы, так как он усиливает интенсивность сокращения мышцы, даже если ее длина остается постоянной. Изменения сократительной способности и первоначальной длины могут происходить одновременно,но, по определению, изменения сократительной способности подразумевают сдвиг от одного пика изометрической кривой зависимости напряжения от длины к другому.
На рис. 3-10, В показано, как подъем пика изометрической кривой зависимости напряжения от длины под действием норадреналина увеличивает степень сокращения мышцы в условиях постнагрузки. При условии постоянства величин преднагрузки и общей нагрузки при наличии норадреналина происходит более мощное сокращение, чем в условиях отсутствия медиатора. Так происходит, потому что, когда сократительная способность возрастает, потенциал образования напряжения равен общей нагрузке при меньшей длине мышцы. Обратите внимание, что норадреналин не оказывает воздействия на зависимость напряжения от длины в условиях покоя Таким образом, норадреналин вызывает более мощное сокращение путем изменения конечной, а не начальной длины мышцы при сокращении в условиях постнагрузки
Клеточный механизм воздействия норадреналина на сократительную способность обусловлен его взаимодействием с [^-адренергическим рецептором. Путь прохожде-
ния сигнала включает активацию 0,,-протеин-цАМФ-протеинкиназы А, которая фосфорилирует Са2+ канал, увеличивая поток кальция внутрь клетки на этапе плато потенциала действия Это увеличение притока кальция не только обусловливает увеличение внутриклеточного содержания Са2+ при данном сокращении, но также приводит к депонированию кальция в клетке, что позволяет использовать данный ион в большем количестве во время последующей деполяризации Это увеличение содержания свободного Са2+ во время активации позволяет образоваться большему количеству поперечных мостиков и развиться большему напряжению
Поскольку норадреналин также вызывает фосфорилирование регуляторного белка, фосфоламбана, на кальциевом АТФазном насосе саркоплазматического ретикулума, скорость возврата кальция в SR возрастает и интенсивность расслабления также увеличивается Это явление носит название положительного батмотропного эффекта Таким образом, в присутствии катехоламинов систолическое сокращение не только более мощное, но и более краткое по времени12 13
Показано, что увеличение парасимпатической активности оказывает на сердце небольшой отрицательный инотропный эффект Предполагается, что в предсердии, где данное воздействие наиболее выражено, отрицательный инотропный эффект возникает благодаря сокращению времени потенциала действия и уменьшению количества Са2+, которое поступает в клетки во время потенциала действия
Изменение частоты сердечных сокращений также оказывает влияние на сократительную способность сердца Помните, что небольшое количество внеклеточного Са2+ поступает в клетки во время фазы плато каждого потенциала действия По мере увеличения частоты сердечных сокращений, в клетки поступает большее количество Са2+ в минуту Происходит накопление внутриклеточного Са2+ и большее количество Са2+ поступает в саркоплазматический ретикулум при каждом потенциале действия Таким образом, вслед за внезапным увеличением частоты сердечных сокращений следует прогрессирующее увеличение силы сокращения до уровня высокого плато Такое явление носит название феномена лестницы (или tгерре) Изменения сократительной способности, возникающие в результате внутреннего механизма, иногда обозначаются как гомометр инее кая ауторегуляция Значение такой, связанной с частотой сердечных сокращений, модуляции сократимости при нормальной деятельности желудочков в настоящее время остается неясным
Сократительная способность изолированной сердечной мышцы часто оценивается по максимальной скорости сокращения препарата мышцы во время изотонических сокращений при различных вариантах общей нагрузки Полученные данные используются для создания так называемой зависимости скорости от силы мышцы, как показано на рис 3-11 А Зависимость скорости от силы указывает на замену развития силы скоростью сокращения, заложенную в механизме сокращения всех мышц На изометрическую способность мышцы генерировать силу указывает точка, где кривая

пересекает ось силы Точка, где кривая зависимости скорости от силы пересекает ось скорости, носит название Утах Эта точка Vmax тесно коррелирует с активностью актинмиозиновой АТФазы мышцы и как считается, указывает на максимально возможную скорость взаимодействия между тонкими и толстыми нитями в пределах саркомера Значение Утах обычно используют как показатель сократительной способности изолированной сердечной мышцы
На рис З-il В показано влияние норадреналина (или другого инотропного фактора) на зависимость скорости от силы Обратите внимание, что как пик изометрического напряжения, так и Утах возрастают по мере увеличения сократительной способности экспериментального препарата