Введение
Смертность от сердечно-сосудистых заболеваний в России является одной из наиболее высоких в мире и составляет 1462 на 100.000 жителей в год. Смертность от сердечно-сосудистых заболеваний в РФ является одной из наиболее высоких в мире и составляет 1462 на 100.000 жителей в год. Основные причины смерти от сердечно-сосудистых заболеваний - прогрессирование хронической сердечной недостаточности (около половины всех летальных исходов) и внезапная сердечная смерть (ВСС) (другая половина). Согласно расчетным данным в РФ внезапно от сердечных причин ежегодно умирает 200.000-250.000 человек. Соответственно, проблема ВСС крайне актуальна для отечественного здравоохранения. Интерес к этой теме обусловлен и тем фактом, что частота ВСС имеет тенденцию к увеличению. Очевидно так же и то, что существует возможность использования эффективных профилактических мер, направленных на улучшение ситуации.
Существует представление об основных и второстепенных факторах риска ВСС.
Выявление основных факторов риска предполагает выбор в пользу более агрессивных методов профилактики ВСС (проведение интервенционного и/или хирургического лечения).
Наличие второстепенных факторов риска ВСС предполагает использование более сдержанной тактики, которая заключается в модификации факторов риска развития основного заболевания у конкретного больного (например, отказ от курения, снижение массы тела) и оптимизации его медикаментозного лечения.
Терминология
Следует различать внезапную сердечную смерть (внезапная смерть от сердечной причины) и внезапную смерть. Критерии диагностики последней сходны с определением ВСС, с тем отличием, что внезапная смерть развивается в результате некардиальных причин, в частности таких как массивная тромбоэмболия легочной артерии, разрыв аневризмы сосудов головного мозга и т.д.
Желудочковая тахикардия двунаправленная – ЖТ с альтернацией электрической оси сердца во фронтальной плоскости; ее развитие часто связано с интоксикацией сердечными гликозидами.
Желудочковая тахикардия мономорфная – ЖТ, имеющая неизменную морфологию комплекса QRS в 12 отведениях поверхностной ЭКГ.
Желудочковая тахикардия неустойчивая (НЖТ) – ЖТ, состоящая как минимум из 4-х желудочковых комплексов, максимальной продолжительностью не более 30 с, которая прекращается самостоятельно.
Желудочковая тахикардия по типу torsades de pointes – ЖТ, которая обычно ассоциируется с удлинением интервалов QT или QTc. ЭКГ во время аритмии характеризуется «скручиванием» направленности комплексов QRS относительно изоэлектрической линии.
Желудочковая тахикардия полиморфная – ЖТ, во время которой в 12 отведениях поверхностной ЭКГ изменяется конфигурация комплекса QRS. Частота активации желудочков на фоне ЖТ находится в диапазоне от 100 до 250 в минуту.
Желудочковая тахикардия с циркуляцией импульса по ножкам пучка Гиса по механизму реентри (bundle-branch re-entrant tachycardia) – развивается вследствие реализации механизма реентри в системе Гиса-Пуркинье. Обычно, на поверхностной ЭКГ регистрируется ЖТ с конфигурацией комплекса QRS по типу блокады левой ножки пучка Гиса (БЛНПГ); выскочастотная (около 200 ударов в минуту); часто возникает у пациентов с ДКМП.
Желудочковая тахикардия устойчивая (УЖТ) – это ЖТ продолжительностью более 30 с, зачастую не купирующаяся спонтанно.
Желудочковые нарушения ритма гемодинамически нестабильные – ФЖ, ТЖ, устойчивая/неустойчивая ЖТ и/или желудочковая экстрасистолия, которые сопровождаются выраженными гемодинамически значимыми клиническими проявлениями (головокружение, пресинкопе, синкопе, гипотензия, прогрессирование проявлений сердечной недостаточности, стенокардия).
Желудочковые нарушения ритма гемодинамически стабильные – устойчивая/неустойчивая ЖТ и/или желудочковая экстрасистолия (ЖЭ), которые сопровождаются минимальными клинически проявлениями (например, легкое головокружение, ощущение сердцебиения, тенденция к гипотонии).
Остановка кровообращения (остановка сердца) – прекращение сердечно-сосудистой деятельности.
Отношение шансов – мера выраженности связи между состоянием или воздействием и заболеванием или исходом. Шанс возникновения события является отношением между вероятностью его появления и вероятностью его непоявления. Отношение шансов вычисляется в результате деления вероятности появления события в одной группе на вероятность его появления в другой.
Пенетрантность – популяционное понятие, означает долю индивидов, у которых имеются проявления какого-либо признака (заболевания), среди всех лиц, обладающих мутацией в заинтересованном гене;
Пробанд – первый член семьи, который/по поводу которого проводится медико-генетическое консультирование;
Профилактика внезапной сердечной смерти – это комплекс мероприятий, проводимых у лиц, переживших сердечный арест (вторичная профилактика) или у пациентов без эпизодов сердечного ареста в анамнезе, имеющих высокий риск развития ВСС (первичная профилактика).
Распространенность заболевания – доля лиц в популяции, имеющих данное заболевание в данный период времени
Риск относительный – отношение частоты возникновения события в исследуемой группе к частоте возникновения события в контрольной группе
Сердечный арест – это прекращение сердечно-сосудистой деятельности вследствие желудочковой тахикардии и/или фибрилляции желудочков, документированных электрокардиографическим способом (без ЭКГ-верификации не существует дефиниции).
Трепетание желудочков – организованная (колебания длины цикла не превышают 30 мс) желудочковая аритмия с частотой активации желудочков около 300 в минуту (длина цикла – 200 мс), характеризующаяся мономорфной конфигурацией комплексов QRS на поверхностной ЭКГ и отсутствием изоэлектрического интервала между соседними желудочковыми комплексами.
Факторы риска – это клинические признаки, указывающие на вероятность развития ВСС у конкретного пациента в текущем календарном году.
Фибрилляция желудочков – высокочастотный, обычно более 300 ударов в минуту (длина цикла составляет 180 мс и менее) нерегулярный желудочковый ритм с выраженной вариабельностью длины цикла, морфологии и амплитуды комплексов QRS.
Частота встречаемости (инцидентность) заболевания – доля лиц в популяции, у которых заболевание возникает в течение определенного промежутка времени.
Экспрессивность – степень количественной выраженности какого-либо признака (заболевания).
Эффект аритмогенный – прямой результат непредсказуемого электрофизиологического действия антиаритмического препарата на клетки проводящей системы сердца и миокарда, обуславливающий появление новых аритмий
Эффект проаритмический – утяжеление клинического варианта течения и/или ухудшение характеристик предсуществующей аритмии, вследствие назначения антиаритмической терапии
Определение
Под внезапной смертью понимают ненасильственную смерть, развившуюся моментально или наступившую в течение часа с момента возникновения острых изменений в клиническом статусе больного.
Эпидемиология
Данные официальных статистических отчетов в РФ (Центральная база статистических данных Федеральной службы государственной статистики, www.gks.ru/dbscripts/Cbsd) не содержат информации относительно ВСС в структуре смертности населения России. Расчетные данные, составленные с учетом коэффициентов, полученных в ходе эпидемиологических исследований в США и стран Европы, свидетельствуют о широком диапазоне возможной частоты ВСС в России в год – от 141 тысяч человек до 460 тысяч. Однако более реальными представляются значения 200-250 тысяч человек в год.
Первые эпидемиологические исследования ВСС на территории бывшего СССР были выполнены в 70-х годах прошлого столетия в рамках программы ВОЗ «Регистр острого ИМ». На 100 000 населения г. Москвы авторами зарегистрировано 78 внезапных смертей у мужчин и 37 – у женщин. Чуть позже сходные данные были получены и в г. Новосибирске и г. Вологде. Эти исследования выявили ряд эпидемиологических особенностей, в частности они установили отчетливую ассоциацию ВСС с распространенностью инфаркта миокарда, а также установили отчетливое преобладание ВСС у мужчин по сравнению с женщинами. Соотношение внезапно умерших мужчин к женщинам составило 2,1-6,6:1.
Недавно закончившееся крупное отечественное исследование РЕЗОНАНС, проведенное в трех российских городах (Рязань, Воронеж, Ханты-Мансийск) и включившее популяцию больных с ИБС численностью 285 736 человек, было 9 спланировано с целью уточнения распространенности ВСС, а также качества диагностики и статистического учета ВСС в медицинских учреждениях. Согласно диагнозам, зарегистрированным в медицинских свидетельствах о смерти, частота ВСС на фоне ИБС составила в мужской популяции - 69 случаев на 100 000 мужского населения в год, в женской – 26 на 100 000 женского населения в год. Однако более детальный дополнительный анализ медицинской документации, опроса родственников, свидетелей смерти, а также лечащих врачей и врачей из бригад скорой медицинской помощи привел к выводу, что уточненная частота ВСС в 2,3 у мужчин и в 2,8 раза у женщин выше зарегистрированного официального уровня и составляет соответственно 156 и 72 случая на 100 000 населения в год. Таким образом в отечественном практическом здравоохранении не выявляется каждый второй случай ВСС у больных ИБС мужского пола, и 2/3 – у больных ИБС женского пола, что приводит к недооценке вероятности развития ВСС в популяции. Основными причинами такого недоучета ВСС у больных ИБС признаны недостаточно активно проведенный диагностический поиск при установлении причины смерти (45,4%) и ошибки оформления медицинской документации (55,6%).
По данным другого российского исследования, проведенного в общей популяции г. Москвы, среди всех причин смерти, наступившей вне медицинских учреждений, доля ВСС достигает 39,4% и соответствует 92,5 случаям на 100.000 жителей
в год.
В США ежегодный показатель ВСС составляет от 1 до 2 случаев на 1000 населения, что в абсолютных числах соответствует 200 000 - 450 000 человек. Такие колебания, в основном, обусловлены различиями используемых критериев включения, в первую очередь, связанных с разными временными рамками синдрома ВСС (от 24 часов, применявшихся в 1980-1990 гг., до 1 часа – в современных рекомендациях). Усредненные эпидемиологические показатели в США свидетельствуют о том, что доля ВСС (при условии 1 часового критерия включения) в структуре общей смертности составляет около 13%, а в смертности от болезней системы кровообращения – около 40%. В то же время результаты голландского исследования, в котором использовался 24-часовой критерий диагностики, показали, что частота ВСС составила 18,5% среди всех смертей. В упоминавшемся российском исследовании РЕЗОНАНС в качестве верхнего временного критерия ВСС был признан 12 ч, а расчетная доля ВСС в структуре общей смертности составила 16,3%.
В Европе частота ВСС в целом сопоставима с таковой в США, вместе с тем, она значительно колеблется в различных европейских странах в зависимости от 10 экономического и географического положения. Кроме того, прослеживается отчетливая взаимосвязь между частотой ВСС и возрастом, полом и распространенностью ИБС. Подавляющее большинство случаев (80-85%) ВСС ассоциировано с ИБС, причем более половины из них связано с острым нарушением коронарного кровообращения. Абсолютное количество случаев ВСС больше у мужчин и увеличивается пропорционально с возрастом в популяции, однако доля ВСС в структуре общей смертности максимальна у лиц в возрасте 35-44 лет. В этом же исследовании было показано, что в 80% случаев смерть наступает в домашних условиях, еще в 15% - на улице или в публичном месте. Более чем в трети случаев смерть наступает без свидетелей.
Таким образом, лишь незначительное число пациентов умирают в присутствии медицинских работников и теоретически имеют больше шансов на успешные реанимационные мероприятия и, соответственно, выживание. Эти данные приводят к выводу, что основные мероприятия должны быть сконцентрированы на выявлении групп повышенного риска ВСС и проведении профилактических мероприятий.
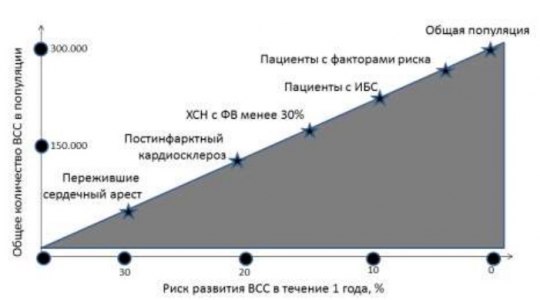
Частота развития и абсолютное число ВСС в общей популяции и специфических группах пациентов (адаптировано из R.J. Myerburg и соавт., 1992). К общей популяции относится неселективная группа пациентов старше 35 лет, подгруппы высокого риска составляют пациенты с множеством факторов риска развития первого коронарного события. Частота развития ВСС минимальна в общей популяции лиц, в которой регистрируется наибольшее число таких смертей. В группах риска доля ВСС наибольшая, но в абсолютных цифрах она значительно меньше таковой в общей популяции.
Актуальность этого положения наглядно демонстрирует рисунок. Частота развития ВСС минимальна в общей популяции , однако, именно среди лиц этой категории регистрируется наибольшее число таких смертей. И, наоборот, в группе наиболее высокого риска ВСС, например, у лиц, перенесших остановку сердца, и/или инфаркт миокарда и имеющих желудочковые нарушения ритма, доля ВСС максимальна, но в абсолютных цифрах она значительно меньше таковой в общей популяции.
Эти данные, впервые продемонстрированные почти 20 лет назад, сохраняют актуальность и в настоящее время. Они свидетельствуют, с одной стороны, о том, что эффективность предупреждения ВСС за это время изменилась явно недостаточно, с другой – что крайне важен поиск новых критериев, которые позволили бы идентифицировать группу повышенного риска в общей популяции.
Численность (2009 г.) и смертность (2010 г.) населения в России
Показатель | Общее число, n | Доля, % |
|---|
Численность постоянного населения | 141 909 244 |
|
|---|
Общее число умерших лиц | 2 028516 | 100,0 |
|---|
Число умерших от естественных причин | 1 711 528 | 84,4 |
|---|
Число умерших от болезней системы кровообращения | 1 151 917 | 56,8 |
|---|
Расчетное число умерших лиц по механизму ВСС | 141 909 – 460 766 |
|---|
Профилактика
Профилактика ВСС – это комплекс мероприятий, проводимых с целью предупреждения или уменьшения вероятности развития ВСС, который осуществляется у лиц переживших сердечный арест (вторичная профилактика) или у пациентов без эпизодов сердечного ареста в анамнезе, но имеющих факторы риска развития ВСС (первичная профилактика). Профилактика риска ВСС должна включать в себя модификацию факторов риска развития заболеваний, а также проведение адекватного медикаментозного лечения основной и сопутствующей патологии. Современная эффективная профилактика ВСС основана на комплексном подходе, включающем в себя применение медикаментозных, интервенционных и хирургических методов профилактики ВСС. Объем проводимых профилактических мероприятий будет определяться в зависимости от того к какой категории будет отнесен каждый конкретный пациент.
Интервенционные методы.
В этом подразделе обсуждаются современные возможности применения различных интервенционных методов в профилактике ВСС. Использование каждого из них имеет различный класс показаний и уровень доказательности и определяется нозологической формой основного заболевания, ФК сердечной недостаточности, состоянием систолической функции миокарда ЛЖ, клинической симптоматикой, наличием нарушений ритма.
Имплантация кардиовертера-дефибриллятора
Современный имплантируемый кардиовертер-дефибриллятор (ИКД) представляет собой систему, состоящую из устройства, которое заключено в небольшой титановый корпус, который размещается подкожно или подфасциально в левой подключичной области и одного или более электродов, установленных в камерах сердца. На сегодняшний день применяются одно-, двух- и трехкамерные (бивентрикулярные) системы. В большинстве аппаратов само устройство, заключенное в титановую коробку, является частью цепи разряда дефибриллятора.
В основе детекции аритмий лежит анализ интервала R-R, формы желудочкового сигнала, стабильности RR-интервала, соотношения характеристик предсердной и желудочковой активности (в двухкамерных системах). Входящий сигнал проходит фильтрацию, в результате которой элиминируются и не подвергаются детекции низкочастотные (обусловленные Т-волной) и высокочастотные компоненты (обусловленные активностью скелетной мускулатуры).В дефибрилляторах существуют различные зоны детекции частоты сердечных сокращений. Например, если частота аритмии попадает в т.н. зону фибрилляции желудочков (где частота сокращений желудочков превышает 200 в минуту), то происходит разряд дефибриллятора для терапии ФЖ или высокочастотной ЖТ.
В т.н. зоне ЖТ возможно проведение различных видов антитахикардической желудочковой стимуляции для подавления аритмий. Так, гемодинамически незначимая, относительно медленная ЖТ, регистрируемая в низкочастотной зоне детекции, может быть успешно купирована антитахикардитической стимуляцией. ЖТ может быть купирована в режиме BURST (стимуляция короткими пачками импульсов с частотой, на 10-30% превышающей частоту тахикардии), RAMP (стимуляция импульсами с постепенно увеличивающейся частотой, при которой каждый последующий импульс укорачивает цикл стимуляции по сравнению с предыдущим) или RAMP+ (стимуляция одиночным сканирующим экстрастимулом, который наносится в зависимости от длины цикла тахикардии установленным интервалом сцепления). При их неэффективности выполняется кардиоверсия. В т.н. нормосистолической зоне (ЧСС находится в диапазоне 40-150 ударов в минуту) ИКД детектирует ритм, а в брадисистолической зоне (ЧСС ниже 40 ударов в минуту) аппарат осуществляет электрокардиостимуляцию в запрограммированном врачом режиме.
Виды антитахикардитической стимуляции. На панеле А схематично представлен Burst режим АТС. Длина цикла ЖТ (интервал R-R) составляет 400 мс. АТС проводится с фиксированной длиной цикла (интервал Vp-Vp) 320 мс, составляющий 80% от длины цикла ЖТ. На панеле Б схематично представлен Ramp режим АТС. Длина цикла ЖТ (интервал R-R) составляет 400 мс. Проводится стимуляция импульсами с постепенно увеличивающейся частотой при которой каждый импульс укорачивает цикл стимуляции по сравнению с предыдущим на 10 мс. На панеле В схематично представлен Ramp+ или сканирующий режим АТС. Длина цикла ЖТ (интервал RVT-RVT) составляет 400 мс. Проводится стимуляция одиночным сканирующим экстрастимулом (Vp), который наносится в зависимости от длины цикла тахикардии. В данном примере сканирующий экстрастимул прерывает ЖТ.
Параметры детекции и алгоритмы терапии для каждой зоны устанавливаются во время тестирования устройства с помощью программатора. В зависимости от клинической ситуации, проводимой медикаментозной терапии эти значения, в дальнейшем, могут корригироваться. Для предотвращения неоправданных разрядов во время суправентрикулярных аритмий, синусовой тахикардии применяются функции анализа стабильности RR интервала (при тахисистолической форме фибрилляции предсердий), морфологии эндографического желудочкового сигнала, регистрируемого желудочковым электродом. Существует возможность оценить внезапность начала тахиаритмии (при возникновении ЖТ или ФЖ величина интервала RR внезапно уменьшается), а также зарегистрировать эндографические сигналы в предсердиях и желудочках. Подбор терапии ИКД определяется врачом на основании переносимости больным клинической тахикардии. Так при гемодинамически значимой быстрой ЖТ или ФЖ первым шагом в терапии является дефибрилляция мощностью на 10 Дж превышающей интраоперационный порог дефибрилляции с последующим автоматическим нарастанием мощности разрядов до максимальных значений (40 Дж), а также изменением полярности в цепи дефибрилляции от корпуса ИКД к внутрисердечному электроду и наоборот.
Эффективность ИКД в отношении профилактики ВСС была доказана в нескольких крупных клинических исследованиях дизайн которых предполагал оценку выживаемости у пациентов с наличием основных факторов риска ВСС, выделенных JT Bigger еще в 1984 г. Результаты, полученные в этих исследованиях, легли в основу существующих сегодня Американских и Европейских рекомендаций по имплантации этих устройств и Рекомендаций по лечению желудочковых аритмий с целью профилактики ВСС.
Таким образом, новые подходы к проведению первичной профилактики ВСС требуют возможности осуществлять профилактическую дефибрилляцию у значительного числа пациентов. С практической точки зрения эта ситуация подразумевает возможное нанесение одного разряда у одного больного за относительно продолжительный период времени, например составляющий несколько лет. В этой связи клиническое использование новых ИКД-технологий, в разработке которых приняли участие, в том числе и отечественный ученные, приобретает важное клиническое значение.
Радио-частотная аблация.
Катетерная РЧА является одной из интервенционных методик, способной эффективно устранить или модифицировать субстрат одного из главных факторов риска, а именно ЖТ и/или ФЖ. Целесообразность ее применения определяется этиологией аритмического синдрома, вариантом его течения. Проведение РЧА оправдано у пациентов с частыми шоковыми разрядами ИКД при развитии т.н. «электрического шторма» (более 3 оправданных шоковых разрядов ИКД в течение 24 часов), обусловленного устойчивой рецидивирующей ЖТ, рефрактерной к множественной ААТ. Тем не менее, на сегодняшний день, данные об эффективности РЧА в отношении профилактики ВСС ограничены, во многом из-за того, что группа пациентов с ЖТ является неоднородной и проведение рандомизации у этой категории пациентов затруднено.
В связи с вышесказанным заслуживают внимания данные мета-анализа 5 исследований по оценки эффективности РЧА ЖТ, опубликованные в 2012 г., в котором анализировались данные о 457 пациентах со структурной патологией сердца (в основном ишемического генеза). В исследовании проводился сравнительный анализ влияния РЧА и ААТ на течение аритмического синдрома и смертность (без уточнения ее механизма), оценивалась частота развития осложнений при проведении РЧА ЖА. Результаты мета-анализа показали, что РЧА ЖА достоверно приводит к снижению количества эпизодов ЖТ, количества эпизодов срабатывания ИКД. Тем не менее, проведение РЧА не сопровождается уменьшением смертности (в т.ч. и внезапной). При обсуждении полученных результатов авторы отдают себе отчет в том, что многие публикации, вошедшие в этот мета-анализ, имели описательный характер, а доля рандомизированных исследований была ограничена.
Несмотря на тот факт, что публикации, посвященные результатам РЧА неишемических ЖНР в т.ч. у пациентов с АДПЖ, ДКМП, каналопатиями свидетельствуют о положительном влиянии интервенционного вмешательства на течение аритмического синдрома, однозначно судить о роли РЧА в профилактике ВСС сегодня не представляется возможным. Число пациентов, принимавших участие в этих исследованиях относительно невелико, а периоды клинического наблюдения за ними были непродолжительными.
Таким образом, сегодня РЧА является наиболее эффективным методом лечения у пациентов с ЖНР и отсутствием структурной патологии сердца. Улучшение гемодинамических параметров, возникающее после проведения РЧА идиопатической ЖЭ, может рассматриваться как важная позитивная модификация такого фактора риска ВСС как систолическая дисфункция. Тем не менее, в эпоху доказательной медицины для подтверждения этого предположения необходимы данные рандомизированных исследований с длительным периодом наблюдения за этой категорией пациентов.
Хирургическое лечение аритмий
Методики прямого хирургического иссечения или резекции аритмогенного очага по-прежнему используются в ведущих хирургических центрах у пациентов с рецидивирующей ЖА, рефрактерной к множественной ААТ; у пациентов с ИКД и частыми шоковыми разрядами; у больных с неэффективностью от проведенной РЧА. Хирургическое лечение обусловливает необходимость тщательной предоперационной подготовки и интраоперационного определения источника или источников тахикардии. Для элиминации аритмогенных участков в ряде центров используют подход, основанный на резекции рубцовых полей в миокарде. Поскольку такие вмешательства довольно травматичны, то используемые сегодня в клинической практике операции эндокардиальной резекции постинфарктного рубца, круговой эндокардиальной вентрикулотомии и эндовентрикулопластики, как правило, сочетаются с аорто-коронарным шунтированием. Во время хирургического вмешательства также могут использоваться эндокардиальная РЧА, криодеструкция очагов аритмии.
Таким образом, при рецидивирующей ЖТ на фоне терапии ИКД, рефрактерной к медикаментозной терапии и катетерной РЧА, возможна хирургическая резекция очага ЖТ или его прямая РЧА или криодеструкция.
У пациентов с врожденным синдромом удлиненного интервала QT (LQTS) выполнение левой шейно-грудной симпатической ганглиоэктомии используется как дополнительный метод лечения при частых эпизодах терапии ИКД или при непереносимости бета-блокаторов.
Реваскуляризация миокарда с целью лечения аритмий
Развитие ЖА напрямую связано с острой или хронической ИБС. В этой связи хирургическая или интервенционная реваскуляризация гибернирующего миокарда может улучшить электрическую стабильность и снизить вероятность развития желудочковых аритмий. Таким образом, скрининговая диагностика и лечение ишемии сердца должны быть первыми этапами стратификации риска и профилактики ВСС, поскольку после реваскуляризация жизнеспособного миокарда может модифицировать такой основной фактор риска ВСС как сократительная дисфункция ЛЖ. У ряда постинфарктных пациентов жизнеугрожающие ЖНР могут быть устранены реваскуляризацией миокарда, но только в том случае, если они провоцируются ишемией. Снизить частоту ЖТ/ФЖ в острый период инфаркта миокарда позволяет и ранняя реваскуляризация миокарда в сочетании с назначением бета-блокаторов.
Тем не менее, у значительного числа больных, несмотря на проведенную реваскуляризацию миокарда, риск развития ВСС в течение года составляет 13%. Следует понимать, что у больных с большой площадью рубца восстановление ФВ ЛЖ менее вероятно, и имплантация ИКД может потребоваться уже вскоре после проведения реваскуляризации.
Обзор исследований, посвященных данной проблеме, свидетельствует о том, что реваскуляризация миокарда приводит к увеличению выживаемости и снижению частоты развития ВСС в отдаленном периоде наблюдения. Если течение ИБС осложняется развитием ЖА, особенно у пациентов с поражением ствола левой коронарной артерии и проксимальных отделов передней межжелудочковой ветви, то существует высокая вероятность того, что реваскуляризация миокарда позволит снизить частоту развития и уменьшить тяжесть течения аритмического синдрома, а у некоторых пациентов полностью его устранит.
На наш взгляд отдельного внимания заслуживает вопрос проведения реваскуляризации у пациентов с ишемической этиологией ХСН без клинически ведущих проявлений стенокардии с целью первичной и вторичной профилактики ВСС. В отношении этой категории больных крайне ограничены данные о влиянии реваскуляризации не только на частоту ВСС, но и также на общую выживаемость.
В этом контексте диагностическое обследование больных с ХСН ишемического генеза должно включать и оценку жизнеспособности миокарда. Так в целом ряде проспективных и ретроспективных исследований, а также мета-анализов было продемонстрировано, что у больных с ишемизированным, но все еще жизнеспособным миокардом, после проведения реваскуляризации отмечается улучшение сократительной функции ЛЖ и характеристик выживаемости. Напротив, у больных без жизнеспособного миокарда реваскуляризация неэффективна, а значит, следует избегать выполнения крайне рискованной операции. Стандартной методикой для оценки анатомии миокарда, его региональной и общей сократительной функции, жизнеспособности и, что еще важнее, размеров инфаркта и процента трансмурального поражения (определяемого с поздним гадолиниевым усилением) является ядерно-магнитный резонанс.
Выбор между основными методами прямой реваскуляризации (АКШ или интервенционная ангиопластикой) должен основываться на тщательной оценке анатомии коронарных поражений, ожидаемой «полноты» реваскуляризации, характера сочетанных заболеваний и наличия или отсутствия сопутствующего выраженного клапанного поражения сердца.
Тем не менее, проведение успешной реваскуляризации у больных ИБС с систолической дисфункцией, не снимает с повестки актуальность мероприятий по профилактике ВСС и имплантации ИКД.
Рекомендации для больных с хронической сердечной недостаточностью и систолической дисфункцией ЛЖ (ФВ ≤35%), с преобладанием симптомов стенокардии
| Класс показаний | Доказательность |
Выполнение ЧКВ возможно при подходящей анатомии и при наличии жизнеспособного миокарда. | IIb | C |
Рекомендации для больных с хронической сердечной недостаточностью и систолической дисфункцией ЛЖ (ФВ ≤35%), с преобладанием симптомов сердечной недостаточности (стенокардии на уровне I-II класса или ее отсутствие)
| Класс показаний | Доказательность |
Выполнение ЧКВ возможно при подходящей анатомии и при наличии жизнеспособного миокарда. | IIb | C |
В отсутствие доказанного наличия жизнеспособного миокарда реваскуляризация не рекомендуется. | III | B |
Медикаментозные методы
Использование различных групп медикаментозных средств с целью первичной или вторичной профилактики ВСС имеет различный класс показаний и уровень 18 доказательности и определяется нозологической формой основного заболевания, ФК ХСН, состоянием систолической функции миокарда ЛЖ, клинической симптоматикой, характером нарушений ритма. С этой целью могут использоваться как препараты, относящиеся к средствам лечения основного заболевания, так, собственно, антиаритмические препараты (ААП).
Бета-адреноблокаторы.
Положительное влияние бета-блокаторов и их разнообразные эффекты хорошо изучены в экспериментах и в клинике. Антиаритмический эффект бета-блокаторов связывают как с их антиишемическим действием, так и со снижением симпатической активности. Мета-анализ 25 исследований, касающихся оценки влияния данных препаратов на выживаемость у постинфарктных больных, включавший почти 25000 больных, выявил, что назначение бета-блокаторов сопровождается увеличением выживаемости, снижением общей и сердечно-сосудистой летальности, а также уменьшением частоты развития ВСС. Положительные эффекты бета-блокаторов в отношении ЖА и ВСС также доказаны и для больных с ХСН ишемической и неишемической природы (ДКМП, ГКМП, синдромом удлиненного QT, катехоламинергической полиморфной ЖТ, АДПЖ, аортальным стенозом). Преимущество ББ заключается также в том, что их можно сочетать с другими ААП, в частности, - с амиодароном. Выбор бета-блокатора и подходы к титрованию доз определяются основным заболеванием, которое имеется у больного (перенесенный ОИМ, ХСН, АГ и другие). Таким образом, бета-блокаторы являются эффективным и, при надлежащем отборе больных и подходах к подбору доз, безопасными средствами, имеют самую большую доказательную базу и в настоящее время должны рассматриваться в качестве препаратов первой линии для проведения первичной и вторичной профилактики ВСС (I, A).
Ингибиторы АПФ и блокаторы ангиотензиновых рецепторов.
Положительные эффекты ингибиторов АПФ на течение ИБС хорошо известно. Эта группа препаратов влияет на электрофизиологические процессы в миокарде, воздействуя на функцию К- и Са-каналов, а также увеличивают рефрактерность и реполяризацию миокарда желудочков, предупреждая развитие аритмий по механизму ре-ентри, у больных с ХСН и ФЖ ишемического генеза. Антиаритмическое действие иАПФ также объясняется их угнетающим действием на симпатическую нервную систему. Они ингибируют циркулирующие катехоламины и ангиотензин-2, повышают уровень калия в крови. В нескольких работах было показано, что иАПФ повышают чувствительность барорефлекса и улучшают показатели ВСР. Наконец, антиаритмический эффект иАПФ может объясняться противовоспалительными свойствами и уменьшением выраженности процессов постинфарктного ремоделирования миокарда на фоне их применения.
Доказательства положительного влияния иАПФ на выживаемость больных, перенесших ОИМ, а также на больных с сердечной недостаточностью как ишемической, так и неишемической природы получены в большом количестве клинических исследований, показавших, что иАПФ достоверно снижают общую и сердечно-сосудистую летальность у данной категории пациентов. Однако, в отличие от бета-блокаторов в большинстве этих клинических испытаний, ВCС в качестве конечной точки не рассматривалась. Исключением является рандомизированное исследование TRACE, в котором изучалось влияние трандолаприла на ВCС, где был доказан положительный результат. Следует заметить, что верификация механизма смерти, особенно при ВСС, представляет известные трудности, особенно – в клинических исследованиях, когда случаи смерти, как правило, оцениваются ретроспективно. Вместе с тем, не вызывает сомнений тот факт, что почти половина больных ИБС, в особенности лица перенесшие ОИМ, погибают внезапно. Очевидно, мы имеем право экстраполировать полученные убедительные результаты о снижении с помощью иАПФ сердечно-сосудистой летальности и на ВСС. Подтверждением вышесказанному является крупный мета-анализ, целью которого была оценка влияния иАПФ на риск развития ВСС. Результаты этого анализа, включавшего данные 15104 пациентов, принимавших участие в 30 исследованиях (из них 15 были слепые, рандомизированные плацебо-контролируемые), показали, что назначение иАПФ пациентам, перенесшим ИМ, сопровождается уменьшением общей и сердечно-сосудистой смертности, при этом частота развития ВСС снижается на 20% (2356 случаев смерти, из них внезапной - 900). В связи с этим положение об эффективности иАПФ для профилактики ВСС у больных, перенесших ИМ и пациентов с ХСН (систолической дисфункцией) присутствует во всех современных отечественных и зарубежных рекомендациях по профилактике ВСС и имеет самый высокий уровень доказательности (I, A).
Что касается данных об эффективности иАПФ для предупреждения ВСС у больных с сохранной функцией левого желудочка, то информации на эту тему существенно меньше. Имеются результаты нескольких исследований (HOPE, EUROPA), показавших преимущества таких препаратов, как рамиприл и периндоприл в отношении предотвращения ВСС у больных с высоким риском развития сердечно-сосудистых осложнений. Следует отметить, что в этих исследованиях ВСС не рассматривалась в качестве самостоятельной конечной точки. Тем не менее, назначение иАПФ рекомендуются больным ХСН с сохранной функцией левого желудочка, так как предупреждает развитие и прогрессирование ХСН (IIа, B) .
Таким образом, иАПФ также входят в группу препаратов необходимых для профилактики ВСС, прежде всего, у постинфарктных больных и пациентов с сердечной недостаточностью.
Что касается блокаторов ангиотензиновых рецепторов, то в плане снижения смертности при ХСН их доказательная база меньше чем у иАПФ. Известны положительные результаты о снижении риска сердечно-сосудистой смертности у больных с ХСН, получавших валсартан и лозартан. В исследовании CHARM представитель этой группы препаратов – кандесартан у пациентов с ХСН и сниженной систолической функцией миокарда ЛЖ доказал выраженную эффективность в снижении показателей смертности от сердечно-сосудистых причин и характеристик внезапной смертности (15% - снижение риска, р=0,036). Поэтому, по-видимому, в настоящее время кандесартан может использоваться для профилактики ВСС у больных ХСН и сниженной ФВ ЛЖ, наравне с иАПФ. В отношении предупреждения ВСС с помощью блокаторов ангиотензиновых рецепторов у больных с сохранной функцией ЛЖ в настоящее время отсутствуют убедительные данные.
Антагонисты альдостерона.
Ретроспективный анализ исследования SOLVD (6797 больных, 424 случая смерти) продемонстрировал взаимосвязь между применением диуретиков при ХСН и риском ВСС. Причем, при использовании калийсберегающих диуретиков, как отдельно, так и в комбинации с другими мочегонными, такая взаимосвязь не прослеживалась. Исследование RALES (1663 больных) было прекращено досрочно, так как у больных с выраженной ХСН, принимавших спиронолактон, по сравнению с больными, использовавшими петлевые диуретики, через 2 года наблюдения были достоверно ниже показатели общей летальности (35% против 46%) и ВСС (10% против 13%). При этом существенного уменьшения частоты выявления желудочковых аритмий не было отмечено. Показано, что электролитные нарушения, возникающие при назначении некалийсберегающих диуретиков, могут способствовать развитию фатальных аритмий, тогда как антагонисты альдостерона, вероятно, играют протективную роль. В дальнейшем было показано, что антиаритмический эффект данных препаратов более сложен. Блокада альдостероновых рецепторов помимо сохранения калия и магния приводит к устранению системной вазоконстрикции, предупреждает стимуляцию образования коллагена и развитие фиброза в миокарде, а также оказывает влияние на автономную нервную систему, являющуюся активным участником аритмогенеза, улучшая показатели ВСР и повышая чувствительность барорефлекса. В последние годы стали доступны результаты применения нового антагониста альдостерона – эплеренона, которые подтверждают эффективность этой группы препаратов в снижении риска ВСС. Следовательно, для предупреждения ВСС у больных с ХСН в схему терапии рекомендуется включать антагонисты альдостерона (I, A), причем не только при застойной сердечной недостаточности, но и при ХСН II ФК.
Ацетилсалициловая кислота.
Убедительно доказано, что назначение ацетилсалициловой кислоты имеет позитивное значение как для первичной, так и вторичной профилактики коронарных событий. Помимо дезаггрегантных свойств имеет значение противовоспалительное действие препарата, что уменьшает процессы ремоделирования в здоровых тканях. Ретроспективный анализ результатов исследования SOLVD показал, что у больных с ХСН назначение ацетилсалициловой кислоты на 24% снижало частоту развития ВСС. Согласно существующим рекомендациям данный препарат входит в стандарты профилактического лечения как у больных перенесших ОИМ, так и у пациентов со стабильной стенокардией и острым коронарным синдромом (I, A).
Статины.
Обзор данных литературы свидетельствует о существенном снижении сердечно-сосудистой смертности при использования статинов у больных ИБС. В большинстве из проведенных клинических испытаний ВСС, как отдельная конечная точка, не оценивалась. Тем не менее, в исследовании 4S при применении симвастатина наряду с существенным снижением общей смертности и смертности от коронарной болезни сердца отмечалась тенденция к уменьшению частоты ВСС. Аналогичные результаты были получены в отношении правастатина (LIPID). Крупный мета-анализ, включавший 90 000 пациентов, принимавших участие в 14 рандомизированных исследованиях, проведенный до 2005 года, доказал эффективность статинов для профилактики ВСС у больных ИБС. Поэтому в существующих рекомендациях по профилактике ВСС использование статинов у больных ИБС признается необходимым (I, A). Для профилактики развития сердечно-сосудистых осложнений назначение статинов рекомендуется всем больным, относящимся к группе высокого сердечно-сосудистого риска. Что касается применения статинов для профилактики ВСС у пациентов с ХСН неишемической этиологии, то доказательной базы для этой категории больных в настоящее время не существует.
ω3-полиненасыщенные жирные кислоты (ПНЖК).
Первые сообщения об эффективности ПНЖК для профилактики ВСС были получены в исследовании DART, которое продемонстрировало, что у лиц, употреблявших два раза в неделю и более жирную рыбу, наблюдалось 30%-е снижение частоты сердечно-сосудистой летальности, преимущественно за счет уменьшения случаев ФЖ.
В дальнейшем гипотеза была проверена в экспериментах на животных, и в частности, было показано, что ω3- ПНЖК, основные жирные кислоты, присутствующие в жирной рыбе, оказывают протективное действие в отношении ФЖ. Были изучены механизмы антиаритмического действия ω3- ПНЖК, которые заключаются в том, что последние в условиях ишемии или адренергической стимуляции стабилизируют мембрану кардиомиоцитов, влияя на работу натриевых, калиевых и кальциевых ионных каналов, действуя подобно ААП Ib класса (мексилетин-подобное действие), но не обладая при этом проаритмическим и аритмогенным эффектами. С электрофизиологической точки зрения защитное действие от назанчения ω3- ПНЖК заключается в том, что на фоне их применения необходима большая амплитуда электрического экстрастимула для индукции «аритмического» потенциала действия, а также отмечается увеличение длительности эффективного рефрактерного периода кардиомиоцитов, что предупреждает запуск фатальных аритмий, в том числе и ФЖ.
Помимо суррогатного слабовыраженного антиаритмического действия эти препараты обладают противовоспалительным действием, снижают образование кислородных радикалов и уменьшают реперфузионные осложнения, повышают синтез энергии в митохондриях, улучшают эндотелиальную функцию, снижают уровень тромбоксана и агрегацию тромбоцитов. В ряде работ показано, что ω3-ПНЖК увеличивают параметры ФВ ЛЖ и улучшают показатели ВСР, оказывая, таким образом, модифицирующее влияния на основные и второстепенные факторы риска ВСС.
Убедительная доказательная база в отношении ω3-ПНЖК была получена в двух крупных исследованиях. В исследовании GISSI-prevenzione у больных с ОИМ применение омакора в дозе 1 г/сут сопровождалось достоверным снижением риска ВСС на 45 %, сердечно- сосудистой смертности на 30% и уменьшением риска общей смерти на 20%. Результаты многоцентрового двойного слепого плацебо-контролируемого исследования GISSI-HF, опубликованные в 2008 году показали, что назначение омакора в дозе 1 г/сут у больных с ХСН на фоне оптимальной медикаментозной терапии сопровождается снижением риска общей смерти на 9% и уменьшение количества госпитализаций по причине желудочковых нарушений ритма. При этом количество побочных эффектов в группе лечения ω3- ПНЖК не отличалось от группы контроля.
Существуют ряд публикаций, в которых показано влияние омакора на выраженность желудочковых нарушений ритма. В одной из них, уже через месяц от начала терапии, добавление ω-3 ПНЖК пациентам со стабильной ИБС привело к статистически достоверному уменьшению числа эпизодов неустойчивой ЖТ и числа парных желудочковых экстрасистол.
Таким образом, к настоящему времени убедительно продемонстрирован профилактический эффект ω3-ПНЖК у больных, перенесших ОИМ в отношении риска развития ВСС. Согласно существующим рекомендациям, больным, перенесшим ИМ, следует употреблять в день 1 грамм ω3- ПНЖК, а именно - омакор, а также устраивать «рыбные дни» (около 200 г жирной рыбы), по меньшей мере, дважды в неделю. Данных о возможности использования омега-3 ПНЖК для вторичной профилактики ВСС у больных, переживших остановку кровообращения, в настоящее время недостаточно, но исследования на эту тему, в частности у больных с ИКД, – продолжаются.
Нитраты.
Поскольку одним из механизмов ВСС могут быть ишемические события, вероятно, одним из путей профилактики ВСС у этих больных могут быть нитраты. Долгосрочных рандомизированных исследований, оценивавших эффект антиангинальной терапии на ЖНР, не проводилось и они не включены в международные и отечественные рекомендации по их лечению. Тем не менее, имеются данные, свидетельствующие о положительном влиянии терапии нитратами на желудочковую эктопическую активность, и их назначение может обсуждаться при лечении ишемических ЖНР.
ААП IC класса.
Применение ААП для профилактики ВСС имеет значительные ограничения, а в ряде случаев, согласно данным многоцентровых рандомизированных исследований, может привести к увеличению риска серьезных нежелательных последствий. В частности, согласно данным исследований CAST и CAST-II назначение препаратов IC класса пациентам с ЖНР и указаниями в анамнезе на перенесенный ранее ОИМ сопровождается достоверным увеличением характеристик ВСС. Тем не менее, существует ряд ситуаций, при которых назначение ААТ может быть оправдано.
Прежде всего, это пациенты с имплантированными кардиовертерами-дефебрилляторами (ИКД) и частыми обоснованными срабатываниями по поводу рецидивирующей ЖТ/ФЖ. Такая ситуация в своих крайних проявлениях называется аритмическим штормом и обусловливает необходимость дополнительного назначения ААТ для терапии ЖТ и уменьшения количества эпизодов терапии ИКД.
Амиодарон и соталол.
Антиаритмический эффект препаратов III класса, таких, как амиодарон и соталол связан с удлинением потенциала действия и увеличением длительности рефрактерного периода, что способствует прерыванию циркуляции электрического импульса в петле ре-ентри, а также подавляет аритмии, возникающие по триггерному механизму. Положительное влияние амиодарона и соталола при аритмиях связано, в том числе с их антиишемическим действием, уменьшением ЧСС, нейромодулирующими воздействиями и влиянием на сократительную функцию левого желудочка. Вопрос о влиянии данных препаратов на выживаемость при их долгосрочном назначении остается открытым. Ряд клинических испытаний и один мета-анализ, включавший нескольких крупных исследований, продемонстрировали снижение частоты ВСС при назначении амиодарона у пациентов с дисфункцией ЛЖ после перенесенного ОИМ и неишемической ДКМП. Однако большинство больных в этих клинических исследований наряду с амиодароном принимали и бета-блокаторы. Крупное, хорошо спланированное исследование SCD-HeFT, в котором оценивалась профилактическая эффективность амиодарона в отношении предотвращения ВСС при ХСН, не выявило его преимуществ по сравнению с плацебо у больных с IV ФК ХСН.
Вместе с тем, следует отметить, что соталол, как и амиодарон, являются наиболее эффективными средствами при лечении ЖА. Их назначение приводит к удлинению интервала QT и может оказывать, таким образом, проаритмическое действие.
В настоящее время нет убедительных данных об улучшении выживаемости при использовании ААП III класса у больных с кардиальной патологией и ЖНР. Их назначение может быть оправдано у пациентов с ЖА в сочетании с бета-адреноблокаторами (для амиодарона - IIa, B; для соталола - IIa, С) при тщательном контроле за возможными побочными эффектами от их назначения, а также аритмогенными и проаритмическими эффектами.
Таким образом, самый высокий уровень доказательной базы в отношении профилактики ВСС имеется у бета-блокаторов, которые следует назначать (при отсутствии противопоказаний) с целью первичной профилактики ВСС всем больным, перенесшим ОИМ, а также пациентам с систолической дисфункцией ЛЖ, как ишемического, так и неишемического генеза вне зависимости от аритмического анамнеза.
С той же целью у больных, перенесших ИМ, назначаются иАПФ/АРА, статины, аспирин, ω3-ПНЖК. У больных с ХСН неишемического генеза обязательно назначение иАПФ/АРА, антагонистов альдостерона, ω3- ПНЖК.