Тетрахлорметан
| Тетрахлорметан | |
|---|---|
 | |
 | |
 | |
| Общие | |
| Систематическое наименование |
тетрахлорметан; перхлорметан |
| Традиционные названия | четырёххлористый углерод, углеродтетрахлорид, |
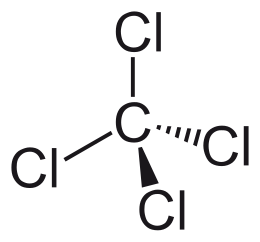
| Хим. формула | CCl4 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 153,82 г/моль |
| Плотность | 1,5954 (при 20 °C) |
| Поверхностное натяжение | 26,43 ± 0,01 мН/м |
| Энергия ионизации | 11,47 ± 0,01 эВ |
| Термические свойства | |
| Т. плав. | −22,87 °C |
| Т. кип. | 76,75 °C |
| Т. всп. | не воспламеняется °C |
| Кр. точка | 283,2 °C / 45 бар |
| Энтальпия образования | −139,3 (298 К) кДж/моль |
| Давление пара | 91 ± 1 мм рт.ст. и 11,6 кПа |
| Химические свойства | |
| Растворимость в воде | 0,08 (25 °C) |
| Оптические свойства | |
| Показатель преломления | 1,4607 (20 °C, для D-линии натрия) |
| Структура | |
| Дипольный момент | 0 Д |
| Классификация | |
| Рег. номер CAS | 56-23-5 |
| PubChem | 5943 |
| Рег. номер EINECS | 200-262-8 |
| SMILES | |
| InChI | |
| RTECS | FG4900000 |
| ChEBI | 27385 |
| Номер ООН | 1846 |
| ChemSpider | 5730 |
| Безопасность | |
| Токсичность |

|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Тетрахлормета́н (четырёххлористый углерод, фреон-10, хладон-10) CCl4 — хлорорганическое соединение, галогеноалкан, бесцветная тяжёлая жидкость, по запаху напоминающая хлороформ. Негорюч. Ядовит. Нерастворим в воде, смешивается с большинством органических растворителей.
Свойства
При нагревании с водой до 250 °C происходит гидролиз: при недостатке воды образуется фосген, при избытке — углекислый газ.
При нагревании до 500 °C превращается в смесь тетрахлорэтилена и гексахлорэтана с выделением свободного хлора.
При ингаляционном отравлении вызывает токсический отёк лёгких и острую эмфизему. Продуктами метаболизма являются хлороформ, фосген, углекислый газ и соляная кислота.
Получение
В промышленности тетрахлорметан производят хлорированием, например, метана или хлорметана, нагревая их смесь с хлором до температуры 400—500 °C. При этой температуре происходит серия химических реакций, постепенно превращающих метан или метилхлорид в соединения с большим содержанием хлора:
Результатом процесса является смесь, состоящая из метилхлорида, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется дистилляцией.
Применение
Применяется как растворитель (жиров, смол, каучука и др.), для получения фреонов, как экстрагент, в медицине.
Тетрахлорметан квалификации «эвс» используется для анализа водных сред на нефтепродукты методом инфракрасной спектроскопии.
Тетрахлорметан с 1930-х годов широко использовался в качестве наполнителя ручных и стационарных огнетушителей для военной, авиационной и другой техники («тетрахлорный огнетушитель», в том числе с ручным приводом насоса), особенно до широкого распространения углекислотных, фреоновых и порошковых систем. Пары́ и продукты разложения тетрахлоруглерода не поддерживают горения, как тушащий агент он имеет много достоинств: жидкий при нормальных условиях, легко испаряется, при этом значительно охлаждая зону горения, неэлектропроводен, не требует для хранения сосудов высокого давления, не корродирует медные и лужёные сосуды, относительно инертен к обрабатываемым поверхностям (для использования в холодное время требуется добавка низкозамерзающих растворителей). Однако из-за токсичности продуктов разложения в гражданских системах применения не получил. Ручное тушение пожара в машине требовалось выполнять в противогазах — при попадании тетрахлорида углерода на горячие поверхности происходила химическая реакция частичного замещения хлора атмосферным кислородом с образованием фосгена — сильнодействующего ядовитого вещества удушающего действия.
Токсикология
Ядовит как в жидком, так и парообразном виде. При попадании в организм выводится довольно быстро и уже через 48 ч не обнаруживается. Метаболизируется до хлороформа и диоксида углерода.




