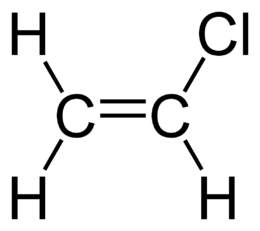
Винилхлорид
| Винилхлорид | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
хлорэтилен |
| Традиционные названия | винилхлорид, хлористый винил |
| Хим. формула | CH2=CHCl |
| Рац. формула | C2H3Cl |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 62,498 г/моль |
| Плотность | 0,9106 (при 20 °C) ; 0,9730 (при −15 °C) |
| Энергия ионизации | 9,99 ± 0,01 эВ |
| Термические свойства | |
| Т. плав. | −153,8 °C |
| Т. кип. | −13,8 °C |
| Пр. взрв. | 3,6 ± 0,1 об.% |
| Кр. точка | 158,4 °C; 5,34 МПа |
| Мол. теплоёмк. | 0,858 (25 °C) Дж/(моль·К) |
| Энтальпия образования | −37,26 кДж/моль |
| Давление пара | 337 кПа (20 °C) |
| Оптические свойства | |
| Показатель преломления | 1,3700 (при 20 °C) |
| Структура | |
| Дипольный момент | 1,44 |
| Классификация | |
| Рег. номер CAS | 75-01-4 |
| PubChem | 6338 |
| Рег. номер EINECS | 200-831-0 |
| SMILES | |
| InChI | |
| RTECS | KU9625000 |
| ChEBI | 28509 |
| ChemSpider | 6098 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Винилхлори́д (хло́ристый вини́л, хлорвини́л, хлорэтиле́н, хлорэте́н, этиленхлори́д) — органическое вещество; бесцветный газ со слабым сладковатым запахом, имеющий формулу C2H3Cl и представляющий собой простейшее хлорпроизводное этилена. Вещество является чрезвычайно огне- и взрывоопасным, выделяя при горении токсичные вещества. Винилхлорид — сильный яд, оказывающий на человека канцерогенное, мутагенное и тератогенное действие.
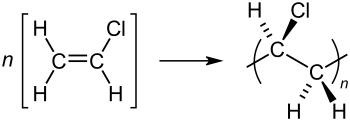
Промышленное производство винилхлорида входит в первую десятку производства крупнейших многотоннажных продуктов основного органического синтеза; при этом почти весь производимый объём используется для дальнейшего синтеза поливинилхлорида (ПВХ), мономером которого и является винилхлорид.
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007), винилхлорид входит в сотню самых важных химических соединений.
Содержание
- 1 История открытия
- 2 Строение молекулы
- 3 Физические свойства
- 4 Химические свойства
- 5 Лабораторные методы получения
- 6 Промышленное производство: технологические аспекты
- 7 Промышленное производство: экономические аспекты
- 8 Применение
- 9 Огне- и пожароопасность
- 10 Физиологическое действие
- 11 Воздействие на окружающую среду
- 12 Гигиенические нормативы
- 13 Обращение, хранение и транспортировка
- 14 См. также
- 15 Примечания
- 16 Использованная литература и источники
- 17 Литература и прочие внешние источники
История открытия
Впервые винилхлорид был получен профессором химии Гиссенского университета Юстусом Либихом в 1830-х годах действием на дихлорэтан спиртового раствора гидроксида калия:
Ученик Либиха, французский химик Анри Виктор Реньо, в 1835 году подтвердил открытие Либиха, впервые опубликовав об этом статью в издании Annales de chimie et de physique. Он же впервые обнаружил, что под действием света вещество превращается в белый порошок. Однако приоритет изобретения поливинилхлорида признаю́т за немецким химиком Эугеном Бауманном, который в 1872 году открыл и описал процесс фотополимеризации винилхлорида.
Первое упоминание соединения «винилхлорид» было сделано немецким химиком Кольбе в 1854 году.
В 1912 году немецкий химик Фриц Клатте (нем. Fritz Klatte) получил винилхлорид по реакции ацетилена с хлороводородом:
Компания Greisheim Electron, где работал учёный, запатентовала в Германии этот метод и материал, получавшийся в результате полимеризации, однако не смогла найти ему практическое применение. Только в 1933 году после исследований американского учёного Уолдо Симона (англ. Waldo Semon) (1926 год) компанией B.F. Goodrich был получен патент и разработано первое промышленное производство винилхлорида. К 1939 году началось коммерческое производство винилхлорида с целью выпуска ПВХ для военных нужд.
До середины XIX века учёные ошибочно считали, что структура винилхлорида описывается формулой C4H3Cl (этилену приписывалась формула C4H4). Только после работ Эмиля Эрленмейера (1862 год), предположившего наличие в этилене двойной связи, учёные пришли к современному представлению о строении винилхлорида.
Из русских учёных исследованием полимеризации винилхлорида и возможностей его коммерческого использования занимался Иван Остромысленский (начало XX века).
Строение молекулы
В молекуле винилхлорида связь C−Cl более короткая и более прочная, чем аналогичная связь в молекуле хлорэтана, что связано с p,π–сопряжением π-орбиталей кратной связи с неподелённой электронной парой атома хлора.
В таблице представлены сравнительные значения длин и энергии связей (C−Hal), а также дипольных моментов в молекуле винилхлорида и некоторых хлоралканов:
| Соединение | Энергия связи C−Cl, кДж/моль |
Длина связи C−Cl, нм | Дипольный момент [молекулы], 10−30 Кл·м |
|---|---|---|---|
| CH2=CHCl | 374,89 | 0,169 | 4,80 |
| CH3−CH2Cl | 336,39 | 0,179 | 6,66 |
| CH3Cl | 349,78 | 0,176 | 6,19 |
Смещение электронной плотности в молекуле винилхлорида от атома хлора в сторону двойной связи, благодаря эффекту сопряжения (+M-эффект), действует одновременно с сильным электроноакцепторным индуктивным эффектом атома хлора (−I-эффект), однако влияние последнего сильнее (−I > +M), поэтому галоген несёт на себе небольшой отрицательный заряд (см. рисунок).
Физические свойства
Винилхлорид при нормальных условиях представляет собой бесцветный газ со слабым сладковатым запахом, напоминающим запах хлороформа. Порог ощущения запаха в воздухе составляет приблизительно 3000 частей на миллион. Малорастворим в воде (около 0,95 масс.% при 15—85 °С), легко растворим в спирте, хлороформе и дихлорэтане, растворим в диэтиловом эфире.
Некоторые физические константы винилхлорида:
- температура кипения: −13,8 °C;
- температура плавления: −153,8 °C;
- относительная плотность при −20 °C: 0,983;
- относительная плотность при 20 °C: 0,911 (жидкость);
- плотность по воздуху: 2,17;
- показатель преломления при 10 °C: 1,4046;
- критическая температура: 158,4 °C;
- критическое давление: 5,34 МПа;
- критическая плотность: 0,370 г/см³;
- вязкость жидкости при −40 °C: 0,334 мПа·с;
- вязкость газа при 20 °C: 10,71 мкПа·с;
- поверхностное натяжение при −20 °C: 22,3 мН/м;
- теплоёмкость жидкости при −20 °C: 1,146 кДж/(кг·К);
- теплоёмкость газа при 25 °C: 0,858 кДж/(кг·К);
- теплопроводность жидкости при 20 °C: 0,138 Вт/(м·К);
- стандартная энтальпия образования, ΔH°298: −37,26 кДж/моль;
- стандартная энтропия образования, S°298: 263,98 Дж/(моль·K);
- теплота испарения при температуре кипения, ΔHисп.: 332,7 кДж/кг;
- теплота сгорания, ΔH°сгор.: −1198,1 кДж/моль.
Согласно исследованиям американских учёных, плотность винилхлорида в диапазоне температур от точки кипения до 60 °C с точностью 0,1 % выражается следующим уравнением
где d — плотность, г/см³; t — температура, °С.
Ими же была получена зависимость, связывающая упругость пара винилхлорида с температурой:
где p — давление, атм; T — температура, K.
Химические свойства
Винилхлорид — активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора.
Подобно алкенам, винилхлорид вступает в реакции присоединения по кратной связи, при этом атом хлора выступает в роли электронакцепторного заместителя, тем самым снижая реакционную способность соединения в реакциях электрофильного присоединения и повышая реакционную способность соединения в реакциях нуклеофильного присоединения.
Атом хлора в винилхлориде очень инертен, что связано с влиянием двойной связи, поэтому реакции замещения, связанные с ним, для винилхлорида не характерны. В то же время именно это свойство позволяет относительно легко отщеплять от него молекулу хлороводорода.
Наибольший интерес представляет реакция полимеризации винилхлорида, имеющая огромное практическое значение.
Реакции присоединения по двойной связи
Хлористый винил легко реагирует с хлором как в жидкой, так и газовой фазе, образуя 1,1,2-трихлорэтан:
При этом реакция может иметь как ионный (катализатор FeCl3), так и радикальный характер (в присутствии инициаторов свободных радикалов, например, органических перекисей). Присоединение хлора также можно осуществить посредством фотохимической инициации или при нагревании реакционной смеси свыше 250 °C в присутствии небольших количеств кислорода.
Винилхлорид присоединяет галогенводороды по двойной связи в соответствии с правилом Марковникова только в присутствии катализаторов (хлорид железа (III), хлорид цинка и др.) при повышенной температуре, образуя 1,1-дигалогеналканы:
Фтористый водород реагирует с винилхлоридом в газовой фазе только при повышенном давлении (1—1,5 МПа):
Фтористый водород реагирует с винилхлоридом в жидкой фазе в присутствии катализатора хлорида олова (IV) с замещением атома хлора на фтор с получением 1,1 — дифторэтана (фреона R152a) — озонобезопасного хладагента:
В присутствии перекисей присоединение идёт иначе (только для HCl и HBr):
Йодистый водород присоединяется к винихлориду в присутствии каталитического количества йода с образованием 1-хлор-1-иодэтана:
С водным раствором хлора винилхлорид реагирует, образуя хлорацетальдегид:
Если реакцию проводить в растворе метанола, образуется хлорацеталь:
Под действием ультрафиолетового облучения винилхлорид реагирует с сероводородом (катализатор — диалкилдитиоэфиры), образуя отравляющее вещество иприт:
В присутствии галогенидов некоторых металлов (FeCl3, AlCl3 и пр.) винилхлорид конденсируется с хлорэтаном, образуя 1,1,3-трихлорбутан; с 2-хлорпропаном — 1,1-дихлор-3-метилбутан:
С четырёххлористым углеродом в присутствии CuCl/C4H9NH2 или RuCl2(PPh3)3 в качестве катализатора с высоким выходом образует 1,1,1,3,3-пентахлорпропан:
В реакции Принса с участием винилхлорида образуется 3,3-дихлорпропанол-1 и 2,3-дихлорпропанол:
Вступает в реакцию Фриделя-Крафтса с бензолом в присутствии хлорида алюминия, образуя 1,1-дифенилэтан:
Винилхлорид вступает в фотохимическую реакцию [2+2] циклоприсоединения к 1-изохинолону:
Реакции замещения по атому хлора
Традиционные реакции замещения, типичные для многих галогенуглеводородов, для винилхлорида не доступны. Обычно под действием оснований, особенно при нагревании, вместо замещения протекают реакции полимеризации или элиминирования.
Тем не менее, в присутствии солей палладия можно осуществить нуклеофильное замещение по атому хлора: таким образом удаётся получить винилалкоголяты, а также простые и сложные виниловые эфиры:
Реакцию замещения с алкоголятом натрия можно провести и без катализатора в достаточно жёстких условиях: при длительном нагревании в закрытом автоклаве при температуре около 100 °C:
Реакцию аминирования также можно провести в присутствии палладиевого катализатора:
Реакция с аммиаком в газовой фазе при 50 °C в присутствии амальгамы натрия приводит к азиридину:
В обычных условиях винилхлорид не образует реактивы Гриньяра, однако в среде тетрагидрофурана удалось получить винилмагнийгалогениды (реактивы Нормана):
В дальнейшем винилмагнийхлорид можно использовать для синтеза широкого спектра винилпроизводных, например:
По аналогии с магнием можно получить и другие винилметаллорганические соединения, например, винилкалий:
Взаимодействие винилхлорида с металлическим мелкодисперсным литием в присутствии натрия (2 %) в среде тетрагидрофурана приводит к виниллитию:
Взаимодействием винилхлорида с 2-тиенилмагнийбромидом в присутствии хлорида кобальта можно получить 2-винилтиофен:
Винилхлорид вступает в реакцию с диметиламином и CO в присутствии палладиевого катализатора с образованием N,N-диметилакриламида:
Реакция полимеризации
В отсутствие кислорода и света при обычных условиях чистый винилхлорид может существовать достаточно долго, не претерпевая каких-либо изменений; однако появление свободных радикалов, вызываемое как фотохимически, так и термохимически, приводит к его быстрой полимеризации.
Механизм полимеризации носит радикальный характер и схематично может быть представлен следующим образом:
Первый этап: действие инициатора — образование свободных радикалов и зарождение цепи.
Второй этап: развитие полимеризации — образование полимерных цепочек.
В процессе образования полимера возможно разветвление цепи, а также образование ненасыщенных фрагментов:
Третий этап: завершение полимеризации.
Прочие реакции
Почти с количественным выходом можно получить бутадиен из винилхлорида в среде диметилформамид-вода в присутствии комплексного смешанного катализатора:
Винилхлорид в реакциях с хлорангидридами карбоновых кислот в присутствии хлорида алюминия образует дихлоркетоны и хлорвинилкетоны:
В присутствии хлоридов палладия (PdCl2), родия (RhCl3•3H2O) или рутения (RuCl3•3H2O) винилхлорид вступает в реакцию со спиртами, образуя ацетали:
Окисление винихлорида неорганическими окислителями в зависимости от условий реакции и выбора окислителя приводит к образованию хлорацетальдегида или формальдегида, более глубокое окисление — монооксиду или диоксиду углерода, хлороводороду и воде:
Озонолиз винилхлорида в среде метанола при температуре −78 °C с высоким выходом приводит к метоксиметилгидропероксиду (1), который можно в дальнейшем превратить в метиловый эфир муравьиной кислоты (2) и диметоксиметан (метилаль) (3):
Восстановление винилхлорида возможно по трём различным направлениям в зависимости от выбора агента и условий реакции:
- до этилена:
- до этилхлорида:
- до этана:
Под действием сильных оснований винилхлорид способен отщеплять хлористый водород, образуя ацетилен:
Винилхлорид термически довольно устойчивое соединение, заметное разложение которого происходит при нагревании свыше 550 °C. Пиролиз винилхлорида при 680 °C с 35 % выходом приводит к смеси продуктов, содержащих ацетилен, хлороводород, хлоропрен и винилацетилен.
Лабораторные методы получения
В лабораторных условиях винилхлорид получают дегидрохлорированием 1,2-дихлорэтана или 1,1-дихлорэтана спиртовым раствором гидроксида натрия или калия при нагревании:
Другой метод — пропускание ацетилена через концентрированный раствор соляной кислоты в присутствии хлорида ртути — в лабораторной практике используется редко:
Ещё одним альтернативным вариантом может служить каталитическая дегидратация этиленхлоргидрина:
Наконец, винилхлорид можно получить при взаимодействии ацетальдегида с пентахлоридом фосфора:
Промышленное производство: технологические аспекты
На 2010 год существуют три основных способа получения винилхлорида, реализованные в промышленных масштабах:
- каталитическое газофазное гидрохлорирование ацетилена;
- комбинированный метод на основе этилена и ацетилена;
- сбалансированный по хлору метод на основе этилена.
Последний метод является самой современной, распространённой и экономически наиболее эффективной технологией производства, однако первые два способа, хоть и являются устаревшими, до сих пор существуют на многих предприятиях, ориентированных (по разным причинам) на использование дорогостоящего ацетилена.
Существует также сравнительно новый способ, пока не получивший распространения и реализованный в виде пилотного проекта в 1998 году на одном предприятии в Германии — окислительное хлорирование этана.
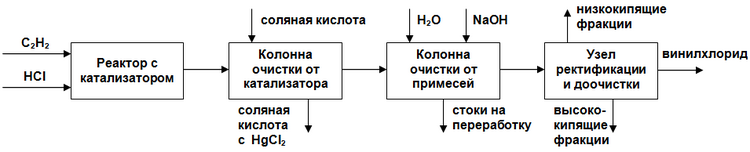
Каталитическое газофазное гидрохлорирование ацетилена
Метод каталитического гидрохлорирования ацетилена, в котором ацетилен получался реакцией карбида кальция с водой, был первым коммерческим процессом получения винилхлорида.
Химия процесса выглядит следующим образом:
- Получение ацетилена:
- Гидрохлорирование ацетилена:
Краткое описание технологии производства:
Произведённый, очищенный и осушенный ацетилен (содержание влаги не более 1,5 г/м³) смешивают с очищенным и высушенным хлороводородом в соотношении примерно 1,0:1,1. Эта смесь газов подаётся в верхнюю часть трубчатого реактора, трубы которого заполнены катализатором, представляющим собой активированный уголь, пропитанный двухлористой ртутью HgCl2 (10—15 %). Реактор изготавливается из углеродистой стали; высота труб составляет 3—6 метров, диаметр 50—80 м. Температура в области реакции 150—180 °C. После реактора реакционные газы подаются в специальную колонну, орошаемую соляной кислотой для извлечения двухлористой ртути. После первой абсорбционной колонны реакционные газы подаются в следующую, где орошаются водой и раствором щёлочи для отделения хлороводорода, ацетальдегида и углекислого газа. После этого газы охлаждаются в конденсаторе для удаления воды и подаются на ректификацию для удаления высококипящих примесей. Полученный винилхлорид на последней стадии пропускается через колонну, заполненную твёрдым едким натром для полного обезвоживания и нейтрализации.
Ниже представлено схематичное изображение процесса:
По состоянию на 1967 год, доля метода каталитического газофазного гидрохлорирования ацетилена в производственных мощностях по выпуску винилхлорида в США составляла 32,3 % (405,6 тыс. тонн). В 2001 году американская химическая корпорация Borden остановила своё последнее производство на основе ацетилена в Луизиане. Помимо экономических соображений, метод каталитического гидрохлорирования ацетилена является экологически небезопасным, так как используемая в производстве ртуть, несмотря на рециркуляцию, неизбежно с газообразными отходами и сточными водами попадает в окружающую среду. В 2002 году в России такие выбросы составили около 31 кг.
Метод каталитического гидрохлорирования ацетилена на 2010 год широко распространён только в Китае из-за богатых запасов угля, наличия дешёвой гидроэлектроэнергии, а также дефицита природного газа, являющегося главным сырьём для производства этилена.
C 2003 по 2008 год метод вновь вызвал к себе интерес из-за значительного роста мировых цен на нефть и газ, однако экономический кризис 2008 года вновь сделал метод прямого окислительного хлорирования этилена наиболее привлекательным с экономической точки зрения.
Комбинированный метод на основе этилена и ацетилена
Комбинированный метод на основе этилена и ацетилена заключается в совмещении реакции хлорирования этилена и последующей деструкции дихлорэтана с реакцией гидрохлорирования ацетилена и использованием для последней хлороводорода со стадии термического разложения.
Химия процесса:
Метод позволил заменить половину ацетилена на более дешёвый этилен, а также утилизировать хлороводород, тем самым доведя почти до 100 % полезное использование хлора.
Сбалансированный по хлору метод на основе этилена
Общее описание метода
На 2010 год самым современным и наиболее эффективным с экономической точки зрения является сбалансированный процесс окислительного хлорирования этилена. В 2006 году более 95 % винилхлорида было произведено этим методом.
В основанном на этилене процессе винилхлорид получается пиролизом дихлорэтана, который, в свою очередь, синтезируется каталитической реакцией хлора с этиленом. Хлороводород, получаемый в результате дегидрохлорирования дихлорэтана, вступает в реакцию с кислородом и этиленом в присутствии медного катализатора, образуя дихлорэтан и тем самым уменьшая расход элементарного хлора, используемого для прямого хлорирования этилена. Этот процесс известен как оксихлорирование. Для получения товарного продукта винилхлорид очищают дистилляцией, а побочные хлорорганические продукты либо выделяют для получения растворителей, либо подвергают термодеструкции для вовлечения хлороводорода снова в процесс.
Химия процесса выглядит следующим образом:
- Хлорирование этилена:
- механизм стадии:
- Термическое дегидрохлорирование дихлорэтана:
- механизм стадии:
- Окислительное хлорирование этилена:
- механизм стадии:
При такой схеме производства распределение этилена происходит примерно поровну между стадиями прямого и окислительного хлорирования.
Vinnolit VCM Process
Одной из самых распространённых технологий производства винилхлорида в мире является Vinnolit VCM Process, лицензируемый немецкой компанией Vinnolit GmbH & Co.: начиная с 1964 года в мире установлено приблизительно 5,5 млн тонн мощностей по выпуску винилхлорида по этому процессу.
Ниже представлено схематичное изображение процесса:
Краткое описание стадий процесса:
- Прямое хлорирование этилена:
- Реакция хлорирования этилена протекает в жидкой фазе в среде дихлорэтана при температуре 50—125 °С в присутствии специального усовершенствованного (по сравнению с FeCl3) комплексного катализатора, препятствующего образованию побочных продуктов, не расходующегося в процессе синтеза и остающегося в реакторном объёме. Благодаря этому образующийся дихлорэтан не требует очистки (чистота достигает 99,9 % и более) и напрямую поступает на стадию пиролиза.
- Процесс оксихлорирования этилена:
- Процесс оксихлорирования — экзотермическая реакция, сопровождающаяся выделением большого количества тепла (ΔH = −238 кДж/моль) и проходящая в присутствии кислорода (преимущественно) или воздуха. Реакционная газовая смесь разогревается до температуры свыше 210 °C, а выделяемое тепло реакции используется для образования пара. Степень конверсии этилена достигает 99 %, а чистота получаемого дихлорэтана — 99,5 %.
- Процесс дистилляции дихлорэтана:
- Дистилляция требуется для дихлорэтана, образующегося в процессе оксихлорирования, а также непрореагировавшего (возвратного) дихлорэтана со стадии пиролиза. Вода и низкокипящие компоненты удаляются в осушающей колонне. Кубовый остаток в дальнейшем поступает на стадию регенерации.
- Пиролиз дихлорэтана:
- Пиролиз дихлорэтана производится в специальных печах (операционный период — до 2 лет) при температуре 480 °C; при этом теплота процесса используется для испарения и нагрева.
- Дистилляция винилхлорида:
- Продукты пиролиза, состоящие, в основном, из дихлорэтана, винилхлорида и хлороводорода, направляются в узел дистилляции. Хлороводород возвращается в отделение оксихлорирования, винилхлорид удаляется через верхнюю часть колонны, а кубовый остаток, состоящий из непрореагировавшего дихлорэтана, возвращается в процесс дистилляции после удаления побочных продуктов.
- Регенерация побочных продуктов:
- Жидкие и газообразные побочные продукты полностью сжигаются при температуре 1100—1200 °С, образуя хлороводород, который после очистки возвращается в процесс оксихлорирования; попутно за счёт высокой температуры продуцируется также пар среднего давления.
Расчётный материально-энергетический баланс процесса (на 1000 кг винихлорида):
- Этилен: 460 кг;
- Хлор: 585 кг;
- Кислород: 139 кг;
- Пар: 125 кг;
- Электроэнергия: 120 кВт·ч;
- Вода: 150 м³.
Метод окислительного хлорирования этана
Идея использовать этан для синтеза винилхлорида была реализована в 1965—1967 годах на опытном производстве компаний The Lummus Co. и Armstrong Cork Co. Технология прямого оксихлорирования в присутствии хлорида меди (I) получила название Transcat Process.
Химия процесса:
Процесс проходил при 450—550 °C и давлении 1 МПа; степень конверсии этана достигала 65—70 %. Метод впоследствии был оптимизирован компанией ICI, которая снизила температурный диапазон проведения синтеза и предложила другой катализатор.
В мае 1998 года компания EVC International NV (Нидерланды) запустила опытный проект мощностью 1000 тонн в год на заводе в Вильгельмсхафене (Германия) с целью опробирования и последующего продвижения на рынке запатентованного процесса окислительного хлорирования этана, или Ethane-to-VCM-Process. Предполагалось, что этот проект будет технологическим прорывом и станет началом работы над полномасштабным заводом, который, как ожидалось, будет запущен в 2003 году.
По данным производителя, температура процесса составляет менее 500 °C, степень конверсии сырья — 100 % по хлору, 99 % по кислороду и более чем 90 % по этану; выход винилхлорида превышает 90 %.
В сентябре 1999 года EVC подписала с компанией Bechtel Group, Inc. (США) соглашение о постройке полноценного производства в Вильгельмсхафене, однако из-за финансовых проблем проект не был осуществлён.
После поглощения в 2001 году корпорацией INEOS компании EVC дальнейшая судьба проекта Ethane-to-VCM-Process не известна.
Альтернативные методы производства винилхлорида
Компанией Monsanto в 1977 году был предложен одностадийный метод получения винилхлорида с выходом до 85 % из этана под действием смеси хлороводорода и кислорода при температуре 400—650 °С в присутствии катализатора (галогенид меди и фосфат калия):
В 1980 году советскими учёными был запатентован альтернативный метод получения винилхлорида газофазным хлорированием смеси, содержащей этан и этилен, при температуре 350—500 °С, отвечающий следующей химической модели:
Побочными продуктами реакции являются хлорэтан, 1,1-дихлорэтан, винилиденхлорид и др. галогенпроизводные.
Одним из самых последних разработанных методов производства (2005 год) является способ получения винихлорида взаимодействием метилхлорида и метиленхлорида в газовой фазе при температуре 300—500 °С, давлении от 0,1 до 1 МПа, в присутствии катализаторов (активный оксид или фосфат алюминия, алюмосиликаты, хлорид цинка с оксидом алюминия):
Все перечисленные способы получения винилхлорида или не были реализованы в промышленности, или не вышли из стадии экспериментального производства.
Промышленное производство: экономические аспекты
Мировое производство винилхлорида
Винилхлорид входит в ТОП 20 крупнейших по объёму продуктов мирового нефтехимического производства, уступая лишь этилену (123 млн тонн в 2010 году), пропилену (77 млн тонн в 2010 году), метанолу (48—49 млн тонн в 2010 году), терефталевой кислоте (42 млн тонн в 2008 году), бензолу (40 млн тонн в 2010 году). Производство винилхлорида является третьим после полиэтилена и окиси этилена по значимости направлением использования этилена как важнейшего химического сырья и составляет 11,9 % его мирового потребления (по данным на 2008 год). Мировое производство винилхлорида в 2010 году составило около 35 млн тонн (36,7 млн тонн в 2008 году), что составляет 70 % всех мировых производственных мощностей (в 2007 году — 90 %, 2008 году — 85 %). По прогнозным данным компании IHS, текущее потребление винилхлорида в период с 2010 по 2015 гг. будет расти в размере 4,4 % в год и 4,2 % в последующие пять лет (с 2015 по 2020 г.).
По состоянию на 1997 и конец 2004 года мировые мощности по производству винилхлорида по регионам выглядят следующим образом:
| Регион | Мощность на 1997 год, тыс. тонн | Мощность на 2004 год, тыс. тонн |
|---|---|---|
|
Северная Америка США Канада Мексика |
7385 6741 374 270 |
8988 8018 500 470 |
|
Южная Америка Бразилия Аргентина Венесуэла |
880 540 160 180 |
1035 655 230 150 |
|
Западная Европа Бельгия Франция Германия Италия Нидерланды Норвегия Испания Швеция Великобритания |
6409 1010 1205 1710 620 520 470 399 115 360 |
6495 880 1205 2015 440 600 470 465 120 300 |
|
Восточная и Центральная Европа Россия и страны СНГ Чехия и Словакия Югославия (бывшая) Венгрия Польша Румыния |
2342 1085 217 260 185 325 270 |
2011 884 217 160 255 300 200 |
|
Африка Алжир Египет Ливия Марокко ЮАР |
405 40 100 62 38 165 |
408 40 100 62 38 168 |
|
Ближний Восток Иран Израиль Катар Саудовская Аравия Турция |
862 213 110 — 360 179 |
1092 240 — 300 400 152 |
|
Азия Китай Индия Индонезия Япония Северная Корея Южная Корея Пакистан Филиппины Тайвань Таиланд |
7145 1356 610 150 2965 24 755 5 10 1030 240 |
13082 4436 845 500 3260 24 1520 — — 1870 627 |
|
Австралия и Океания Австралия |
36 36 |
— — |
| ИТОГО | 25 464 | 33 111 |
Крупнейшим потребителем винилхлорида в мире является Китай: около 30 % всего мирового производства; на втором месте США и Канада, приблизительно с 20 % (по состоянию на 2008 год). Крупнейшим производителем винилхлорида в мире (по объёму производственных мощностей) являются США: 8,24 млн тонн по данным на 2003 год (для сравнения — в 1967 году мощности составляли 1,26 млн тонн, а в 1960 году всего 0,67 млн тонн).
Крупнейшие производители США и Канады по объёму производственных мощностей по данным на 2003 год:
- Dow Chemical — 2,4 млн тонн (2006 год);
- Occidental Chemical Corporation — 1,68 млн тонн;
- Georgia Gulf — 1,18 млн тонн;
- Oxymar — 1,04 млн тонн;
- Formosa Plastics — 1,00 млн тонн.
В 1997 году крупнейшими мировыми компаниями-производителями (42 % всего суммарного объёма мировых производственных мощностей) были:
- Dow Chemical — 1906 тыс. тонн;
- Formosa Plastics — 1643 тыс. тонн;
- EVC — 1370 тыс. тонн;
- Solvay — 1193 тыс. тонн;
- The Geon Company — 1088 тыс. тонн;
- Occidental Chemical — 1020 тыс. тонн;
- Elf-Atochem — 803 тыс. тонн;
- Georgia Gulf — 726 тыс. тонн;
- Norsk Hydro — 595 тыс. тонн;
- Tosoli Corporation — 570 тыс. тонн.
По состоянию на 2005 год крупнейшими мировыми компаниями-производителями являются (перечислены в порядке убывания):
- Formosa Plastics;
- Dow Chemical;
- Occidental Chemical Corporation;
- Solvay;
- Georgia Gulf;
- INEOS;
- Tosoh;
- Total Petrochemicals;
- LG Chemicals;
- Shin-Etsu Chemical.
Производство винилхлорида в России
Вклад России в мировое производство винилхлорида довольно скромный: около 1,5 % от годового глобального выпуска и место во второй двадцатке стран-производителей (по состоянию на 2008 год). При этом технологическое оснащение серьёзно отстаёт от мирового: почти 30 % мощностей используют устаревшую ацетиленовую технологию.
Производство винилхлорида в России практически полностью (более 99 % всего объёма) ориентировано на выпуск поливинилхлорида, являясь при этом одним из крупнейших направлений потребления хлора в российской химической промышленности (18 % по данным на 2004 год).
По состоянию на 2009 год производство винилхлорида в России осуществляется на следующих предприятиях:
| Наименование | Регион | Технология производства | Производственная мощность, тыс. тонн/год | Произведено в 2008 году, тыс. тонн |
|---|---|---|---|---|
| ОАО «Саянскхимпласт» | г. Саянск, Иркутская область | СХМЭ | 270,0 | 250,0 |
| ОАО «Каустик» | г. Стерлитамак, Республика Башкортостан | СХМЭ | 165,0 | 165,0 |
| ОАО «Пласткард» | г. Волгоград | КМЭА | 100,0 | 96,3 |
| ОАО «Сибур-Нефтехим» (завод «Капролактам») | г. Дзержинск, Нижегородская область | СХМЭ | 90,0 | 78,5 |
| ОАО «НАК Азот» | г. Новомосковск, Тульская область | КГА | 45,0 | нет данных |
| ВОАО «Химпром» | г. Волгоград | КГА | 27,0 | 21,7 |
| ООО «Усольехимпром» | г. Усолье-Сибирское, Иркутская область | КГА | 26,0 | < 20,0 |
| Итого | 723,0 | 620,0—650,0 | ||
Во сентябре 2014 года компанией ООО «РусВинил» было осуществлено торжественное открытие нового комплекса по производству ПВХ (включая и производство винилхлорида) в Кстовском районе Нижегородской области мощностью 330 тыс. тонн в год. Учредителями совместного предприятия стали компания «Сибур» и бельгийская компания SolVin — совместная дочерняя компания международной химико-фармацевтической группы Solvay и немецкого концерна BASF.
Производство винилхлорида на Украине
По состоянию на 2018 год, единственным действующим производителем винилхлорида на Украине является ООО «Карпатнефтехим» (г. Калуш), входящий до февраля 2017 года в состав российской группы Лукойл. Производство осуществляется прямым хлорированием этилена; мощность производства — 370 тыс. тонн в год.
Применение
Производство поливинилхлорида
В настоящее время 98—99 % всего производимого в мире винилхлорида используется для дальнейшего производства ПВХ. В 2009 году совокупные глобальные мощности по выпуску поливинилхлорида составляли около 48 млн тонн, а его мировое производство и потребление − 29,92 млн тонн, что соответствует уровню загрузки 62 %.
Более половины мирового производства ПВХ (57 % по состоянию на 2009 год) сосредоточено в Азии, причём 20 % в Китае. Крупнейшими мировыми производителями поливинилхлорида в 2001 году были компании Shin-Etsu (Япония) — 2,75 млн тонн, Formosa Plastics (Тайвань) — 2,63 млн тонн и OxyVinyls (США) — 2,01 млн тонн. В 2011 году производственные мощности крупнейших мировых производителей ПВХ составляли:
- Shin-Etsu (Япония) — 3,69 млн тонн;
- Formosa Plastics (Тайвань) — 3,30 млн тонн;
- Solvay (Бельгия) — 2,60 млн тонн;
- LG Chem (Южная Корея) — 2,31 млн тонн;
- Kerling (Великобритания) — 1,99 млн тонн.
Объём производства ПВХ в России в 2008 году составил 578,3 тыс. тонн (−1,4 % по отношению к 2007 году), суммарная мощность производства ПВХ составляет 635,8 тыс. тонн.
В настоящий момент существуют четыре принципиально различных технологии полимеризации винилхлорида (перечислены в порядке убывания распространения):
- суспензионная полимеризация: полимеризация винихлорида в каплях эмульсии, полученной диспергированием мономера в воде, в присутствии стабилизатора эмульсии и мономер-растворимого инициатора полимеризации;
- Типичный массовый состав для суспензионной полимеризации:
- винилхлорид — 33,3 %;
- вода — 66,6 %;
- инициатор (например, органический пероксид) — 0,015 %;
- стабилизатор (например, поливиниловый спирт) — 0,005 %.
- дисперсионная полимеризация: полимеризация винилхлорида в воде в присутствии ПАВ и водорастворимых инициаторов (персульфат калия, персульфат аммония, перкарбонат натрия, пероксиуксусная кислота, пероксид водорода и гидропероксид кумола и пр.) с образованием стабильных дисперсий из очень маленьких частиц;
- полимеризация в массе: третий по важности метод, заключающийся в полимеризации винилхлорида в объёме целиком, без добавок воды, ПАВ, растворителей или иных вспомогательных компонентов (за исключением мономер-растворимых инициаторов, таких, как ди-(2-этилгексанол)пероксид, 3,5,5-триметилгексанолпероксид, ди-(трет-бутил)пероксиоксалат, ди-2-бутоксиэтилпероксидикарбонат, ди-4-хлорбутилпероксидикарбонат, азобис(изобутиронитрил), азобис-(циклогексилкарбонитрил));
- полимеризация в растворе: наиболее редкий и специфический метод, применяемый для получения сополимеров, используемых в создании полимерных покрытий.
В мире наиболее распространён метод суспензионной полимеризации (80 % всего объёма производства), причём наиболее современными и популярными являются следующие технологии:
- Chisso PVC Process;
- Vinnolit Suspension PVC Process.
Chisso PVC Process
Корпорация Chisso — лидер японской полимерной промышленности — разработала современную технологию суспензионного производства поливинилхлорида: Chisso PVC Process. Особенности метода — получение высококачественного продукта с использованием безопасной и безвредной для окружающей среды технологии, низкие начальные инвестиции и низкие операционные издержки.
Chisso PVC Process лицензирован на 19 предприятиях по всему миру, суммарная мощность — свыше 1,5 млн тонн в год.
Vinnolit Suspension PVC Process
Метод суспензионной полимеризации винилхлорида был изобретён и запатентован в 1935 году компанией Wacker Chemie GmbH, одним из прежних учредителей компании Vinnolit. После многократных усовершенствований Vinnolit Suspension PVC Process стал одним из современных и очень экономически эффективных процессов для производства поливинилхлорида во всём мире.
Реакция полимеризации осуществляется периодическим способом в реакторах объёмом около 170 м³, при этом особенность конструкции позволяет эффективно удалять тепло из реакционной смеси без использования обратного холодильника или воды для охлаждения, тем самым обеспечивая высокую производительность. Кроме того, особенности технологии позволяют получить готовый продукт с минимальным содержанием непрореагировавшего винилхлорида без применения температурной дегазации, сохраняя тем самым структуру полимера.
Прочие направления использования
Около 1 % винилхлорида используется для получения сополимеров с винилацетатом и другими мономерами.
Не более 1 % винилхлорида применяют для органического синтеза следующих соединений:
До середины 1970-х годов винилхлорид использовался как хладагент, пропеллант для аэрозольных баллонов и компонент для некоторых видов косметики.
Огне- и пожароопасность
Вещество является чрезвычайно огнеопасным, его смеси с воздухом взрывоопасны; при горении выделяет раздражающие, токсичные и коррозионно-активные вещества, среди которых, в частности, обнаруживается крайне ядовитый фосген.
Температура вспышки: −78 °C; температура самовоспламенения: 472 °С. Пределы воспламенения в воздухе: 3,6—33 %.
Гашение пламени при горении винилхлорида производят только после остановки подачи газа, при этом используют воду на максимально возможном от очага возгорания расстоянии, создавая плотную туманоподобную завесу, а также охлаждая горячие поверхности.
Рейтинг NFPA 704: ![]()
![]()
![]()
Физиологическое действие
Винилхлорид очень токсичен. Оказывает комплексное токсическое воздействие на организм человека, вызывая поражение ЦНС, костной системы, системное поражение соединительной ткани, мозга, сердца. Поражает печень, вызывая ангиосаркому. Вызывает иммунные изменения и опухоли, оказывает канцерогенное, мутагенное и тератогенное действие.
Многие исследования сообщают, что воздействие винилхлорида на человека вызывает образование злокачественных новообразований в различных тканях и органах, включая печень (опухоли, помимо ангиосаркомы), мозг, лёгкие, лимфатическую и гематопоэтическую систему (органы и ткани, вовлечённые в кровообразование). При этом можно отметить, что употребление этанола только усиливает канцерогенный эффект винилхлорида.
Хроническая интоксикация винилхлоридом носит название «винилхлоридной болезни».
Физиологическое воздействие винилхлорида на людей имеет преимущественно ингаляционный характер, причём его опасная концентрация в воздухе (1 часть на миллион) ниже предела его обнаружения человеком посредством обоняния (3000 частей на миллион). Концентрация в размере 8000 частей на миллион вызывает головокружение, а при уровне 20000 частей на миллион появляется сонливость, потеря координации, визуальные и слуховые отклонения, дезориентация, тошнота, головная боль, синдром жжения конечностей. Продолжительное воздействие более высоких концентраций винилхлорида может вызвать смерть из-за паралича центральной нервной системы и остановки дыхания. Следует иметь в виду, что газ тяжелее воздуха и может вызвать удушье в плохо проветриваемых или замкнутых помещениях.
В организме человека винилхлорид биотрансформируется преимущественно ферментами печени, при этом основным его метаболитом, выводящимся с мочой, является тиодигликолевая кислота.
Метаболический путь винилхлорида в организме человека представлен на рисунке:
Острый токсический эффект винилхлорида для различных животных:
- Крысы: ЛД50 (англ. LD50) ⩾ 400 мг/кг (перорально);
- Крысы: ЛК50 (англ. LC50) = 390 000 мг/м³ (ингаляционно);
- Мыши: ЛК50 (англ. LC50) = 294 000 мг/м³ (ингаляционно).
Воздействие на окружающую среду
В окружающей среде винилхлорид появляется исключительно вследствие его выбросов во время производства и переработки. По оценке специалистов, более 99 % выброса винилхлорида остаётся в воздухе, где происходит его фотохимическая деградация под воздействием гидроксил-радикалов; при этом период его полураспада составляет 18 часов (по другим данным, это время составляет 2,2—2,7 дней).
С поверхности почвы винилхлорид быстро испаряется, однако может мигрировать в её глубь через грунтовые воды. В растениях и животных не накапливается.
В почве и воде винилхлорид подвергается аэробной биодеградации (преимущественно до CO2) под воздействием микроорганизмов, например, рода Микобактерии (Mycobacterium); биораспад в грунтовых водах может носить и анаэробный характер, причём его продуктами являются метан, этилен, углекислый газ и вода.
Исследования показывают, что в почве и воде под действием микроорганизмов винилхлорид разлагается на 30 % в течение 40 дней и на 99 % в течение 108 дней.
Гигиенические нормативы
Основные гигиенические нормативы для винилхлорида:
- ПДК максимально разовая в воздухе рабочей зоны: 5 мг/м³;
- ПДК среднесменная в воздухе рабочей зоны = 1 мг/м³;
- класс опасности для рабочей зоны: 1 (чрезвычайно опасное);
- особенность токсического действия на организм: K (канцероген);
- ПДК среднесуточная в атмосферном воздухе населённых мест = 0,01 мг/м³;
- класс опасности для населённых пунктов: 1 (чрезвычайно опасное);
- лимитирующий показатель воздействия: резорбтивный.
- ПДК в воде = 0,005 мг/м³;
- предельно допустимая концентрация (Maximum Exposure Limits, MEL): 7 ppm;
США:
- предельно допустимая концентрация в рабочей зоне при длительном воздействии (Threshold Limit Value — Time Weighted Average, TLV-TWA): 1 ppm;
- допустимый предел воздействия (Permissible Exposure Limit, PEL):1 ppm;
- уровень минимального риска (Minimal Risk Levels, MRL):
- острое ингаляционное воздействие: 0,5 ppm;
- разовое пероральное воздействие: 0,03 ppm;
- хроническое пероральное воздействие: 0,003 мг/кг в день.
Обращение, хранение и транспортировка
Винилхлорид хранится вдали от источников тепла и огня в жидком виде при температуре −14…22 °C в больших сферических металлических заземлённых ёмкостях с небольшой добавкой стабилизатора (например, гидрохинон). Ёмкости должны быть оснащены самозапорными клапанами, устройствами контроля давления и искрогасителями. Контейнер с веществом должен находиться в хорошо проветриваемых условиях при внешней температуре ниже 50 °C. Необходимо избегать контакта с медью, любыми источниками огня или тепла, окислителями, каустической содой и активными металлами. Стабилизированный хлористый винил транспортируется в жидком виде в охлаждаемых стальных цистернах, которые предварительно должны быть тщательно высушены и продуты азотом.
См. также
- ↑ Значение приведено по Винилхлорид // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.. По-видимому, данные в «Химической энциклопедии» (−158,4 °C) не вполне корректны. В российской и зарубежной научной литературе приводится значение −153,8 °C или близкое к нему (±0,1 °C).
- ↑ Плотность вещества, отнесённая к плотности воды при температуре 4 °C.
- ↑ В качестве инициатора для примера рассматривается органический пероксид.
- ↑ Представлен один из возможных вариантов.
- ↑ Приведённые в статье альтернативные методы не являются исчерпывающими.
- ↑ По состоянию на 2010 год, одним из крупных производителей винилхлорида является не упомянутая в этой таблице Малайзия. Завод компании Petronas Архивная копия от 9 июня 2010 на Wayback Machine имеет мощность 400 тыс. тонн/год.
-
↑ Сокращения:
- КГА — каталитическое газофазное гидрохлорирование ацетилена;
- КМЭА — комбинированный метод на основе этилена и ацетилена;
- СХМЭ — сбалансированный по хлору метод на основе этилена.
- ↑ 1 2 3 В пересчёте на поливинилхлорид.
- ↑ Ориентировочное значение, рассчитанное исходя из данных по фактическому выпуску винилхлорида и производственной мощности по выпуску ПВХ.
- ↑ На официальном web-сайте компании Архивная копия от 16 сентября 2009 на Wayback Machine упоминание о производстве винилхлорида или ПВХ отсутствует.
- ↑ По данным издательства "Коммерсантъ" по состоянию на 01.01.2018 актив принадлежит украинским предпринимателям: Ильхаму Мамедову через Xedrian Holding Ltd (Кипр) и Techinservice Limited (Великобритания) Игорю Щуцкому.
- ↑ Основными продуктами горения винилхлорида являются углекислый и угарный газ, а также хлороводород.
-
↑ Расшифровка обозначений:
- синий цвет — опасность для здоровья;
- красный цвет — пожароопасность;
- жёлтый цвет — химическая активность.
- ↑ Речь идёт о предельно допустимой концентрации винилхлорида в рабочей зоне при длительном воздействии (TLV-TWA) — нормативе, принятом в США.
- ↑ Определяется исходя из однократного воздействия в течение 8 часов.
- ↑ Определяется исходя из постоянного воздействия в течение 8-часового рабочего дня, 40 часов в неделю.
- Флид М. Р., Трегер Ю. А. Винилхлорид: химия и технология. В 2 книгах. — М.: Калвис, 2008. — 584 с. — ISBN 978-5-89530-019-0.
Химия, промышленное производство и применение винилхлорида
- Елфимова С. Н., Яковенко Д. Ю. Вариант модернизации технологии получения винилхлорида из 1,2-дихлорэтана (рус.) // Альманах современной науки и образования, Тамбов: Грамота. — 2011. — № 5 (48). — С. 69-70.
- Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. и доп. — М.: «Химия», 1988. — С. 126-127; 140-141; 146-152. — ISBN 5-7245-0008-6.
- Технология производства винилхлорида и поливинилхлорида (pdf) (недоступная ссылка) 34. Uhde GmbH (30 мая 2012). Дата обращения 15 июля 2014. Архивировано 16 июля 2014 года.
- Флид М. Р. Состояние и перспективы развития производства винилхлорида − мономера для получения ПВХ (pdf) (недоступная ссылка). Дата обращения 15 июля 2014. Архивировано 23 сентября 2015 года.
- Юкельсон И. И. Технология основного органического синтеза. — М.: «Химия», 1968. — С. 299-310.
- Barnes A. W. Vinyl Chloride and the Production of PVC (англ.) // Proceeding of the Royal Society of Medicine. — 1976. — Vol. 69, no. 4. — P. 277-281.
- Cowfer J. A. Part 2. Vinyl Chloride Monomer // PVC Handbook / Wilkes C. E., Summers J. W., Daniels C. A.. — 1 st ed. — Minich: Carl Hanser Verlag, 2005. — P. 19-56. — ISBN 1-56990-379-4.
- Kun Si. Vinyl Chloride Polymerization in presence of Organic Additives: New Kinetics and Mechanism of Vinyl Chloride Polymerization and Correlation between Structural defects and Dehydrochlorination of Polyvinyl Chloride. — VDM Verlag, 2010. — 288 p. — ISBN 978-3-6392-1368-3.
- Naqvi M. K., Kulshreshtha A. K. Vinyl Chloride Manufacture: Technology Trends and an Energy Economic Perspective (англ.) // Polymer-Plastics Technology and Engineering. — 1995. — Vol. 34, no. 2. — P. 213-226.
- Saeki Y., Emura T. Technical progresses for PVC production (англ.) // Progress in Polymer Science. — 2002. — Vol. 27, no. 10. — P. 2055-2131.
- Sittig M. Vinyl Chloride and PVC Manufacture: Process and Environmental Aspects (Pollution Technology Review). — Noyes Data Corporation, 1978. — 350 p. — ISBN 978-0815507079.
- Vinyl Chloride // Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems. — 4-th edition. — New York: John Wiley & Sons, 1994. — Т. 24. — P. 413-425.
Физиологическое воздействие винилхлорида
- Могиленкова Л. А. Воздействие винилхлорида на состояние здоровья работающих в производственных условиях (обзор) (рус.) // Профилактическая медицина. — 2011. — Т. 11, июнь. — С. 558-571.
- Barrio-Lage G. A., Parsons F. Z., Narbaitz R. M., Lorenzo P. A., Archer H. E. Enhanced Anaerobic Biodegradation Iof Vintyl Chloride in Ground Water (англ.) // Environmental Toxicology and Chemistry. — 1990. — Vol. 9, no. 4. — P. 403-415.
- 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide). — IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97. — Lyon: International Agency for Research on Cancer, 2008. — 525 p. — ISBN 978-92-832-1297-3.
- Environmental Health Criteria 215. Vinyl Chloride. — Geneva: World Health Organization, 1999. — 382 p. — ISBN 92-4-157215-9.
- Fazlul H. Molecular Modelling Analysis of the Metabolism of Vinyl Chloride (англ.) // Journal of Pharmacology and Toxicology. — 2006. — Vol. 1, no. 4. — P. 299-316. (недоступная ссылка)
- Hartmans S., De Bont J. A. Aerobic Vinyl Chloride Metabolism in Mycobacterium aurum LI (англ.) // Applied and Enviromental Microbiology. — 1992. — Vol. 58, no. 4. — P. 3878-3880.
- IUCLID Dataset. Vinyl Chloride (англ.) (pdf) (недоступная ссылка — история ). European Commission's Joint Research Centre (19 Feb 2000). Дата обращения 27 октября 2009. (недоступная ссылка)
- Plugge H., Safe S. Vinyl chloride metabolism — A review (англ.) // Chemosphere. — 1977. — Vol. 6, no. 6. — P. 309-325.
- Selikoff I. J., Hammond E. C. Toxicity of Vinyl Chloride — Polyvinyl Chloride. — Annals of New York Academy of Sciences. — New York: New York Academy of Sciences, 1975. — P. 337.
- Toxicological profile for vinyl chloride. — Agency for Toxic Substances and Disease Registry U.S. Public Health Service, 2006. — 328 p.
- Vinyl Chloride (BUA Report) / Gesellschaft Deutscher Chemiker Advisory Committee. — Wiley-VCH Verlag GmbH, 1992. — 99 p. — ISBN 978-3527285242.
- Vinyl Chloride in Drinking-water / Background document for development of WHO Guidelines for Drinking-water Quality. — World Health Organization, 2004. — 23 p.
- Vinyl chloride: health and safety guide / International Program on Chemical Safety, United Nations Environment Programme, International Labour Organisation, World Health Organization, Inter-Organization Programme for the Sound Management of Chemicals. — Geneva: World Health Organization, 1999. — 28 p. — ISBN 92-4-151109-5.









![{\displaystyle {\ce {CH2=CHCl{}+ 2 HF ->[{\ce {SnCl4}}] CH3-CHF2{}+ HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba7f6f18c056267dfe322003a88ad6871887538c)
![{\displaystyle {\ce {CH2=CH-Cl{}+ HBr ->[{\ce {ROOH}}] CH2Br-CH2Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/92265af5c2de414633c6447920fb4e45bc7c348b)
![{\displaystyle {\ce {CH2=CH-Cl{}+ HI ->[{\ce {I_2}}] CH3-CH(I)Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe166bfa3ac1dccbc563eb52a87f39dd51a9b707)

![{\displaystyle {\ce {CH2=CH-Cl{}+ HClO -> [ClCH2-CH(OH)Cl] -> ClCH2-CHO{}+ HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1bfd3f64698b8ba85f0becc7d2bd7607c82c13fa)
![{\displaystyle {\ce {CH2=CH-Cl{}+Cl2{}+CH3OH->ClCH2-CH(OCH3)Cl{}+HCl->[+~{\ce {CH3OH}}]ClCH2-CH(OCH3)2{}+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8452a89be50ada7b0d0eee417a6edbcb1b89e872)








![Реакция [2+2] циклоприсоединения винилхлорида к 1-изохинолону](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Vinyl-chloride-cycloaddition-to-isoquinolone.png/450px-Vinyl-chloride-cycloaddition-to-isoquinolone.png)
![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+CH_{3}COONa\ {\xrightarrow[ {CH_{3}COOH}]{PdCl_{2}}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!OCOCH_{3}+NaCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e0dca5b981978525bcc34a6792133d3c09bae6b)
![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+C_{2}H_{5}ONa\ {\xrightarrow[ {C_{2}H_{5}OH}]{100\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!OC_{2}H_{5}+NaCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82162f9cc9f5bad24489b2997394b469faae271c)
![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+HNRR'\ {\xrightarrow[ {t-BuONa,\ C_{6}H_{5}CH_{3},\ 70-90\ ^{o}C}]{PdCl_{2},\ [o-CH_{3}(C_{6}H_{4})]_{3}P}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!NRR'+HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/404a60a5ee715c9051adb58901d3d69dd2b49438)
![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+NH_{3}\ {\xrightarrow[ {Na-Hg}]{50\ ^{o}C}}\ (CH_{2}\!\!-\!\!CH_{2})NH+HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcb8d913978449e907e875a11a554388707bc58f)
![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+Mg\ {\xrightarrow[ {THF}]{40-50\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!MgCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d503588f404f4a7e6c127e4d4d4dba2b57227a4a)

![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2K\ {\xrightarrow[ {THF}]{Na,\ 0\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!K+KCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90c653578ca9d49c738a3e2d22cee948f08a892f)
![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2Li\ {\xrightarrow[ {THF}]{Na,\ 0-10\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!Li+LiCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bd2d256c4d1bca7ac6c997b6a022d34956d0c116)














![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+R\!\!-\!\!COCl\ {\xrightarrow {AlCl_{3}}}\ CH_{2}Cl\!\!-\!\!CHCl\!\!-\!\!C(O)R{\xrightarrow[ {-HCl}]\ }CHCl\!\!=\!\!CHC\!\!-\!\!C(O)R}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c0c7734dc0545f11322b1593dec2a71027ec757)

![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+5[O]\ {\xrightarrow {KMnO_{4},\ H_{2}O\ ,\ t^{o}}}\ 2CO_{2}+H_{2}O+HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/17886dd1a4b0df579973254276b72f3a0d3e496b)





![{\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2H_{2}\ {\xrightarrow[ {-HCl}]{Ni_{{Reney}},\ KOH}}\ CH_{3}\!\!-\!\!CH_{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f762b76b49d67598c4e89b67e4754b5442ed93f7)































![{\displaystyle {\ce {CH2=CHCl{}+ HCl ->[{\ce {FeCl3}}] CH3-CHCl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/21d585a0103dbd87f24b4ce3157351eb71b42211)
![{\displaystyle {\ce {CH3-CHCl2{}+Cl2->[{\text{370—400 °C}}]CH3-CCl3{}+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf7b36880fd2595f8a7aa3be2705518d3d769e5d)



