Введение
На рубеже XX и XXI веков мировое сообщество столкнулось с глобальной проблемой, имеющей не только медицинское, но и огромное социально‐экономическое значение – пандемией хронических неинфекционных болезней, которые ежегодно уносят миллионы жизней, приводят к тяжелым осложнениям, связанным с потерей трудоспособности и необходимостью высокозатратного лечения.
Среди них заболевания почек занимают важное место из‐за значительной распространенности в популяции, резкого снижения качества жизни, высокой смертности пациентов и приводят к необходимости применения дорогостоящих методов заместительной терапии в терминальной стадии – диализа и пересадки почки.
В то же время, развитие медицинской науки и фармакологии в конце XX века заложило основы для разработки новых высокоэффективных и доступных методов профилактики, позволяющих существенно замедлить прогрессирование хронических заболеваний почек, снизить риск развития осложнений и затраты на лечение. Такие подходы оказались применимы к подавляющему большинству пациентов с почечной патологией, независимо от ее причины.
Данные обстоятельства требуют от систем здравоохранения новой стратегии в отношении дефиниции и стратификации тяжести хронической почечной патологии. Назрела необходимость выработки простых критериев и универсальной классификации, позволяющих оценивать степень нарушения функции почек, прогноз и четко планировать те или иные лечебные воздействия. Общепризнанная унифицированная трактовка тяжести поражения почек необходима также для решения медико‐социальных и медико‐экономических проблем. Только на основе универсальных подходов и единой терминологии можно проводить адекватную оценку заболеваемости и распространенности, составлять региональные и национальные регистры пациентов с нарушением функции почек и на этой основе рассчитывать потребность в соответствующих методах лечения, а также планировать необходимые финансовые затраты.
Исторически первая попытка решения этих вопросов была инициирована в начале XXI века Национальным Почечным Фондом США (National Kidney Foundation – NKF). Проведенный анализ многочисленных публикаций по вопросам диагностики и лечения заболеваний почек, прогностической роли ряда показателей, терминологических понятий лег в основу концепции хронической болезни почек (ХБП – chronic kidney disease – CKD) [National Kidney Foundation KD: Clinical practice guidelines for chronic Kidney disease: Evaluation, classifcation and stratifcation. Am J Kidney Dis 2002;39 [Suppl 1]: S1–S266]. В дальнейшем в разработке данной модели принимали участие эксперты Европейской Почечной Ассоциации – Европейской Ассоциации Диализа и Трансплантации (ERA‐EDTA) [European Best Practice, 2002] и KDIGO (Kidney Disease: Improving Global Outcomes) [Levey AS и соавт., 2005; Levey AS и соавт., 2010].
К настоящему времени понятие ХБП и ее классификация получили мировое признание. Проблему ХБП, начиная с 2003 г., неоднократно обсуждали на различных форумах отечественных нефрологов, в связи с чем пленум Правления Научного общества нефрологов России (НОНР) (Москва, 17–18 октября 2007 г.), детально проанализировав данную проблему, счел необходимым разработать соответствующие Национальные Рекомендации.
Определение
Под ХБП следует понимать наличие любых маркеров, связанных с повреждением почек и персистирующих в течение более трех месяцев вне зависимости от нозологического диагноза.
Комментарий: Под маркерами повреждения почек следует понимать любые изменения, выявляющиеся при клинико‐лабораторном обследовании, которые отражают наличие патологического процесса в почечной ткани.
Эпидемиология
Рекомендация 1.1: Внедрение концепции ХБП в практическую работу системы национального здравоохранения следует рассматривать как важный стратегический подход к снижению общей и сердечно‐сосудистой смертности, увеличению продолжительности жизни населения, а также к снижению расходов на госпитальное лечение осложнений нарушения функции почек и проведение заместительной почечной терапии.
Распространенность ХБП сопоставима с такими социально значимыми заболеваниями, как гипертоническая болезнь и сахарный диабет, а также ожирение и метаболический синдром. Признаки повреждения почек и/или снижение скорости клубочковой фильтрации выявляют, как минимум, у каждого десятого представителя общей популяции. При этом сопоставимые цифры были получены как в индустриальных странах с высоким уровнем жизни, так и в развивающихся странах со средним и низким доходом населения.
Распространенность ХБП в мире по данным популяционных исследований
Страна | Исследование | Распространенность ХБП |
|---|
1-5 стадии, % | 3-5 стадии, % |
|---|
США | NHANES, 1999-2006 | 15 | 8,1 |
|---|
Нидерланды | PREVEND, 2005 | 17,6 | - |
|---|
Испания | EPIRCE, 2005 | 12,7 | - |
|---|
Китай | Beijing study, 2008 | 14 | 6,5 |
|---|
Япония | Imai и соавт., 2007 | - | 18,7 |
|---|
Австралия | AusDiab, 2008 | 13,4 | 7,7 |
|---|
Конго | Kinshasa study, 2009 | 12,4 | 8 |
|---|
Результаты проведенных эпидемиологических исследований в России показали, что проблема ХБП для нашей страны является не менее острой. Признаки хронической болезни почек отмечаются более чем у 1/3 больных с хронической сердечной недостаточностью; снижение функции почек наблюдается у 36% лиц в возрасте старше 60 лет, у лиц трудоспособного возраста; снижение функции отмечается в 16% случаев, а при наличии сердечно‐сосудистых заболеваний его частота возрастает до 26% [Добронравов ВА и соавт., 2004; Смирнов АВ и соавт., 2004; Бикбов БТ, Томилина НА, 2009; Шалягин ЮД и соавт., 2011]. Эти данные заставляют пересмотреть традиционное представление об относительной редкости болезней почек среди населения и требуют коренной перестройки системы оказания помощи этой категории больных.
По данным официальной статистики, почечная смертность относительно низка. Это связано с развитием методов заместительной терапии (диализ и трансплантация почки), а также с тем, что непосредственной причиной гибели пациентов с нарушенной функцией почек (на додиализном и диализном этапах лечения) являются сердечно‐сосудистые осложнения. Поэтому в официальных отчетах случаи смерти больных с нарушенной функцией почек учитываются как обусловленные сердечно‐сосудистыми причинами, а роль заболевания почек, как основного фактора сердечно‐сосудистого риска, игнорируется.
Снижение функции почек, по современным представлениям, является самостоятельной и важной причиной ускоренного развития патологических изменений сердечно‐сосудистой системы. Это обусловлено рядом метаболических и гемодинамических нарушений, которые развиваются у больных со сниженной скоростью клубочковой фильтрации, когда возникают и выходят на первый план нетрадиционные, «почечные» факторы сердечно‐сосудистого риска: альбуминурия/протеинурия, системное воспаление, оксидативный стресс, анемия, гипергомоцистеинемия и др. [Смирнов АВ и соавт., 2005].
Оказание помощи пациентам с ХБП требует высоких материальных затрат. [Смирнов АВ и соавт., 2006; Бикбов БТ, Томилина НА, 2009; Xue JL и соавт., 2001; Bommer J, 2002; Schiepati A, Remuzzi G, 2005]. В первую очередь, это касается проведения заместительной почечной терапии – диализа и трансплантации почки, которая жизненно необходима пациентам с терминальной почечной недостаточностью, развивающейся в исходе нефропатий различной природы. По ориентировочным оценкам во всем мире на программы диализа в начале 2000‐х годов ежегодно выделялось 70–75 млрд $ [Xue JL и соавт., 2001]. В США расходная часть бюджета системы Medicare, направляемая на обеспечение заместительной почечной терапии, достигает 5%, тогда как доля этих пациентов составляет всего 0,7% от общего числа больных, охваченных данной системой [U.S. Renal Data System, 2004].
В России, по данным Регистра Российского диализного общества, в 2007 году различные виды заместительной почечной терапии получали более 20 000 человек, ежегодный прирост числа этих больных в среднем составляет 10,5%. В нашей стране средний возраст больных, получающих заместительную почечную терапию, составляет 47 лет, т.е. в значительной мере страдает молодая, трудоспособная часть населения. На сегодняшний день, несмотря на определенный прогресс в развитии заместительной почечной терапии в России в течение последних 10 лет, обеспеченность населения РФ этими видами лечения остается в 2,5–7 раз ниже, чем в странах Евросоюза, в 12 раз ниже, чем в США [Бикбов БТ, Томилина НА, 2009]. В то же время, возможности нефропротективной терапии, которая позволяет затормозить прогрессирование ХБП и стабилизировать функцию почек, а затраты на которую в 100 раз ниже, чем на заместительную почечную терапию, используются неэффективно.
Таким образом, быстрый рост в популяции числа больных со сниженной функцией почек – не узкоспециальная, а общемедицинская междисциплинарная проблема, имеющая серьезные социально‐экономические последствия [Смирнов АВ, 2005; Мухин НА, 2008; Remuzzi G и соавт., 2004; de Portu S и соавт., 2011]. Она требует, с одной стороны, перестройки и усиления нефрологической службы – не только за счет открытия новых диализных центров и развития трансплантологии, но и укрепления ее структур, направленных на проведение этиотропного, патогенетического и нефропротективного лечения с целью предотвращения терминальной почечной недостаточности. С другой стороны – необходима всемерная интеграция нефрологии и первичного звена здравоохранения, а также других специальностей с целью проведения широких профилактических мероприятий, ранней диагностики ХБП, обеспечения преемственности лечения и эффективного использования имеющихся ресурсов.
Концепция ХБП, обеспечивающая унификацию подходов как к профилактике, так и диагностике, и лечению нефропатий разной природы, создает предпосылки для решения этих важных задач здравоохранения.
Классификация
Рекомендация 2.5: В практической работе ХБП следует разделять на стадии в зависимости от значений скорости клубочковой фильтрации.
Суммарный анализ многочисленных публикаций, частично цитированных выше, показал, что почечный и кардиоваскулярный прогноз существенно зависит от величины СКФ. Поэтому уже в первом варианте классификации ХБП было предложено разделять ее на пять стадий [National Kidney Foundation KD: … 2002].
Этот основной принцип стратификации тяжести ХБП сохраняется до настоящего времени. С другой стороны, накопление новых данных заставило несколько его модифицировать. Прежде всего, это касается третьей стадии ХБП.
Такое разделение целесообразно, поскольку почечный и сердечно‐сосудистый прогнозы неодинаковы в группах лиц с ХБП 3 ст. с СКФ от 59 до 45 мл/мин/1,73 м2 и от 44 до 30 мл/мин/1,73 м2. Если в подгруппе лиц с СКФ от 59 до 45 мл/мин/1,73 м2 весьма высоки сердечно‐сосудистые риски при умеренных темпах прогрессирования ХБП, то у пациентов с градацией СКФ в пределах от 44 до 30 мл/мин/1,73 м2 риск развития ТПН оказывается выше, чем риск летальных сердечнососудистых осложнений [Go AS и соавт., 2004; Levey AS и соавт., 2005; Glynn LG и соавт., 2007; Levey AS и соавт., 2010].
Целесообразность градации 3 стадии ХБП на две подстадии (3а и 3б) была обоснована в «Рекомендациях Научноисследовательского института нефрологии Санкт‐Петербургского государственного медицинского университета им. акад. И.П. Павлова: определение, классификация, диагностика и основные направления профилактики хронической болезни почек у взрослых», опубликованных в 2008 г. [Смирнов АВ и соавт., 2008].
Позже необходимость такого подхода была поддержана другими отечественными специалистами [Шилов ЕМ и соавт., 2011]. Кроме того, на представительной конференции в октябре 2009 г. в Лондоне эксперты KDIGO также пришли к консенсусу по этому вопросу. Поэтому в настоящее время следует рекомендовать следующую стратификацию тяжести ХБП по уровню СКФ.
Стратификация стадий ХБП по уровню СКФ
Обозначение | Характеристика | Уровень СКФ (мл/мин/1,73м2) |
|---|
С 1 | Высокая или оптимальная | >90 |
|---|
С 2 | Незначительно сниженная | 60-89 |
|---|
С 3а | Умеренно сниженная | 45-59 |
|---|
С 3б | Существенно сниженная | 30-44 |
|---|
С 4 | Резко сниженная | 15-29 |
|---|
С 5 | Терминальная почечная недостаточность | <15 |
|---|
Рекомендация 2.6: Каждую стадию ХБП следует индексировать в зависимости от выраженности альбуминурии/протеинурии; для случаев заместительной почечной терапии следует указывать ее вид – диализ (Д) и трансплантация (Т).
Имеющиеся к настоящему времени данные, включая и метаанализ более 1.5 млн наблюдений [Levey AS и соавт., 2010, 2011], определенно указывают на то, что риски общей и сердечно‐сосудистой смертности, развития ТПН, острого повреждения почек и прогрессирования ХБП существенно отличаются в зависимости от уровня мочевой экскреции альбумина в любом диапазоне СКФ.
В таблице представлена модификация стратификации мочевой экскреции альбумина, предложенная KDIGO [Levey AS и соавт., 2010].
Индексация альбуминурии/протеинурии
Индексация, описание и границы (альбумин, мг / креатинин, г) |
|---|
А0 | А1 | А2 | А3 | А4 |
|---|
Оптимальная | Повышенная | Высокая | Очень высокая | Нефротическая |
<10 | 10-29 | 30-299 | 300-1999 (соответствует суточной протеинурии >=0,5г) | >=2000 (соответствует суточной протеинурии >=3,5г) |
У больных с А3–А4, что соответствует протеинурии >0,5 г/сут, для оценки тяжести поражения почек вместо исследования альбуминурии, с точки зрения экономии бюджета, можно использовать определение общего белка в суточной моче (суточная протеинурия) или отношения общий белок/креатинин в утренней порции мочи.
Очевидно, что у больных, получающих лечение постоянным гемодиализом или перитонеальным диализом, необходимости в индексации альбуминурии/протеинурии нет.
Диагностика: критерии
Критерием снижения функции почек является уровень скорости клубочковой фильтрации, стандартизированной на поверхность тела, находящийся ниже нормальных значений, т.е. ниже 90 мл/мин/1,73 м2.
СКФ в пределах 60–89 мл/мин/1,73 м2 расценивают как начальное или незначительное ее снижение. Для установления ХБП в этом случае необходимо наличие также и маркеров почечного повреждения.
При их отсутствии ХБП не диагностируется. Для лиц 65 лет и старше это расценивают как вариант возрастной нормы. Лиц моложе этого возраста относят в группу высокого риска развития ХБП, им рекомендуют контроль состояния почек не реже 1 раза в год, активную профилактику ХБП.
Если СКФ ниже 60–89 мл/мин/1,73 м2, наличие ХБП устанавливается даже при отсутствии каких‐либо маркеров почечного повреждения.
3‐месячное ограничение (критерий «стойкости») в качестве временного параметра определения ХБП было выбрано потому, что в данные сроки острые варианты развития дисфункции почек, как правило, завершаются выздоровлением или приводят к очевидным клинико‐морфологическим признакам хронизации процесса.
ХБП – понятие наднозологическое и в тоже время не является формальным объединением хронических почечных заболеваний различной природы в одну большую аморфную группу, подменяя этиологический принцип. Понятие ХБП, с одной стороны, отражает наличие общих факторов риска развития и прогрессирования нефропатий, универсальных механизмов формирования нефросклероза и вытекающих отсюда способов первичной и вторичной профилактики, а также наличие общего исхода – терминальной почечной недостаточности.
Следует подчеркнуть, что понятие ХБП не отменяет нозологический подход к диагностике заболеваний почек. Необходимо добиваться идентификации конкретной причины (или причин) развития повреждения почек для того, чтобы установить нозологический диагноз и максимально рано назначить соответствующую этиотропную и патогенетическую терапию. В то же время, концепция ХБП при разных нозологических формах является универсальным инструментом для определения степени нарушения функции, расчета риска развития терминальной почечной недостаточности и сердечнососудистых осложнений, планирования и оценки эффективности нефропротективного лечения, подготовки и начала заместительной почечной терапии.
Основные признаки, позволяющие предполагать наличие хронической болезни почек
Маркер | Примечания |
|---|
Повышенная альбуминурия/протеинурия | У каждого больного с ХБП следует выполнять исследование уровня альбуминурии/протеинурии, поскольку этот показатель имеет важное значение для диагностики ХБП, оценки прогноза ее течения, риска сердечно‐сосудистых осложнений, а также выбора тактики лечения. |
Стойкие изменения в осадке мочи | Эритроцитурия (гематурия), цилиндрурия, лейкоцитурия (пиурия) |
Изменения электролитного состава крови и мочи | Изменения сывороточной и мочевой концентрации электролитов, нарушение кислотно-щелочного равновесия и др. (в том числе характерные для синдрома "канальцевой дисфункции", синдром Фанкони, почечные тубулярные фцидозы, синдромы Барттера и Гительмана, нефрогенный несахарный диабет и т.д.) |
Изменения почек по данным лучевых методов исследования | Изменения развития почек, кисты, гидронефроз, изменения размеров почек и др. |
Патоморфологические изменения в ткани почек, выявленные при прижизненной нефропсии | Признаки активного необратимого повреждения почечных структур, специфические для каждого хронического заболевания почек, и универсальные маркеры нефросклероза, указывающие на "хронизацию" процесса. |
Стойкое снижение скорости клубочковой фильтрации менее 60 мл/мин/1,73 м2 | Указывает на наличие ХБП даже при отсутствии повышенной альбуминурии/протеинурии и других маркеров повреждения почек. |
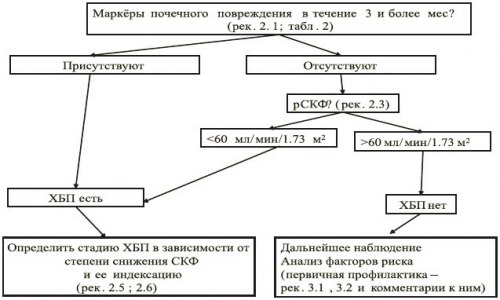
Рекомендация 2.2: Диагноз ХБП следует устанавливать на основании следующих критериев:
Диагностика ХБП может базироваться на выявлении любых морфологических и клинических маркеров почечного повреждения в зависимости от клинической ситуации. Для постановки диагноза ХБП целесообразно руководствоваться следующим алгоритмом.
В соответствии с определением, для диагностики ХБП необходимо подтверждение наличия маркеров повреждения почек при повторных исследованиях, как минимум, в течение 3 мес. Такой же интервал необходим для подтверждения снижения уровня СКФ<60 мл/мин, в том случае, если СКФ<60 мл/мин выступает в роли единственного маркера ХБП. Для диагностики ХБП может оказаться достаточным однократное исследование, если оно недвусмысленно указывает на необратимые структурные изменения органа (данные визуализирующих инструментальных методов или прижизненного морфологического исследования).
Алгоритм диагностики ХБП
- выявление любых клинических маркеров повреждения почек, подтвержденных на протяжении периода длительностью не менее 3 месяцев;
- наличие маркеров необратимых структурных изменений органа, выявленных однократно при прижизненном морфологическом исследовании органа или при его визуализации;
- снижение скорости клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2, сохраняющееся в течение трех и более месяцев, вне зависимости от наличия других признаков повреждения почек.
Рекомендация 2.3: Для оценки СКФ в широкой (амбулаторной) клинической практике целесообразно применять значения этого показателя, полученные на основании расчетных формул (рСКФ), включающих пол, возраст пациента и концентрацию креатинина в сыворотке крови; клиренсовые методы при необходимости наиболее точного определения СКФ предпочтительно использовать в условиях стационара.
Рекомендация 2.3.1: У больных ХБП недопустимо использование только концентрации креатинина в сыворотке крови с целью оценки функции почек; каждое определение концентрации креатинина в сыворотке крови или указание на него в медицинской документации должно сопровождаться расчетом СКФ.
До настоящего времени нет метода исследования СКФ, безупречного с точки зрения точности, доступности и удобства использования.
Наиболее точными являются клиренсовые методы оценки функции почек – по клиренсу экзогенных веществ: инулина, 51Cr‐ЭДТА (этилендиаминтетрауксусная кислота), 99mTcDTPA (диэтилентриаминопентауксусная кислота), 125I‐йоталамата или йогексола, которые вводятся в кровь. Они остаются «золотым стандартом» измерения СКФ, однако техническая сложность и трудоемкость, необходимость введения чужеродного вещества в кровь, высокая стоимость ограничивают их применение. В настоящее время они используются в научных исследованиях, а также в клинических ситуациях, когда требуется максимально точное определение СКФ, например, при оценке функции почек на фоне химиотерапии или у потенциального родственного донора. Радиоизотопные методы исследования СКФ позволяют раздельно оценить функциональное состояние правой и левой почки, что имеет значение при заболеваниях с односторонним поражением, некоторых аномалиях почек и т.д. Клиренсовые методы исследования СКФ с использованием экзогенных веществ являются стандартными для проверки точности всех других методов.
Оценка СКФ по клиренсу эндогенного вещества – креатинина, который поступает в кровь естественным образом в процессе самообновления мышечной ткани с примерно постоянной скоростью, более удобно, хотя и менее точно, чем по клиренсу экзогенных веществ. Проводится проба Реберга–Тареева, основанная на сборе мочи в течение 24 ч. Определяется объем суточной мочи, концентрация креатинина в суточной моче и в крови, взятой после завершения пробы. СКФ рассчитывается по приведенной формуле.
Формула для оценки СКФ по клиренсу креатинина (в пробе Реберга–Тареева):
где V – объем мочи, собранной за сутки, мл; UCr – концентрация креатинина в суточной моче; SCr –концентрация креатинина в сыворотке крови, взятой в конце пробы.
Полученный результат необходимо стандартизировать на площадь поверхности тела пациента, которая может быть рассчитана по формулам Дюбуа или Хейкока.
Стандартизация СКФ на площадь поверхности тела пациента (Sтела):
Sтела рассчитывается:
Сбор суточной мочи представляет определенные затруднения для пациентов, особенно амбулаторных. Кроме того, высока вероятность ошибки, связанной с неправильным сбором мочи или неточным измерением ее объема. Для точности пробы необходим достаточный суточный диурез (не менее 1000 мл).
В широкой практике, учитывая трудности, связанные с проведением пробы Реберга–Тареева, состояние функции почек было принято оценивать по уровню креатинина сыворотки крови, поскольку он находится в обратной, хотя и нелинейной зависимости от СКФ. Как показали многочисленные исследования, такой подход является грубым, неточным и поэтому некорректным. Он не учитывает различные факторы, помимо клубочковой фильтрации, оказывающие влияние на кинетику креатинина: величину мышечной массы, которая определяет скорость поступления креатинина в кровь и зависит от пола и возраста, а также канальцевую секрецию креатинина, которая у здоровых людей не превышает 10% от общего количества выводимого с мочой креатинина, а у больных с 3б‐5 стадиями ХБП может превышать 40%. Таким образом, у пожилых людей, женщин, лиц с небольшой мышечной массой, при выраженных стадиях ХБП использование уровня креатинина крови для оценки функции почек приводит к ошибке – завышению СКФ по сравнению с ее истинным значением, определяемым при помощи клиренсовых методов с использованием экзогенных веществ, а значит, недооценке тяжести ХБП.
Уровень креатинина, превышающий референсные значения, безусловно, свидетельствует о нарушении функции почек.
Однако важно подчеркнуть, что во многих случаях и при значениях креатинина, укладывающихся в референсные пределы, СКФ может быть существенно снижена.
По современным представлениям, уровень сывороточного креатинина вследствие указанных погрешностей не может быть использован ни для оценки выраженности дисфункции почек, ни для решения вопроса о начале заместительной терапии.
С начала 70‐х годов прошлого века делаются попытки разработать формулу, которая позволила бы, определив уровень креатинина сыворотки крови и несколько дополнительных показателей, влияющих на его образование в организме, получить расчетную СКФ, наиболее близкую по значению к истинной СКФ, измеренной по клиренсу инулина или другими точными методами.
Первой формулой, получившей широкое применение в нефрологии, клинической фармакологии и других областях медицины, стала формула Кокрофта–Голта [Cockcroft DW, Gault MH, 1976]. Она проста, однако полученное значение желательно стандартизировать на поверхность тела пациента, что значительно усложняет расчеты.
В 90‐е годы группой экспертов на основании данных исследования MDRD (Modifcation of Diet in Renal Disease) [Levey AS и соавт., 1999] были предложены новые уравнения, более точные, чем формула Кокрофта–Голта, и не требующие дополнительной стандартизации на поверхность тела, а также знания антропометрических показателей, получившие название формул MDRD. Чтобы рассчитать СКФ при помощи сокращенного варианта формулы MDRD, достаточно знать уровень креатинина сыворотки крови, пол, возраст и расу пациента, что делает ее очень удобной для скрининговых исследований и амбулаторной практики. Однако формула MDRD имеет ряд существенных недостатков. На 3–5 стадиях ХБП она точнее отражает функцию, чем формула Cockcroft–Gault, однако при истинной СКФ выше 60 мл/мин/1,73 м2 она дает неточные (заниженные) результаты [Hallan S и соавт., 2004; Ma YC и соавт., 2006; Ibrahim S и соавт., 2008]. Уравнения MDRD, полученные при обследовании популяции Северной Америки, некорректно отражают уровень СКФ у представителей монголоидной расы и ряда этносов [Matsuo S и соавт., 2009], что актуально для многонационального населения России.
В 2009–2011 гг. той же группой исследователей был разработан наиболее универсальный и точный метод расчета СКФ, работающий на любой стадии ХБП и у представителей всех трех рас – уравнения CKD‐EPI.
Уравнения CKD‐EPI, 2009 г., модификация 2011
Нужный вариант выбирается в зависимости от расы, пола и уровня креатинина сыворотки пациента.
Разработчикам удалось преодолеть обе причины искажений: влияние различий в мышечной массе лиц разного возраста и пола и ошибку, связанную с активацией канальцевой секреции креатинина на поздних стадиях ХБП. Формула создана на основании базы данных, включающей 8254 больных. Ее точность была проверена на 4014 пациентах из США и Европы и 1022 больных из Китая, Японии и Южной Африки (у японцев и южноафриканцев она давала значительную погрешность). Она является наиболее универсальной и точной из всех используемых на сегодня формул.
Результаты исследований, выполненных в Санкт‐Петербургском Научно‐исследовательском институте нефрологии, показали, что стратификация стадий ХБП на основе CKD‐EPI‐метода оценки СКФ довольно близко совпадает с данными, полученными с помощью референтного метода – плазматического клиренса 99mTcDTPA.
Полученные данные позволяют рекомендовать CKD‐EPI‐метод оценки рСКФ как наиболее оптимальный для амбулаторной клинической практики в настоящее время. Дополнительной стандартизации на поверхность тела, так же как при использовании формулы MDRD, не требуется.
Для удобства пользования формулой разработаны компьютерные программы и номограммы. Для широкого внедрения расчетных методов оценки функции почек рекомендуется, чтобы каждое определение уровня креатинина сыворотки в биохимической лаборатории сопровождалось расчетом СКФ по уравнениям CKD‐EPI, которые должны быть заложены в программное обеспечение лаборатории. В бланке лаборатории, помимо уровня креатинина сыворотки, должен обязательно указываться уровень СКФ, рассчитанный по формуле CKD‐EPI для данного больного.
Формулы CKD‐EPI, MDRD, Кокрофта–Голта разработаны для взрослых. Для оценки функции почек у детей используется формула Шварца (Schwartz):
где Рост, см; SCr – концентрация креатинина в сыворотке крови; k – возрастной коэффициент.
Таким образом, на сегодняшний день в медицинской практике используются целый ряд формул для расчета СКФ. У взрослых наиболее безупречным, с точки зрения универсальности и точности, является метод CKD‐EPI, который вытесняет устаревшие формулы MDRD и Кокрофта–Голта. С целью унификации подходов к диагностике ХБП НОНР рекомендует оценивать СКФ у взрослых методом CKDEPI.
У детей рекомендуется использовать формулу Шварца.
Существуют ряд ситуаций, в которых использование расчетных методов оценки СКФ некорректно:
В таких обстоятельствах необходимо воспользоваться, как минимум, стандартным измерением клиренса эндогенного креатинина (проба Реберга–Тареева) или другими клиренсовыми методами (обычно плазматическими или почечными клиренсами комплексонов или рентгеновских контрастов).
Сравнительная характеристика методов оценки скорости клубочковой фильтрации (СКФ)
Метод определения СКФ | Технические особенности | Достоинства | Ограничения | Область применения |
|---|
По клиренсу экзогенных веществ (инулина, гломерулотропных радиофармацевтических препаратов и др.) | В кровь вводится вещество, обладающее следующими свойствами:полностью выводится путем клубочковой фильтрации, при этом не реабсорбируется, не секретируется и не разрушается в почечных канальцах и мочевых путях. через определенный промежуток времени исследуется концентрация данного вещества в крови пациента и в объеме мочи, собранной за это время (или определяется только только концентрация вещества в плазме крови через определенные промежутки времени), на основании чего расчитывается клиренс. Проводится стандартизация на поверхность тела. | Высокая точность | Дорогостоящие,технически сложные и инвазивные исследования, требующие введения в организм чужеродного вещества | Необходимость особо точного измерения СКФ (например, прогнозирование начала диализа, у потенциальных доноров, при подборе доз химиопрепаратов, научные исследования) |
|---|
По клиренсу креатинина (проба Реберга-Тареева) | Определяется концентрация креатинина в сыворотке крови пациента и пробе мочи, собранной накануне за сутки. На основании концентрации креатинина, объема мочи и времени исследования (24ч=1440 мин) расчитывается клиренс креатинина. Проводится стандартизация на поверхность тела. | Приемлемаяточность.Может применяться у людей с нестандартной мышечной массой и скоростью поступления креатинина в кровь. | Требуется сбор суточной мочи. Возможны погрешности вследствие неправильного сбора и измерения ее объема. У пациентов с 3б-5 стадиями может завышать значение СКФ | Обследование стационарных больных. Уточнение результатов, полученных при помощи формул, для решения принципиальных лечебно-диагностических и экспертных вопросов. Использование в случаях, когда формулы не применимы |
|---|
Расчет по формулам | Определяется концентрация креатинина в сыворотке крови. На основании ее значения с учетом пола и возраста пациента по специальным формулам (MDRD или CKD-EPI) расчитывается уровень СКФ. При использовании формулы Кокрофта-Голта необходима дополнительная стандартизация на поверхность тела, более современные формулы этого не требуют | Не требуют сбора суточной мочи и исключают возможные связанные с ним ошибки. Учитывают усиливающуюся канальцевую секрецию креатенина у пациентов 3б-5 стадиями ХБП, предотвращая завышение значение СКФ. Формулы оценивают антропометрические, гендерные и возрастные особенности, влияющие на кинетику креатинина. | В ряде ситуаций недостаточно точны и не рекомендуются к применению у людей с нестандартными размерами тела и мышечной массой. | Скрининг ХБП, амбулаторные обследования пациентов с ХБП и условно здорового населения. Динамический контроль амбулаторных и стационарных пациентов. |
|---|
Рекомендация 2.4: У каждого больного с ХБП следует выполнять исследование уровня альбуминурии/протеинурии, поскольку этот показатель имеет важное значение для диагностики ХБП, оценки прогноза ее течения, риска сердечно‐сосудистых осложнений, а также выбора тактики лечения.
Рекомендация 2.4.1: Для оценки альбуминурии/протеинурии следует определять ее уровень в суточной моче или отношение альбумин/креатинин, или общий белок/креатинин в разовой, предпочтительно утренней порции мочи.
Рекомендация 2.4.2: Исследование экскреции альбумина с мочой следует проводить с целью диагностики и мониторинга ХБП при отсутствии протеинурии в разовых порциях мочи или уровне протеинурии <0,5 г/сут (или ее эквивалента по определению отношения общий белок мочи/креатинин мочи).
Имеющиеся в настоящее время данные позволяют утверждать, что скрининг и диагностика ХБП, основанные только на расчете СКФ, не являются клинически и экономически эффективной стратегией предупреждения терминальной почечной недостаточности (ТПН) и сердечно‐сосудистых заболеваний. Одновременная оценка двух основных показателей – СКФ и альбуминурии/протеинурии – занимает центральное место в первичной диагностике ХБП так же и потому, что эти показатели используются для определения прогноза, контроля течения и/или темпов прогрессирования на фоне терапии. Следует иметь в виду, что для ранних стадий ХБП (1–2) характерно бессимптомное течение, а явные клинические проявления и изменения почек, по данным визуализирующих методов сследования, как правило, указывают на далеко зашедший процесс. В клинической практике при отсутствии любых других признаков хронического повреждения почек повышенный уровень альбуминурии может быть единственным показателем, отражающим субклиническое течение ХБП.
В особенности это касается медленно развивающихся почечных процессов, таких как сосудистые поражения почек в результате артериальной гипертензии, диабета, ожирения, что является принципиально важным для осуществления мер по вторичной профилактике сердечно‐сосудистых осложнений и прогрессирования ХБП.
Значения k для формулы Шварца
Возраст | k для SCr, мг/100 мл | k для SCr, мкмоль/л |
|---|
<1 года | 0,33 | 29 |
>1 года | 0,45 | 40 |
2-12 лет | 0,55 | 49 |
13-21 год М | 0,7 | 62 |
ж | 0,55 | 49 |
- нестандартные размеры тела (пациенты с ампутацией конечностей, бодибилдеры);
- выраженные истощение и ожирение (ИМТ<15 и >40 кг/м2);
- беременность;
- заболевания скелетной мускулатуры (миодистрофии);
- параплегия и квадриплегия;
- вегетарианская диета;
- быстрое снижение функции почек (острый и быстро прогрессирующий гломерулонефрит, острое почечное повреждение);
- необходимость назначения токсичных препаратов, выводимых почками (например химиотерапия)
- для определения их безопасной дозы;
- при решении вопроса о начале заместительной почечной терапии;
- больные с почечным трансплантатом.
Альбуминурия/протеинурия в концепции ХБП‐K/DOQI рассматривается как маркер ренальной дисфункции. Однако физиологическое и клиническое значение этого показателя является более широким.
Данный признак отражает, по крайней мере, следующие патофизиологические сдвиги:
Учитывая вышесказанное, альбуминурию можно и нужно считать кардинальной интегральной характеристикой ХБП, а не только ее «маркером» [Смирнов АВ и соавт., 2010].
Общепринятой считалась следующая градация выраженности экскреции альбумина с мочой: «нормоальбуминурия» – <30 мг/cут (30 мг/г креатинина мочи), «микроальбуминурия» – 30–299 мг/сут (30–299 мг/г креатинина мочи), «макроальбуминурия/протеинурию» – >300 мг /сут (>300 мг/г креатинина мочи). Тем не менее, при использовании альбуминурии для диагностики и классификации ХБП существенным и пока дискутируемым моментом остается граница нормального значения этого показателя [Смирнов АВ и соавт., 2008; Смирнов АВ и соавт., 2010; Levey AS и соавт., 2005; Levey AS и соавт., 2010].
Длительное время «нормальным» уровнем альбуминурии считали его мочевую экскрецию <30 мг/сут. В «Рекомендациях Научно‐исследовательского института нефрологии Санкт‐Петербургского государственного медицинского университета им. акад. И.П. Павлова» в качестве нижней границы нормы был предложен более «строгий» показатель мочевой экскреции альбумина – 15 мг/сут (или15 мг альбумина/г креатинина мочи) [Смирнов АВ и соавт., 2008]. Однако накопленные в настоящее время сведения делают более обоснованной верхнюю границу нормы экскреции альбумина почками 10 мг/сут (или 10 мг альбумина/г креатинина мочи), поскольку уровень экскреции альбумина в диапазоне 10–29 мг/сут отчетливо ассоциируется с повышением рисков общей и сердечно‐сосудистой смертности [Brantsma AH и соавт., 2005; Forman JP, Brenner BM, 2005; Klausen KP и соавт., 2005; Schmieder RE и соавт., 2007; Levey AS и соавт., 2010].
Проблема градации альбуминурии/протеинурии стала предметом дискуссии на Лондонской конференции KDIGO 2009 г.
Были оставлены прежние градации выраженности альбуминурии («стадии альбуминурии») – <30; 30–299; >300 мг альбумина/г креатинина мочи. Вместо традиционной терминологии «нормоальбуминурия‐микроальбуминурия‐макроальбуминурия/протеинурия» для описания выраженности мочевой экскреции альбумина (МЭА) предложено использовать определения «оптимальный» (<10 мг/г), «высоконормальный» (10–29 мг/г), «высокий» (30–299 мг/г), «очень высокий» (300–1999 мг/г) и «нефротический» (>2000 мг/г). Использование терминов «нормоальбуминурия», «микроальбуминурия», «макроальбуминурия» в настоящее время представляется нежелательным [Levey AS и соавт., 2010].
- повышение проницаемости клеточных мембран (размер‐селективность, заряд‐селективность);
- изменения транспортных процессов в проксимальных канальцах;
- повышение гемодинамической нагрузки на клубочек;
- наличие системной и ренальной эндотелиальной дисфункции.
Примеры формулировки диагноза
Рекомендация 2.7: В каждом случае ХБП следует стремиться к идентификации конкретной этиологической причины (или причин) развития повреждения почек (нозологии). В исключительных случаях диагноз ХБП может быть установлен без детализации (диагностики) ее причины или до проведения окончательной диагностики, или когда диагноз почечного заболевания не удается установить, несмотря на тщательно проведенное обследование.
Рекомендация 2.7.1: В медицинской документации на первом месте следует указывать нозологический диагноз и основные проявления заболевания; термин ХБП с указанием стадии по СКФ, индекса альбуминурии/протеинурии и вид ЗПТ следует отмечать после описания нозологической формы.
Следует подчеркнуть, что понятие ХБП, в первую очередь, направлено на необходимость выявления факта персистирующего повреждения почек и оценки их глобальной функции. В то же время, оно ни в коей мере не отменяет этиологического подхода к диагностике и терапии конкретного заболевания почек.
Необходимость установления нозологического диагноза и включение первичной патологии почек в концепцию ХБП вновь были подчеркнуты в последних предложениях KDIGO [Levey AS и соавт., 2010], что так же соответствует и традициям отечественной медицины.
Термин ХБП должен указываться в диагнозе после описания нозологической формы и проявлений основного почечного заболевания.
Примеры формулировки диагноза:
При временной неопределенности конкретных причин повреждения почек, а также при невозможности уточнения этиологического диагноза, употребляется только термин «ХБП» с указанием стадии, что позволяет оценить текущий прогноз заболевания и объем лечебных мероприятий [Levey AS и соавт., 2005].
Следует отметить, что соответствующие изменения были внесены в МКБ‐10 [http://www.who.int/classifcations/icd/ICD10%20Updates%202007.pdf], в которой устаревший термин «хроническая почечная недостаточность» был заменен на термин «хроническая болезнь почек» (код N18). Коды N18.1–N18.5 следует использовать для обозначения стадий ХБП (табл. 8). Это устраняет препятствия для широкого внедрения диагноза ХБП в отечественную практику медицинского статистического учета, использующую для кодировки заболеваний систему МБК‐10.
Соответствие стадий ХБП кодировке МКБ‐10 (с изменениями от октября 2007 г.)
Стадии ХБП | Код МКБ-10 |
|---|
С1 | N18.1 |
С2 | N18.2 |
С3а | N18.3 |
С3б |
С4 | N18.4 |
С5 | N18.5 |
- Сахарный диабет, тип 2. Диабетический гломерулосклероз. ХБП С3а А3
- Гипертоническая болезнь III ст. Риск 4. Гипертонический нефросклероз. ХБП С3а А1
- Фокально‐сегментарный гломерулосклероз. Нефротический синдром. ХБП С3а А4
- IgA‐нефропатия. Изолированный мочевой синдром. ХБП С3б А3.
- Мембранопролиферативный гломерулонефрит. Нефротический синдром. ХБП 5д (постоянный гемодиализ с 12.05.2010).
- IgA‐нефропатия. Остронефритический синдром. Постоянный гемодиализ с 15.03.2008 по 17.04.2010. Аллотрансплантация почки от родственного донора от 18.04.2010. ХБП С1А3т.